不同浓度硫酸新霉素对生物絮团氨氮转化速率及抗生素抗性基因的影响
2023-07-31杨逸尊罗国芝谭洪新
杨逸尊,罗国芝,2,3,谭洪新,2,3
(1.上海海洋大学,上海水产养殖工程技术研究中心,上海 201306;2.上海市水产动物良种创制与绿色养殖协同创新中心,上海 201306;3.上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
近几年来,抗生素抗性基因引起了越来越多的关注[1,2],而水产养殖行业被越来越多地认为是抗生素抗性细菌的重要来源和抗生素抗性基因的贮存库[3]。宏基因组学分析表明,抗生素选择压力显著影响了抗生素抗性基因谱的组成,显著促进了抗生素抗性基因的富集,包括相应的和非相应的抗生素抗性基因类型[4]。形成各种抗生素抗性基因的共存组合,共同选择多种抗生素耐药性。ZHAO等[5]发现在同一种抗生素选择压力下,非对应抗生素抗性基因的丰度也升高,表明抗生素具有显著的共选择效应,表现出抗生素的特异型。
生物絮凝技术(biofloc technology,BFT)作为一种新兴的养殖技术,其主体生物絮团主要是水体中的大量微生物、饲料粪便残渣、有机碎屑和一些聚合物通过复杂作用相互絮凝而成的细菌团[6]。目前,国内外对于抗生素在生物絮凝养殖技术中的使用研究较少,而硫酸新霉素在各种养殖及水处理系统中的使用也鲜有关注,故本实验选取了硫酸新霉素这种常用渔药,来探究不同浓度硫酸新霉素对生物絮团水质处理能力及抗生素抗性基因的影响。水体中细菌对硫酸新霉素产生耐药性共有三种途径[7],其中最具普适性的就是由细菌自身产生修饰氨基糖苷类抗生素的酶,而这种修饰氨基糖苷类的酶又可以细分为三种,一种是以aph基因为代表的对氨基糖苷磷酸转移酶进行编码的抗生素抗性基因,一种是以aac基因为代表的对氨基糖苷乙酰转移酶进行编码的抗生素抗性基因,最后一种就是以ant基因为代表的对氨基糖苷核苷转移酶进行编码的抗生素抗性基因。本实验选取了5种硫酸新霉素抗性基因,包含了三种类别的氨基糖苷修饰基因,为用药后抗性基因的积累给出数据支持,也为抗生素在生物絮凝养殖技术中的使用提供参考。
1 材料与方法
1.1 实验装置与材料
实验在上海海洋大学循环水养殖与工程实验室内进行,实验室为封闭空间,温度设定为25 ℃。反应容器为10 L透明圆柱形塑料桶,使用功率为370 W的气泵(森森集团股份有限公司,型号:HG-370)进行曝气,气石为球形石英曝气石,置于反应容器中心使水体和空气充分且均匀接触。实验用水经过提前24 h充分曝气以去除水中残留氯。絮团取自上海海洋大学循环水养殖与工程实验基地未添加过抗生素的罗非鱼养殖池,养殖密度约为20 kg/m3。添加的碳源为一水合葡萄糖(C6H12O6·H2O,分析纯,含碳量为36.4%);使用的饲料为通威鱼用膨化配合饲料(江苏省宿迁市沭阳县扎下镇,粗蛋白为31.0%,碳含量为37.3%),实验所用氯化铵(分析纯,纯度≥99.5%)及所有水质检测使用试剂均采购自国药集团化学试剂有限公司,所用抗生素均采购自合肥中龙神力动物药业有限公司。
1.2 实验设计与管理
实验分为4组,每组三个平行,A组作为对照组不添加硫酸新霉素,B组添加0.02 g硫酸新霉素(休药期500 ℃·d),C组添加0.04 g硫酸新霉素,D组添加0.12 g硫酸新霉素。添加的药量根据硫酸新霉素的推荐使用量计算,其中B组为推荐使用量的一半,初始浓度为0.50 mg/L,C组为推荐使用量,初始浓度为1.00 mg/L,D组为推荐使用量的3倍,初始浓度为3.00 mg/L。4组接种絮团后调节TSS至315~330 mg/L,水体体积为8 L。
第一次加药连续检测每组投加10 mg/L氨氮(氯化铵溶液),实验期间反应器加盖并及时补充因蒸发流失的少量水分。实验开始时水体碱度为355~375 mg CaCO3/L,当低于150 mg CaCO3/L时添加适量小苏打以维持碱度。当所有组氨态氮以及亚硝态氮浓度降低并维持在0.5 mg/L以内时视为第一次连续监测实验结束。维持系统培养直到休药期结束,加药进行第二次连续监测。
第二次加药连续检测每组投加10 mg/L氨氮(氯化铵溶液),实验期间反应器加盖并及时补充因蒸发流失的少量水分。实验开始时水体碱度为265~285 mg CaCO3/L,当低于150 mg CaCO3/L时添加适量小苏打以维持碱度。当所有组氨态氮以及亚硝态氮浓度降低并维持在0.5 mg/L以内时视为实验结束。

1.3 水质及絮团指标的检测方法
水质指标检测先用注射器取10 mL絮团水样,再通过0.22 μm针头滤器(上海航欧机电设备有限公司,型号:Collins MCE 0.22 μm)过滤后进行检测。检测方法见表1,检测仪器为分光光度计(上海优尼科仪器有限公司,型号:UV2000),总有机碳分析仪(岛津制作所,型号:TOC-4200),多参数手提测试仪(德国WTW,型号:Multi 3430),105 ℃电热鼓风干燥箱(上海一恒科学仪器有限公司),碳氮元素分析仪(德国Elementar vario max CNS),马弗炉(协郝上海仪器科技有限公司,型号:SX2-4-10Y)。

表1 水质指标检测方法Tab.1 Water quality index detection method
1.4 硫酸新霉素的检测
水体中硫酸新霉素在第一次休药期结束和第二次加药3 d后从各组实验水体中均匀抽取50 mL水样,通过0.22 μm针头滤器过滤后通过冰袋运送至上海微谱化工技术有限公司进行检测。硫酸新霉素含量检测方法由LC-MS/MS外标法测定。液相型号为:Waters 1-Class;质谱型号为:Waters TQS;色谱柱为:ACQUITY UPLcr HSS T3 1.8 μm;柱温:35 ℃;进样量:5 μL;流动相为:0.1%甲酸水溶液和乙腈;流速:0.4 mL/min。
1.5 生物絮团中抗生素抗性基因的采集与测定
在第二次连续监测实验结束后从各组实验水体中均匀抽取150 mL水样,通过0.22 μm滤膜抽滤后,将抽滤在滤纸上的絮团放进10 mL透明无菌离心管中,用干冰保存第一时间送至上海生工生物工程股份有限公司进行抗生素抗性基因的检测。
实验所用引物通过Primer Premier 5.0软件设计,表2为所用目的基因引物。

表2 本实验所研究基因参考引物Tab.2 Reference primers for genes studied in this lab
1.6 生物絮团中异养细菌的生物群落估算
用稀释平板计数法来测定生物絮团中的异养细菌的群落数量。在对接种絮团扩培之前及扩培实验结束之后采集絮团水样。在无菌操作台中,取1 mL均匀水样,根据菌群的大致数量用合适倍数的无菌生理盐水进行稀释。将各组稀释后的菌液用杀菌消毒后的干净三角玻棒均匀涂布在大豆酪蛋白琼脂培养基上(杭州百思生物技术有限公司)。将均匀涂布后的平板放入恒温生化培养箱中(上海精宏实验设备有限公司,型号:SHP-250),设定温度为35 ℃,培养时间为24 h。最后对培养之后的菌落进行计数,菌落数(CFU/mL)为平板上所有菌落数量再乘以稀释倍数进行计算。
1.7 氨氮去除效率和氨氮去除速率及抗生素使用量计算公式
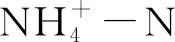
R=100%×(Ci-Ce)/Ci
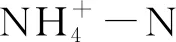
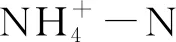
S=(Ci-Ce)/(T×t)
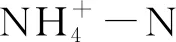
抗生素使用量计算公式:
M=ρ×V×Mi/k
式中,M为使用药物的质量(g);ρ为养殖水体密度(kg/m3);V为实验水体体积(L);Mi为抗生素药物使用剂量(g);k为药物有效成分含量(%)。
1.8 数据统计分析
实验数据通过Excel2017软件进行记录和统计,由Origin Pro 2021和Graphpad Prism 9.0软件绘制相关图表。实验数值用平均值(Mean±SD)形式表示,采用SPSS 22统计软件对数据进行ANOVA单因素方差分析,P<0.05为差异性显著。
2 结果与分析
2.1 实验期间水质及絮团变化
在探究不同浓度硫酸新霉素对生物絮团氨氮转化速率和抗生素抗性基因累积的效果前,对各个实验组的水质指标进行检测并无显著差异,如表3所示。

表3 加药之前4个组水质指标平均值、最小值和最大值Tab.3 Average,minimum and maximum values of water quality indicators in 4 groups before dosing
第一次加药连续检测水质变化如图1所示,其中各组氨态氮变化如图1(a)所示。4个组的氨态氮去除效率分别为99.80 %、99.70%、99.53%和99.29%;氨态氮去除速率分别为(3.88±0.02)mg TAN/(g TSS·h)、(2.22±0.03)mg TAN/(g TSS·h)、(2.17±0.04)mg TAN/(g TSS·h)和(1.72±0.02)mg TAN/(g TSS·h),氨态氮去除速率A组>B组>C组>D组。A组与其他三组去除速率有显著差异,B组和C组的去除速率无显著差异,D组与其他三组去除速率有显著差异。

图1 第一次加药时4个组中三态氮(a,b,c)及溶解性有机碳(d)的变化图Fig.1 Changes of tristate nitrogen(a,b,c)and dissolved organic carbon(d)in the four groups during the first dosing.
实验期间4个组亚硝氮的浓度变化如图1(b)所示,4个组的亚硝氮浓度变化趋势总体一致,在实验前4 h处于上升阶段且在第4 h达到峰值,第4 h后A组和B组亚硝氮在第12 h下降到0.1 mg/L的低浓度水平,C组和D组亚硝氮分别在第16和18 h下降到0.1 mg/L的低浓度水平。
实验期间4个组硝态氮的浓度变化如图1(c)所示,4个组的硝态氮浓度在实验结束后的浓度较实验开始时均有下降,除C组外其余3组下降幅度不大,均在3.00 mg/L以内。
实验期间4个组DOC浓度变化如图1(d)所示,4个组的DOC均呈现下降趋势,且总消耗量均在96.00至99.00 mg/L之间,各组无显著差异。
在第一次连续监测前对4个组的TSS浓度进行了检测,4组浓度分别为(315.00±3.00)mg/L、(315.00±2.00)mg/L、(325.00±2.00)mg/L和(315.00±1.00)mg/L。各组无显著差异,连续监测结束后4组TSS浓度如图2所示,各组TSS浓度较实验开始前均有所下降,A组降至(210.00±14.51)mg/L;B组降至(243.33±18.93)mg/L;C组降至(252.00±26.73)mg/L;D组降至(238.67±14.64)mg/L。下降量A组>D组>B组>C组,A组与其余3组有显著性差异。

图2 第一次加药结束4个组TSS浓度变化图Fig.2 Changes of TSS concentration in 4 groups at the end of the first dosing
第二次加药连续检测水质变化如图3所示,其中各组氨态氮变化如图3(a)所示。4个组的氨态氮去除效率分别为99.70%、99.68%、99.73%和99.79%。4个组的氨态氮去除速率分别为(2.99±0.08) mg TAN/(g TSS·h)、(2.98±0.03) mg TAN/

图3 第二次加药时4个组中三态氮(a,b,c)及溶解性有机碳(d)的变化图Fig.3 Changes of tristate nitrogen(a,b,c)and dissolved organic carbon(d)in the four groups during the second dosing
(g TSS·h)、(2.97±0.08)mg TAN/(g TSS·h)和(5.10±0.03)mg TAN/(g TSS·h),氨态氮去除速率D组>A组>B组>C组。D组与其他三组去除速率有显著差异,A组、B组和C组的去除速率无显著差异。
实验期间4个组亚硝氮的浓度变化如图3(b)所示,4个组的亚硝氮浓度变化趋势总体一致,在实验前4 h处于上升阶段且在第4 h达到峰值,在第10 h下降到0.02 mg/L以下的低浓度水平。4个组硝态氮的浓度变化如图3(c)所示,4个组的硝态氮浓度在实验结束后的浓度较实验开始时均有下降,但下降幅度均在2.00 mg/L以内。
实验期间4个组DOC浓度变化如图3(d)所示,4个组的DOC均呈现下降趋势,且总消耗量均在90.00~94.00 mg/L之间,各组无显著差异。
在第二次连续监测前对4个组的TSS浓度进行了检测,4组浓度分别为(331.30±7.59)mg/L、(329.00±3.27)mg/L、(327.00±3.56)mg/L和(323.30±3.30)mg/L。各组无显著差异,连续监测结束后4组TSS浓度如图4所示,各组TSS浓度较实验开始前均有所下降,A组降至(264.67±19.62)mg/L;B组降至(301.33±4.99)mg/L;C组降至(267.33±5.25)mg/L;D组降至(262.67±4.99)mg/L。下降量D组>A组>C组>B组,B组与其余3组有显著性差异。
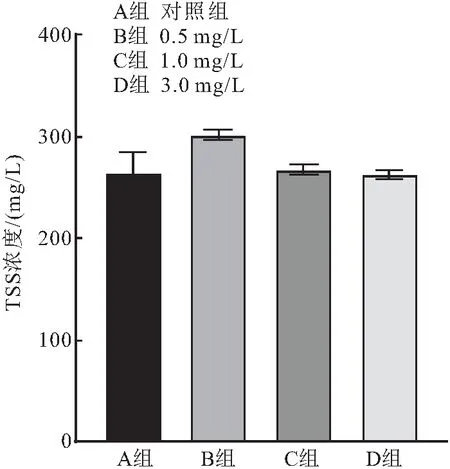
图4 第二次加药结束4个组TSS浓度变化图Fig.4 Changes of TSS concentration in 4 groups at the end of the second dosing
各组连续检测后絮团组分如表4所示,絮团VSS/TSS为B组>C组>A组>D组,B组与C组与A、D组呈显著差异。粗灰分则为D组>A组>C组>B组,A组与D组无显著差异,其余各组间均有显著差异。粗蛋白各组无显著差异。粗脂肪B组>C组>A组>D组,B组与其他各组呈显著差异。

表4 实验结束时絮团VSS/TSS、粗灰分、粗蛋白、粗脂肪的含量Tab.4 Contents of floc VSS/TSS,crude ash,crude protein and crude fat at the end of the experiment %
2.2 水体抗生素含量
在休药期结束也就是第二次连续监测前和第二次连续监测结束后3 d对水体中的硫酸新霉素进行检测,检测结果如表5所示。4个组前后两次均未在水体中检测到硫酸新霉素的存在,或低于检出阈值。

表5 休药期结束时4组水体硫酸新霉素含量Tab.5 The contents of neomycin sulfate in the four groups of water at the end of the withdrawal period (mg/L)
2.3 生物絮团中抗生素抗性基因含量
在第二次连续监测结束后,对水体送样检测抗生素抗性基因,其中包含5种氨基糖苷类抗生素抗性基因和1种整合子基因。检测结果如图5所示,实验结束后4个组的intl1的拷贝数分别为1.17×106copies/mL、6.51×105copies/mL、2.17×106copies/mL和2.13×106copies/mL,拷贝数C组>D组>A组>B组;4个组aadB的拷贝数分别为2.86×105copies/mL、2.13×105copies/mL、4.03×105copies/mL和6.17×105copies/mL,拷贝数D组>C组>A组>B组;4个组aph(3′)-Ia的拷贝数分别为7.10×103copies/mL、3.63×103copies/mL、3.01×104copies/mL和1.03×106copies/mL,拷贝数D组>>C组>>A组>B组;4个组aph(3′)-Ⅱa的拷贝数分别为3.43×103copies/mL、1.86×103copies/mL、2.17×104copies/mL和6.64×105copies/mL,拷贝数D组>>C组>A组>B组;4个组aac(6′)-Ⅰb的拷贝数分别为5.50×105copies/mL、3.25×105copies/mL、2.34×106copies/mL和4.00×106copies/mL,拷贝数D组>C组>A组>B组;4个组aac(3)-Ⅱ的拷贝数分别为7.04×103copies/mL、6.00×103copies/mL、1.53×104copies/mL和1.43×105copies/mL,拷贝数D组>>C组>A组>B组。

图5 第二次加药后4组6种抗生素抗性基因拷贝数Fig.5 Copy numbers of 6 antibiotic resistance genes in 4 groups after the second dosing
2.4 生物絮团中异养细菌生物群落数量
如图6所示,在连续监测实验结束后4个实验组与初始水样的异养菌生物群落数量相差较大,各组培养后菌群扩增量较大与初始组有显著差异。连续监测实验结束后,4个实验组的异养菌群落数量为B组>C组>D组>A组。其中B组与A组、C组、D组有显著差异,A组、C组和D组无显著差异。
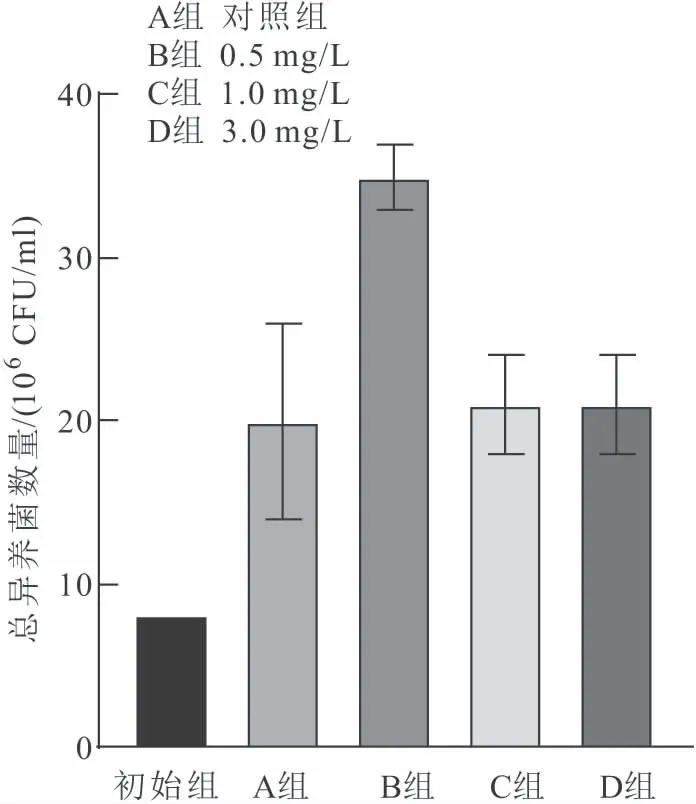
图6 第二次加药后初始和4个实验组的异养菌数量Fig.6 The number of heterotrophic bacteria in the initial and 4 experimental groups after the second dosing
3 讨论
3.1 不同浓度硫酸新霉素对生物絮团氨氮转化的影响
通过第一次连续监测,直观地看出硫酸新霉素的添加会对水体氨氮处理速率产生影响,硫酸新霉素的浓度越高影响越大,第一次加药后的氨氮处理速率也就越低。但是通过一个休药期的培养后,水体中的菌群对硫酸新霉素有了明显的抗性,同样的浓度再次添加已经无法对氨氮处理速率产生负面的影响,反而在添加了较高浓度硫酸新霉素的D组中,较高浓度的硫酸新霉素在不影响亚硝氮和硝氮转化的情况下,促进了氨氮转化的速率。这和LI等[15]使用四环素对生物膜系统对脱氮性能探究的结果相反。据推测,高浓度硫酸新霉素的选择使菌群多样性降低同时也对具有抗生素抗性的细菌大量富集,使之成为新的优势种。在适应高浓度抗生素环境后,相关菌群恢复了其生态功能,且菌群数量较加药前有所提升,最终使生物絮团对氨态氮的转化速率提高。
3.2 不同浓度硫酸新霉素在生物絮团中累积情况
在对第二次连续监测前和第二次连续监测结束后3 d的水体进行采集送样检测发现,水体中的抗生素含量低于检测阈值未能检出或者已经被分解甚至转移至絮团内部。这与LIANG等[16]在研究通过生物膜法去除抗生素抗性基因的时候对于水体中硫酸新霉素去除率的结果相似。这说明了生物絮团在适应抗生素环境后,能够快速转移和代谢水体中的硫酸新霉素。不过这也反映出,水体中硫酸新霉素并不能维持在所使用浓度条件下。那么在生物絮团中使用抗生素时,浓度的选择要与常规养殖模式有所区别。
3.3 不同浓度硫酸新霉素对生物絮团抗生素抗性基因的影响
在对第二次加药后的生物絮团进行抗生素抗性基因检测后,发现了硫酸新霉素的添加对于aph(3′)-Ia、aph(3′)-Ⅱa、aac(6′)-Ⅰb、aac(3)-Ⅱ这四种硫酸新霉素抗性基因具有较大的选择和富集的能力,尤其是aph(3′)-Ia、aph(3′)-Ⅱa和aac(3)-Ⅱ这三种基因随着硫酸新霉素浓度的增加,基因拷贝数成倍上涨,呈现显著的正相关。这与ZHAO等[17]在活性污泥反应器中使用不同种类抗生素得出的结果相似。但是本实验中添加了0.5 mg/L硫酸新霉素的B组,在实验结束后的所有抗生素抗性基因均低于未添加抗生素的A组,这与ZHAO等[17]和WAN等[18]的结论有所差异,推测原因可能是低浓度的硫酸新霉素对于絮团的选择压力较小,而B组的细菌群落数量有大幅增加,使对应的几种抗生素抗性基因相对丰度降低。
