HBeAg阳性慢性乙型肝炎患者抗病毒治疗前后HBcrAg、HBV DNA、甲胎蛋白水平变化研究*
2023-07-28齐聪幸郭少华范伟光石荣亚安伟娜
齐聪幸 郭少华 范伟光 石荣亚 安伟娜 刘 静
1.保定市人民医院肝一科 (河北 保定, 071000) 2.保定市人民医院 3.保定市人民医院
乙型肝炎是临床常见传染病之一,主要由乙型肝炎病毒(HBV)引起,我国目前约有2 000万慢性乙型病毒性肝炎(CHB)患者[1]。WHO报道,全世界约有20亿人有HBV感染史,其中慢性HBV感染者占17.5%左右,这其中每年约有100万人因HBV感染所致的肝衰竭、肝硬化和原发性肝细胞癌等疾病死亡[2]。乙型肝炎e抗原(HBeAg)是HBV感染的标记物之一,阳性代表HBV DNA处于活跃复制状态,HBeAg阳性CHB患者若得不到及时治疗,将有大部分进展至肝硬化和肝癌,给患者身体健康及社会和谐稳定造成严重影响[3]。抗病毒治疗是HBeAg阳性CHB患者治疗的关键,其中恩替卡韦分散片对HBV抑制作用较强,所需药物浓度很低,且对线粒体DNA含量无明显影响,抗HBV疗效已得到国内外大规模临床试验的证实[4]。既往报道显示,乙型肝炎核心相关抗原(HBcrAg)、HBV DNA与肝内HBV共价闭合环状DNA(cccDNA)关系密切,对多种抗病毒药物治疗效果及耐药情况监测有重要实用价值[5,6]。甲胎蛋白(AFP)可在一定程度上反映肝脏损害程度[7]。目前临床上有关HBcrAg、HBV DNA、AFP对HBeAg阳性CHB患者抗病毒疗效的预测价值研究较少,且现有文献多为单一指标,较少三者综合分析探究。本研究旨在探究HBcrAg、HBV DNA、AFP在HBeAg阳性慢性乙肝患者治疗过程中的变化及对完全应答的预测价值,以期为该类患者的临床治疗提供参考。
1 资料与方法
1.1 研究对象 选取2019年11月至2020年11月医院肝病科收治的80例HBeAg阳性CHB患者为研究对象,其中男51例,女29例,年龄19~62岁,平均(31.26±10.57)岁。纳入标准:①诊断均符合2018年美国肝病学会(AASLD)指南:慢性乙型肝炎的预防、诊断和治疗(更新版)中相关标准[8];②HBeAg阳性超过6个月,HBsAg和HBV DNA均为阳性,且HBV DNA≥1×105IU/ml,血清总胆红素(TBil)<2×ULN;③近6个月内未使用过抗病毒及免疫调节剂治疗;④患者及家属均对本研究知晓,并签字确认。排除标准:①诊断为丙型肝炎病毒(HCV)、甲型肝炎病毒(HAV)、戊型肝炎病毒(HEV)等嗜肝病毒感染者;②合并酒精肝或自身免疫性肝病等肝脏疾病者;③合并严重的心、肺、肾等器官功能障碍、恶性肿瘤、血液系统疾病或精神疾病者;④近6个月使用过干扰素、核苷(酸)类似物、化疗药、免疫抑制剂或致肝脏毒性药物者;⑤病情进展至肝硬化失代偿期者;⑥妊娠期或哺乳期女性。本研究获医院医学伦理委员会批准[批件号【2019】科伦审字(086)号]。
1.2 研究方法
1.2.1 治疗方法 参考2018年AASLD指南:慢性乙型肝炎的预防、诊断和治疗(更新版)。给予80例HBeAg阳性CHB患者恩替卡韦分散片(苏州东瑞制药有限公司,国药准字H20100129)治疗,空腹口服,每次0.5 mg,每日1次。连续治疗12个月。
1.2.2 实验室指标检测 分别在治疗前及治疗3个月、6个月、12个月时抽取患者空腹外周静脉血9 ml,3 000 r/min离心10 min(离心半径13.5 cm),分离收集血清,以检测HBcrAg、HBV DNA、AFP、HBV血清标志物和丙氨酸氨基转移酶(ALT)等指标。HBcrAg:采用G1200全自动化学发光免疫分析仪(日本富士)检测;HBV DNA:采用圣湘生物科技股份有限公司试剂盒检测;HBV血清标志物(HBsAg、HBeAg)、AFP:采用Roche E601全自动电化学发光分析仪(瑞士罗氏公司)检测;ALT:采用Beckman AU 680全自动生化分析仪(美国贝克曼公司)检测。所有操作均严格按照仪器及配套试剂盒使用说明书操作步骤进行。
1.2.3 分组 根据病毒学应答判断标准将80例患者分为应答组(50例)和非应答组(30例)。病毒学应答是指通过治疗,血清HBV DNA检测不到或低于检测下限。完全应答是指治疗后实现HBeAg清除/血清学转换和HBV DNA<20 IU/ml,否则为非完全应答[9]。
1.3 观察指标 ①比较两组治疗前、治疗3个月、6个月、12个月时HBcrAg、HBV DNA、AFP、HBV血清标志物以及ALT水平;②分析HBcrAg、HBV DNA、AFP与HBV血清标志物、ALT水平的相关性;③分析HBcrAg、HBV DNA、AFP联合对HBeAg阳性慢性乙型肝炎患者治疗后完全应答的预测价值。
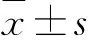
2 结果
2.1 两组患者一般资料比较 两组患者性别、年龄、身体质量指数(BMI)比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般资料比较
2.2 两组患者治疗前后HBcrAg、HBV DNA、AFP、HBsAg、HBeAg、ALT变化情况 两组患者治疗前HBcrAg、HBV DNA、AFP、HBsAg、HBeAg以及ALT水平比较差异无统计学意义(P>0.05);随着治疗时间的延长,两组患者HBcrAg、HBV DNA、AFP、HBsAg、HBeAg以及ALT水平总体呈下降趋势,其中应答组治疗各时间点上述指标均低于非应答组(P<0.05)。见表2。

表2 两组患者HBcrAg、HBV DNA、AFP、HBsAg、HBeAg、ALT水平在治疗中的变化
2.3 HBeAg阳性CHB患者HBcrAg、HBV DNA、AFP 、HBsAg、HBeAg 、ALT关系分析 治疗前,HBcrAg与HBV DNA、AFP、HBsAg、HBeAg以及ALT均呈正相关性(r=0.583、0.601、0.552、0.597、0.354,P<0.05);治疗前,HBV DNA与AFP、HBsAg、HBeAg以及ALT均呈正相关性(r=0.514、0.608、0.587、0.339,P<0.05);治疗前,AFP与HBsAg、HBeAg以及ALT均呈正相关性(r=0.533、0.562、0.348,P<0.05),见表3。治疗12个月时,HBcrAg与HBV DNA、AFP、HBsAg、HBeAg以及ALT均呈正相关性(r=0.467、0.435、0.488、0.482、0.328,P<0.05);治疗12个月时,HBV DNA与AFP、HBsAg、HBeAg以及ALT均呈正相关性(r=0.396、0.411、0.403、0.317,P<0.05);治疗12个月时,AFP与HBsAg、HBeAg以及ALT均呈正相关性(r=0.533、0.562、0.348,P<0.05),见表4。

表3 治疗前HBeAg阳性CHB患者HBcrAg、HBV DNA、AFP与HBV血清标志物以及ALT关系分析

表4 治疗后HBeAg阳性CHB患者HBcrAg、HBV DNA、AFP、HBsAg、HBeAg 、ALT关系分析
2.4 HBcrAg、HBV DNA、AFP对治疗后HBeAg阳性
CHB患者完全应答预测效能分析 绘制ROC曲线,结果显示,治疗前HBcrAg、HBV DNA、AFP预测治疗后HBeAg阳性慢性乙肝患者完全应答的AUC分别为0.742、0.770、0.761,敏感度分别为84.30%、85.70%、80.00%,特异度分别为60.70%、57.10%、58.40%,三者联合预测的AUC为0.859,敏感度和特异度分别为87.10%、56.30%。治疗后HBcrAg、HBV DNA、AFP预测HBeAg阳性慢性乙型肝炎患者完全应答的AUC分别为0.656、0.668、0.652,敏感度分别为68.00%、62.00%、60.00%,特异度分别为56.00%、66.00%、56.00%,三者联合预测的AUC为0.767,敏感度和特异度分别为76.00%、54.00%。见表5和图1。

图1 HBcrAg、HBV DNA、AFP预测治疗后HBeAg阳性CHB患者完全应答的ROC曲线 (A.治疗前各指标ROC曲线;B.治疗后各指标ROC曲线)
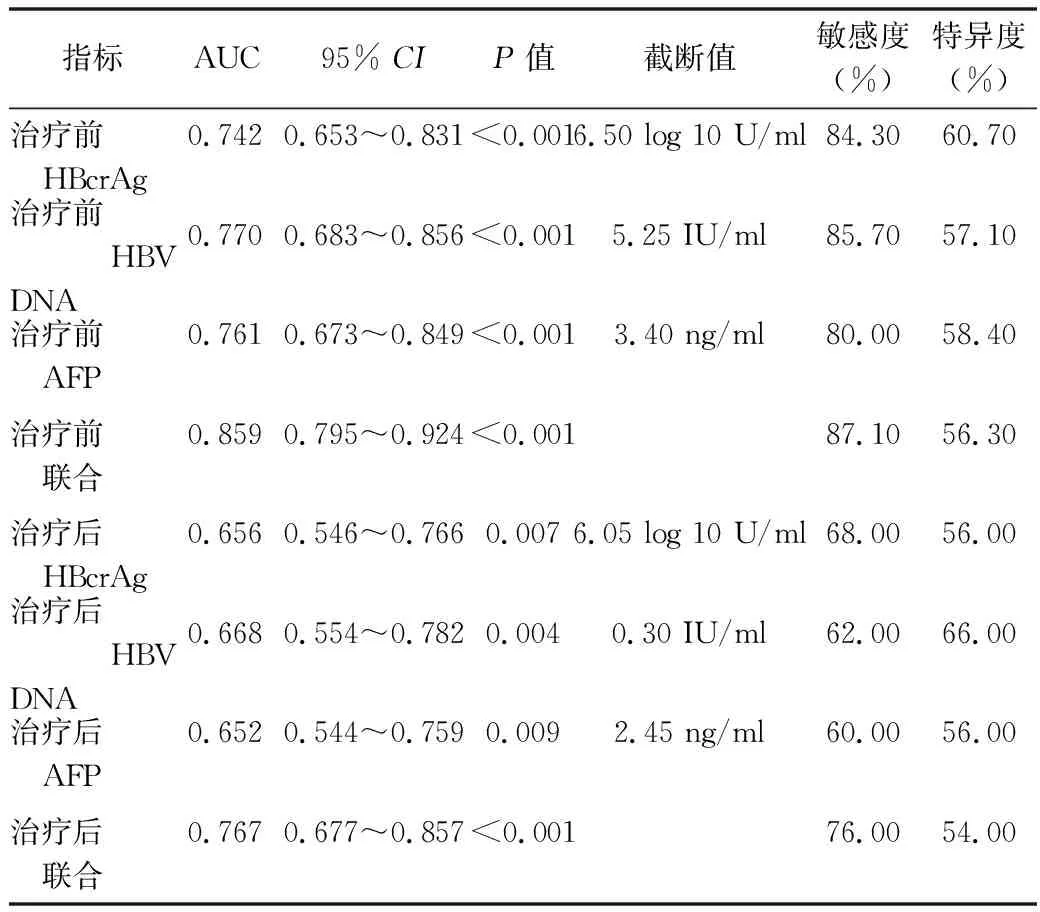
表5 HBcrAg、HBV DNA、AFP对治疗后HBeAg阳性CHB患者完全应答预测效能分析
3 讨论
据相关调查显示,我国约有1.2亿人为HBV携带者,HBsAg阳性率约10%[10]。慢性HBV感染者因缺乏对HBV的特异性免疫清除,以血清HBsAg、HBeAg阳性及高病毒载量(≥1.0×106IU/ml)为主要表现[11]。CHB已成为全球性健康问题之一。既往研究证实,cccDNA存在于肝细胞核中,是HBV复制的中间体,亦是病毒成功感染肝细胞的标志,治疗CHB的关键因素是将其抑制或清除,故可通过监测cccDNA来评估抗病毒治疗效果[12]。但肝穿刺风险较高,取材及检测步骤较为繁琐,因此寻找高效的可反映肝内cccDNA水平的指标意义重大。近年来,血清HBcrAg、HBV DNA和HBsAg水平在慢性HBV感染者不同阶段的变化研究已成为临床热点。Chen等[13]研究表明,慢性HBV感染者不同免疫状态下,血清HBcrAg水平与cccDNA存在正相关性。Mu等[14]研究显示,CHB患者肝组织cccDNA与肝组织HBV DNA及血清HBV DNA均呈显著正相关关系。
由此可见血清HBcrAg、HBV DNA水平可以反映肝细胞内cccDNA水平,通过监测其水平变化对于抗病毒药物疗效的评估以及完全应答的预测均具有重要意义。在本研究中,随着治疗时间的延长,两组患者HBcrAg、HBV DNA、AFP、HBsAg、HBeAg以及ALT水平总体呈下降趋势,其中应答组治疗各时间点上述指标均低于非应答组,与王晴等[15]部分研究结果一致。此外,相关性分析结果显示,治疗前及治疗后HBcrAg与HBV DNA、AFP、HBsAg、HBeAg以及ALT均呈正相关性,提示上述指标可作为HBeAg阳性CHB患者抗病毒治疗效果评估的参考指标,上述指标水平发生明显变化者可重点监测以实现完全应答。HBcrAg主要在不含HBV DNA的病毒颗粒中发现,由HBeAg、乙型肝炎核心抗原(HBcAg)以及一种核心p22cr蛋白组成,通过cccDNA转录的mRNA翻译而来,对于HBeAg阳性患者,较低的HBcrAg水平提示患者处于强烈的免疫控制之下,这与HBeAg血清转换后HBeAg的产生减少有关[16]。血清HBcrAg水平在慢性HBV感染者中从免疫耐受期经免疫激活期到免疫控制期呈逐步降低趋势,血清HBV DNA载量在不同阶段的变化方向和幅度与其基本一致,但血清HBcrAg测量相较于血清HBV DNA更具优势,大部分患者无法检测到血清HBV DNA时仍可检测到HBcrAg[17]。AFP主要是胚胎时期卵黄囊细胞合成分泌的一种糖蛋白,胎儿时期血液中其含量较高,后逐渐降低,在正常人中含量极低。既往研究表明,良恶性肝病患者中血清AFP水平均伴有不同程度升高,对于原发性肝癌的诊断或鉴别具有重要的临床指导意义[18]。最新研究显示,慢性乙型肝炎患者肝脏炎症活动度升高时,其血清AFP水平也随之升高[19]。然而AFP能否作为临床诊断或预测HBeAg阳性CHB患者的指标目前尚无定论,仍需进一步研究。
基于本研究上述研究结果及相关分析,可初步认为HBeAg阳性CHB患者治疗过程中血清HBcrAg、HBV DNA、AFP水平显著性下降更有利于抗病毒治疗后实现完全应答。国外一项研究显示,基线HBcrAg以及治疗12周HBcrAg下降水平为持续性病毒学应答的影响因素[20]。本研究ROC曲线分析表明,治疗前及治疗后血清HBcrAg、HBV DNA、AFP水平对完全应答有较好的预测价值,AUC均在0.6以上,尤其是各指标联合预测的AUC大于0.7,说明治疗前后血清HBcrAg、HBV DNA、AFP联合检测可为HBeAg阳性慢性乙肝患者抗病毒治疗的临床疗效评估提供更准确数据。而曹卫华等[21]研究显示,恩替卡韦治疗虽可以直接抑制HBV DNA复制,但无法增强免疫细胞功能。临床治疗可考虑与其他药物联用,以增强患者细胞免疫功能,更快实现完全应答。
综上所述,血清HBcrAg、HBV DNA、AFP在HBeAg阳性慢性乙型肝炎患者治疗过程中波动较大,与抗病毒治疗效果关系密切,可在一定程度上作为预测抗病毒治疗后实现完全应答的有效指标。但本研究纳入样本量有限,未进行长时间随访,后续仍需扩大临床规模进行长期随访研究,以进一步明确上述指标对于HBeAg阳性CHB患者的临床指导意义。
