红凉伞化学成分及药理活性研究进展
2023-07-28晏合吕赵春丽周永强薛艳谢梅任佳霖
晏合吕 赵春丽 周永强 薛艳 谢梅 任佳霖
【摘 要】 红凉伞为紫金牛属植物朱砂根的变种植物,在民间用药中,红凉伞主要用于治`疗跌打、风湿、各种炎症等,特别是其对咽炎具有良好的治疗效果。其所含的主要药用成分有香豆素类、黄酮类及三萜皂苷类等,多具有显著的镇咳、免疫增强、抗HIV、抗凝血等药理活性。文章通过查阅国内外文献总结了红凉伞的化学成分以及药理作用,进一步阐述了红凉伞的药用价值,为临床开发新药提供基础。
【关键词】 红凉伞;化学成分;岩白菜素
【中图分类号】R258.6 【文献标志码】A 【文章编号】1007-8517(2023)13-0043-05
DOI:10.3969/j.issn.1007-8517.2023.13.zgmzmjyyzz202313010
Research Progress on Chemical Constituents and Pharmacological Activities
of Ardisia crenata Sims var. bicolor(Walker)
YAN Helv ZHAO Chunli* ZHOU Yongqiang XUE Yan XIE Mei REN Jialin
Guizhou University of Traditional Chinese Medicine, Guiyang 550025,China
Abstract: Ardisia crenata Sims var. bicolor (Walker) is a variant plant of the viburnum root of the genus Ardisia, which is a commonly used folk Chinese medicine. In folk medicine, Ardisia crenata Sims var. bicolor is mainly used to treat falls, rheumatism, various inflammation and other diseases, especially for pharyngitis. The main medicinal ingredients of Ardisia crenata Sims var. bicolor are coumarins, flavonoids and triterpenoid saponins, which have significant antitussive, immune enhancement, anti HIV, anti-coagulation and other pharmacological activities. In this paper, the chemical constituents and pharmacological effects of red parasol are summarized by consulting domestic and foreign literatures, and the medicinal value of Ardisia crenata Sims var. bicolor is further elaborated, which provides a basis for clinical development of new drugs.
Key words: Ardisia crenata Sims var. bicolor (Walker);Chemical Composition;Bergenin
紅凉伞[ Ardisia crenata Sims var.bicolor (Walker)]别名铁凉伞、两色紫金牛、红八爪等,以根或全株入药,植株直立灌木状,常树冠伞形,叶片多为椭圆状革质 或坚纸质,且顶端为尖状,基部呈锯齿形,边缘为波状,叶背为紫红色。主要分布于我国华东、中南、西南等地,民间多与朱砂根混用[1]。现代研究[2]中红凉伞植株所含的主要药用成分岩白菜素,含量较高,位于朱砂根、紫金牛之上。红凉伞的根及全株可入药,有活血祛瘀、清热降火、消肿解毒、祛痰止咳等功效[3]。研究[4]表明其根含朱砂根总皂苷能抑制癌细胞增殖,直接杀伤癌细胞,有望成为抗癌新药,而具有较高的药用价值。现代研究[5]中,从红凉伞分离的主要化合物有三萜皂苷类(triterpenoid saponin),岩白菜素(bergenin monohydrate)、酚类(phenol)、醌类、黄酮类(flavonoids)等多种生物活性成分。红凉伞具有显著抗肿瘤[6]、抗HIV病毒[7]等活性等多种生物活性成分。并且红凉伞药材内化学成分相对稳定,魏中璇等[8]对8个不同产地的红凉伞药材HPLC指纹图谱的相似度均在0.9以上。红凉伞应用前景广大,非常适合挖掘,本文通过对其化学成分及药理研究的归纳,对红凉伞的研究及开发具有重要的意义。
1 红凉伞的形态特征
红凉伞属紫金牛科植物,植株常灌木状,直立,树冠伞形[9],株高1~2 m,稀达3 m,茎干粗壮约25 cm。红凉伞的叶片触感为革质或坚纸质,形状多为椭圆状,叶片顶端为尖状,基部呈锯齿形,边缘为波状,叶背为紫红色,且两面光滑无毛。单叶互生,长9.9~20.1 cm,宽3.1~4.7 cm[9]。花伞为顶端生长,生长于植株侧面生特殊花枝顶部或者植株下半部分,掩弊在枝叶间,花瓣为白色或淡红色,有微香,盛开时有反卷现象。花冠五裂,雄蕊五枚,花梗、花萼及花瓣皆为紫红色[10]。
2 红凉伞化学成分
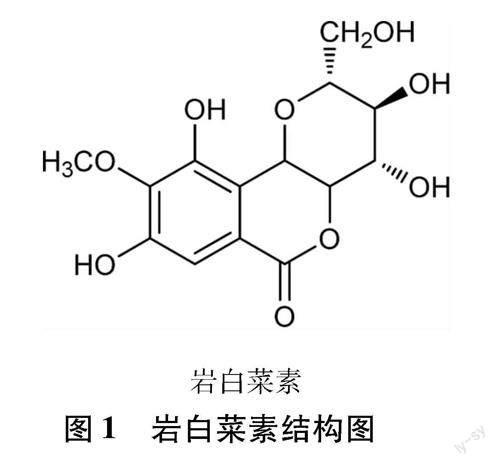
2.1 香豆素类 研究[11-13]表明,红凉伞的主要化学成分为香豆素类,其中香豆素类成分岩白菜素的含量最高,是公认的质量控制指标性成分和活性物质。研究[14]在红凉伞等八爪金龙植物中鉴定出8个香豆素类化合物,其中包括岩白菜素[14]。岩白菜素(bergenin)为一类异香豆素类化合物,是4位甲基化的没食子酸与葡萄糖形成的β构型碳苷。其分子式为C 14H 16O 9,化学名为3,4,8,10-四-O-羟基-2-羟甲基-9-O-甲基- 2,3,4α,10β-四氢吡喃基[3,2-c]苯并吡喃-6-酮;白色针状结晶或结晶性粉末[15]。岩白菜结构图如图1所示。研究[16]表明,其具有镇咳祛痰作用,用于治疗慢性支气管炎。据文献记载岩白菜素还具有显著的镇咳、镇痛、抗炎、增 强免疫、保护肾脏、抗糖尿病、抗HIV、抗凝血等活性。不同入药部位红凉伞药材中岩白菜素的量存在较大的差异,其中以根中主要有效成分岩白菜素的量最高,不同部位岩白菜素的量由高到低的顺序为:根、叶、茎、侧枝﹑果柄、花、果壳、种子,其中侧枝與茎、果壳与果柄中岩白菜素的量没有明显差异[17]。研究[18]表明红凉伞含有大量岩白菜素,其中根岩白菜素平均含量为 14.56 mg·g-1,叶岩白菜素平均含量为14.47 mg·g-1。
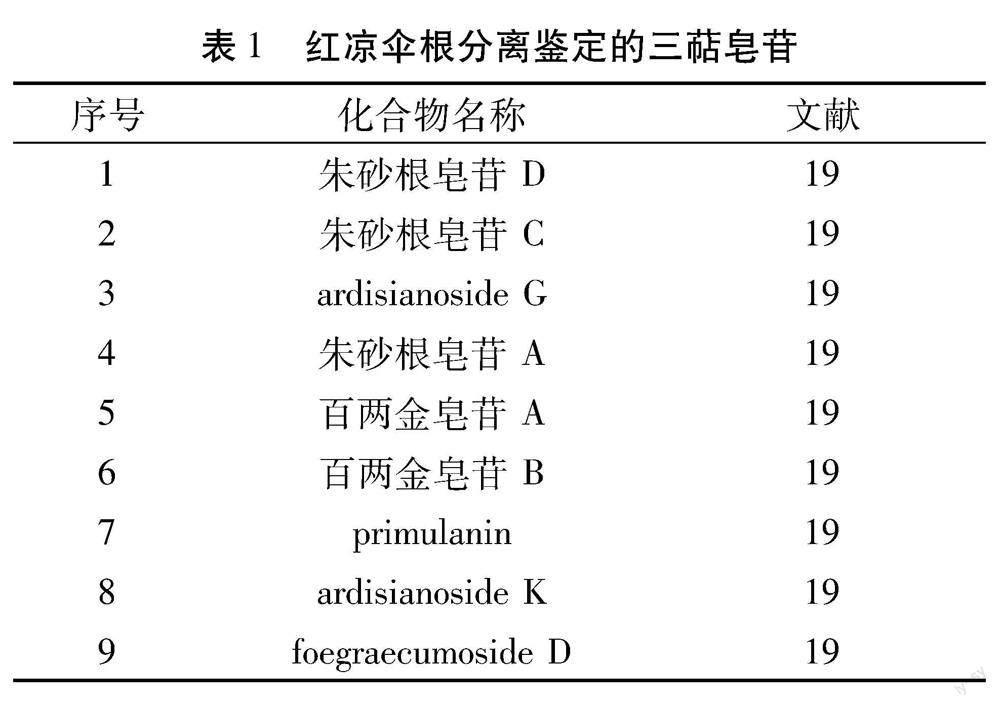
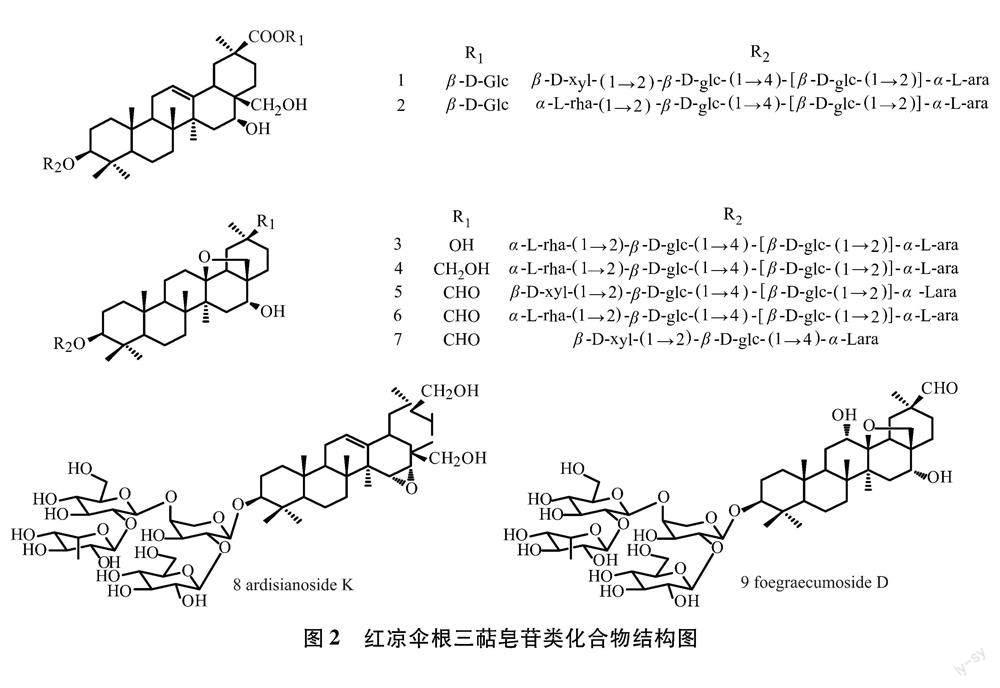
2.2 三萜皂苷类 三萜皂苷类的苷元的基本骨架分为11种,其中包括1种四环三萜[19]。糖链通常连接在3位-OH上,由2-7个不等的单糖组成,以3~5个单糖组成的糖链尤为常见。研究发现红凉伞三萜皂苷成分中也具有显著抗肿瘤抗HIV等活性,叶洪波等在红凉伞的根中,分离鉴定出9个三萜皂苷[20],见表1和如图2所示,其中,FOEGRAECUMOSIDE D为首次从紫金牛属植物中分离得到。此外,有研究首次在红凉伞中发现天然三萜皂苷二倍体存在[21]。
2.3 黄酮类 据文献[22]报道,八爪金龙药材红凉伞中黄酮类化学成分含量较高。李晓等[14]从红凉伞以及同属植株朱砂根、百两金药材中共鉴定出17个黄酮及其苷类化合物,包括9个黄酮醇类、2个二氢黄酮类、3个黄烷-3-醇类及3个其他类化合物。同时李晓等[14]也在贵州产红凉伞中共鉴定出13个黄酮类化合物,包括墨沙酮、3-(2,3-二氢苯并[1,4]二噁英-6-基)-7-羟基-2-三氟甲基-4-酮等,其中正、负离子模式下,共鉴定出9个黄酮醇类成分,分别为槲皮素3-O-鼠李糖苷7-O-葡糖苷、杨梅素、芦丁、槲皮素、槲皮苷等,如图3所示。此外,活性类黄酮的O-甲基化可以增强其抗过敏、抗癌和心脏保护作用[22]。
2.4 其他类 苯醌类:苯醌类化合物在紫金牛属中研究最多、最早且最广泛[23]。密花醌(RAPANONE)和恩贝素(EMBELIN)在紫金牛属多种植物中均曾分离得到。该类化合物的基本母核均为1,4-苯醌,2,3,5,6位常发生-OH、-OME、-ME、-OAC及长链脂肪烃基取代,发生取代的长链脂肪烃碳原子数为奇数[19]。近年研究中发现紫金牛属中存在苯环与苯醌环通过脂肪链连接组成的化合物,以及苯醌环与苯环在5位上直接相连的化合物。
苯酚类:紫金牛属植物含有苯酚类化合物,母核上通常发生-OMe,-Oac或者长度不等的长链脂肪烃取代[24]。研究[19]发现,有的化合物是通过长链脂肪烃连接两个苯酚类化合物组成,有的化合物由母核直接发生-β-D-glc取代形成。发生取代的长链脂肪烃有的含有1~2个不等双键,有的脂肪链上发生-CO或-OAc取代,长链脂肪烃的长度多为13C、15C、16C、17C和19C。
3 药理作用
3.1 抗肿瘤 红凉伞有着良好的抗肿瘤效果,已有研究对其抗肿瘤转移化学成分研究[25]。肿瘤是严重危害人类健康的恶性疾病,肿瘤的发生较以前逐年上升[26]。肿瘤治疗在我国可以说是个重点问题,近些年在中药对于抗肿瘤方面提供了很大帮助。红凉伞提取物进行抗肿瘤转移作用研究发现,95%乙醇提取物具有很强抗人乳腺癌细胞(MDA-MB-231)的趋化迁移作用。此外,红凉伞提取物可抑制乳腺癌细胞增殖、迁移和侵袭,促进细胞凋亡,并且胡志霞等[27]研究其机制可能与MNX1-AS1有关。
3.1.1 皂苷类的抗肿瘤活性 用Transwell chemotaxis法,对单体化合物的活性研究发现红凉伞提取的百两金皂苷B和正丁基-a-D-呋喃果糖苷抗人乳腺癌细胞趋化迁移活性较强,化合物正丁基-α-D-呋喃果糖苷在浓度0.8 μg/mL下对人乳腺癌细胞趋化抑制率达到93.8%。其研究[25]结果发现了红凉伞的抗肿瘤转移作用。研究[28]表明百两金皂苷C对肝癌细胞Bel-7402有显著的抗增殖作用,百两金皂苷A对人口腔上皮癌耐药细胞株KB-V1、人宫颈癌细胞 株Hela、人结直肠癌细胞株HCT-15、人乳腺癌细胞株MCF-7、人非小细胞肺癌细胞株NCI-H460、人前列腺癌细胞株PC-3等肿瘤细胞均具有显著的增殖抑制的作用[29]。
3.1.2 岩白菜素类的抗肿瘤活性 近年来,红凉伞中的岩白菜素可以作为为先导化合物进行结构修饰可开发出一系列具有抗肿瘤活性的衍生物[30]。此外,岩白菜素还可以通过抑制PI3K/AKT/mTOR信号通路,促进结肠癌细胞凋亡、抑制细胞周期从而发挥其抗肿瘤作用[31]。
3.2 红凉伞对呼吸系统疾病的作用 红凉伞常被制作开喉箭喷雾剂,被用于咯痰不爽、喉咙红肿、咳嗽,在土家治验方中治咽喉肿痛,上呼吸道感染[32],红凉伞同朱砂根、百两金是湘西土家开喉箭的三种基源。
3.2.1 止咳祛痰作用 红凉伞止咳来源主要是因为其主要成分为岩白菜素,岩白菜素具有良好祛痰止咳作用[33-36],对咳嗽中枢有选择性抑制作用,岩白菜素是红凉伞主要成分,在止咳化痰上不良反应小,且连续使用不产生耐药性,但药效不高,体内代谢快,生物利用度不高[37],对岩白菜素研究中其衍生物氨基岩白菜素的合成方法简便,且化合物具备镇咳祛痰活性[34],将是其研究的另外一个方向。
3.2.2 治疗慢性支气管炎 研究[41]表明,用岩白菜素治疗SO 2吸入法造模的慢支大鼠,大鼠肺组织中炎症细胞浸润的情况得到缓解,HE染色切片显示肺组织中的肺泡变大及萎陷情况也有所好转。此外,岩白菜素可通过改变支链氨基酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,糖醇解和甘油醋类代谢途径治疗慢性支气管炎[41]。
3.3 抗炎、抑菌、抗病毒作用
3.3.1 岩白菜素的抗炎活性 对红凉伞直接用于抗炎的研究还处于一个较空白区域,但对其主要成分岩白菜素用于治疗炎症可追溯至1984年[38]。长久以来,岩白菜素对炎症方向上的研究众多,包含抑制前列腺素和细胞因子等炎症方向上研究[39]。岩白菜素对小鼠因为致炎液诱发的炎症有抑制作用,并能够抑制肉芽肿增生[40]。临床中,岩白菜素也应用于慢性支气管炎、胃炎等治疗。此外,岩白菜素的衍生物也具有良好抗炎活性,Jung等[42]和Shah等[43]对岩白菜素进行修饰,并测得较好的抗炎效果。
3.3.2 岩白菜素的抑菌活性 研究发現红凉伞中的岩白菜素能够有效抑制白粉属、链格孢属、镰刀菌属真菌生长,且岩白菜素能完全抑制镰刀菌和白粉菌孢子的萌芽。此外,岩白菜素还可以作用于丝状真菌、黄曲霉菌和构巢曲菌,表现出抑制作用[44]。
3.3.3 岩白菜素的抗氧化活性 研究[45]表明,岩白菜素能降低小鼠脑组织中的脂质过氧化水平,有效抑制脑组织缺血后的脂质过氧化反应,并对黄嘌呤-黄嘌呤氧化酶体系产生的超氧阴离子自由基有清除作用,岩白菜素能升高糖尿病大鼠肝脏中的超氧化物歧化酶、过氧化氢酶含量,降低脂质过氧化水平[46]。此外,对含岩白菜素的植物根提取物进行体外抗氧化研究,显示该提 取物对DPPH自由基、ABTS自由基、羟自由基等均有清除作用,能有效防止脂质过氧化[47]。岩白菜素和异岩白菜素混合物具有较好DPPH 自由基的清除率[48]。
3.4 其他活性 研究[49]表明红凉伞根提取物具有驱虫作用,其甲醇提取物对SCHISTOCERCA AMERICANA (DRURY) NYMPHS 和DIAPREPES ABBREVIATUS L.成虫均有震慑作用,但其二氯甲烷提取物仅对后者有用。
4 结论
本文通过对红凉伞化学成分及药理作用的研究整理,增进对紫金牛属红凉伞的认识,从目前研究来看,在药用使用上,红凉伞的使用略显空缺。红凉伞上有着巨大的药用潜力,其成分决定在镇咳、抗炎、抗氧化等活性,以及抑制癌细胞增殖,直接杀伤癌细胞上将有很大的作用。与之主要成分相关的主要成分研究较广,但其成分少有从红凉伞中获取,从红凉伞中获取的成分是否存在新的衍 生物有待进一步考证。红凉伞作为一款应用范围广泛的名贵中药材,其功能活性毋庸置疑,其相关用药原理、药理活性依旧是一个巨大宝库,在未来临床用药上的价值有待进一步研究。
参考文献
[1]中国科学院北京植物研究所.中国高等植物图鉴(第3册)[M].北京:科学出版社,1974:224,221.
[2]赵亚, 刘合刚. 紫金牛属植物研究近况[J]. 中草药, 1999, 30(3):228.
[3]魏江存 ,陈勇,康梦莹,等. 瑶药红凉伞的质量标准初步研究[J]. 药学研究, 2016,19(4):62-64.
[4] 彭丽彬,张家鸿,米方田. 红凉伞的形态特征、物候节律及生长发育特性[J]. 西部林业科学,2008(1):77.
[5]邓素芳,黄烯,赖钟雄. 朱砂根的药用价值与观赏价值[J]. 亚热带农业研究,2006(3):176-178.
[6]张清华. 紫金牛属植物化学成分研究概况[J]. 华西药学杂志,1994(2):99-103.
[7] 王雪,唐生安,翟慧媛,等. 红凉伞抗肿瘤转移化学成分研究[J]. 中国中药杂志,2011, 36(7):881-885.
[8]魏中璇,叶信,陈勇,等.广西瑶药红凉伞的HPLC指纹图谱研究[J]. 中华中医药杂志,2017,32(11):5068-507.
[9]彭丽彬,张家鸿,米方田. 红凉伞的形态特征、物候节律及生长发育特性[J]. 西部林业科学,2008(1):77-81.
[10] 崔会平. 时尚室内观赏植物——红凉伞[J]. 农业工程技术(温室园艺),2008(2):57-59.
[11] 刘斌, 谭成玉, 池晓会, 等. 马卡比力. 岩白菜素的研究进展[J]. 西北药学杂志,2015, 30(5): 660-662.
[12]贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].贵阳: 贵州科技出版社,2003:164.
[13]张艺, 赖先荣, 孟宪丽.紫金牛属药用植物中岩白菜素的高效液相色谱法测定及资源利用[J].中国中药杂志, 1996, 21(8):458.
[14]李晓,石慧,丁晶鑫,等. 不同基原八爪金龙药材中黄酮、香豆素类化学成分分析[J]. 中国药房,2021,32(4):443-452.
[15]董成梅,杨丽川,邹澄,等. 岩白菜素的研究进展[J]. 昆明医学院学报,2012,33(1):150-154.
[16]牛小花,陈洪源. 药用植物朱砂根研究概况[J]. 亚太传统医药,2016,12(18):48-50.
[17] 陈随清,李君,陈颖,等. 红凉伞中岩白菜素的积累动态研究[J]. 中草药,2009,40(9):1486-1488.
[18]王长彬,周永强,俸婷婷,等. 基于HPLC图谱探究苗药八爪金龙3个基原不同药用部位的差异[J]. 化学工程师,2020(12):23-27.
[19]靳志娟. 紫金牛属植物化学成分和药理作用的研究进展[J]. 实用医技杂志,2008(25):3432-3436.
[20] 叶洪波,周永强,廖张蓉. 红凉伞根三萜类化学成分分离与鉴定[J].中药材,2022, 45(2):346-350.
[21]邹萍. 红凉伞地下部分中的一个新双倍体三萜皂苷[A]. 中国化学会.第七届全国天然有机化学学术研讨会论文集[C]//中国化学会,2008:1.
[22]MA C,LV H,ZHANG X,et al. Identification of regioisomers of methylated kaempferol and quercetin by ultra high performance liquid chromatography quadrupole time-of-flight(UHPLC-QTOF)tandem mass spectrometry combined with diagnostic fragmentation pattern analysis[J]. Anal Chim Acta,2013(795):15-24.
[23]赵欧,杜莹,班大明,等.苗药八爪金龙中生物活性成分的研究(Ⅰ)[J].湖北农业科学,2013,52(19):4723-4725.
[24]梅玲,邓赟. 紫金牛属植物化学成分研究进展[J]. 亚太传统医药,2015,11(21):54-55.
[25]王雪. 红凉伞抗肿瘤转移化学成分研究[D].天津:天津医科大学,2011.
[26]徐希宇. 中医药防治恶性肿瘤转移的研究[D].北京:北京中医药大学,2013.
[27]胡志霞,王文元,王岩,等. 红凉伞提取物调控MNX1-AS1对乳腺癌细胞增殖和凋亡的影响[J]. 新中医,2020,52(22):10-14.
[28]黄伟. 百两金抗肿瘤活性成分研究[D].长沙:中南大学,2007.
[29] 蔡佳仲. 朱砂根和树豆叶的化学成分及抗肿瘤作用研究[D].广州:广州中医药大学,2012.
[30]杨彦霞,庄方方,闫福林.岩白菜素衍生物合成方法及抗肿瘤活性评价[J].新乡医学院学报,2019,36(9): 819-823.
[31]高旭灿.岩白菜素通过PI3K/AKT/mTOR信号通路对结肠癌细胞生物学行为的影响及作用机制研究[D].广州:南方医科大学,2020.
[32]熊鹏辉,董淼珍,沈美英,等.湘西北土家族开喉箭的基源调查[J].中国民族民间医药,2013,22(14):13.
[33] 刘晓波,方春生,王成军.岩白菜素缓释片祛痰平喘作用的实验研究[J].大理学院学报,2008(4):5-6.
[34]周金娜,张荣平,邹澄,等.岩白菜素新颖衍生物合成及其镇咳祛痰活性[J].昆明医科大学学报,2020,41(8):14-17.
[35]XIE J X,WANG L,LIU C X,et al. The identification and total synthesis of aichasu,an antitussive agent (authors transl) [J]. Acta Pharmaceutica Sinica, 1981,16(6):425-428.
[36]杨为民,刘吉开,麻兵继,等.岩白菜素衍生物的止咳、祛痰活性筛选[J].四川生理科学杂志,2004(4):188-189.
[37]江苏新医学院.中药大辞典[M].上海:上海人民出版社,1999:2359.
[38] SWARNALAKSHMI T,SETHURAMAN M G,SULOCHANA N,et al. A note on the anti-inflammatory activity of bergenin[J].CurrSci,1984,53(17):917.
[39]邓丽华,李云森,吴艳芬.岩白菜素及其衍生物抗炎活性的相关研究进展[J].药学研究,2016,35(7):408-411.
[40]王刚,麻兵继. 岩白菜素的研究概况[J]. 安徽中医学院学报,2002(6):59-62.
[41]任晓磊.基于代谢组学的慢性支气管炎发病机理及岩白菜素作用机制研究[D].北京:北京中医药大学,2016.
[42]JUNG J C,LIM E,KIM S H,et al. Practical synthesis and biological evaluation of bergenin analogs[J].ChemBiol Drug Des, 2011,78(4): 725-729.
[43]SHAH M R,ARFAN M,AMIN H,et al. Synthesis of new bergenin derivatives as potent inhibitors of inflammatory mediators NO and TNF-α[J].Bioorg Med ChemLett, 2012,22(8) : 2744-2747.
[44]BAJRACHARYA G B. Diversity, pharmacology and synthesis of bergenin and its derivatives: potential materials for therapeutic usages[J]. Fitoterapia, 2015( 101): 133-152.
[45]TAKAHASHI H, KOSAKA M, WATANABE Y, et al.Synthesis and neuroprotective activity of bergenin derivatives with antioxidant activity[J]. Bioorg Med Chem,2003,11(8):1781-1788.
[46]SRINIVASAN R, CHANDRASEKAR M J,NANJAN, et al,Antioxidant Activity of Caesalpinia sappan Heartwood(Pharmacology)[J]. J Ethnopharmacol,2007,113(2):284-91.
[47] NAZIR N, KOUL S, QURISHI M A,et al.Evaluation of antioxidant and antimicrobial activities of Bergenin and its derivatives obtained by chemoenzymatic synthesis[J]. Eur J Med Chem,2011,46(6):2415-20.
[48]ZAMARRUD, ALI I, HUSSAIN H, et al. Two new antioxidant bergenin derivatives from thestem of Riveahypocrateriformis[J].Fitoterapia, 2011, 82(4):722-725.
[49] SANDOVAL-MOJICA A F, CAPINERA J L. Antifeedant effect of commercial chemicals and plant extracts against Schistocerca americana (Orthoptera: Acrididae) and Diaprepes abbreviatus (Coleoptera: Curculionidae)[J]. Pest Management Science, 2011, 67(7):860-868.
(收稿日期:2022-10-10 編辑:陶希睿)
