苗药白龙须对RA滑膜细胞STAT-3/IL-17炎症通路的影响
2023-07-28杨庆万蓝天座安阳谢良山潘晓艺仇维斌雷玉梅
杨庆万 蓝天座 安阳 谢良山 潘晓艺 仇维斌 雷玉梅
【摘 要】 目的: 觀察苗药白龙须对类风湿关节炎患者滑膜成纤维细胞(RA-FLS)增殖及STAT-3相关炎症通路的影响,揭示白龙须对RA滑膜炎症的调控机制。 方法: 培养3~5代RA-FLS细胞,分为空白组(胎牛血清)、正常组(正常兔血清)、雷公藤多苷(TG)组、来氟米特(LEF)组、白龙须低剂量组、白龙须中剂量组和白龙须高剂量组,按各组剂量加含药血清培养,用CCK8法检测各组RA-FLS增殖抑制率的差异,ELISA法检测RA-FLS与CD4+T细胞共培养上清液中炎症细胞因子IL-6、IL-17、IL-23和TNF-α浓度,蛋白印迹法(Wersten Blots)检测RA-FLS中pSTAT-3、SOCS-3的蛋白表达。 结果: 白龙须能够抑制RA-FLS的增殖,降低共培养体系细胞上清中IL-6、IL-17、IL-23、TNF-α等4种炎症细胞因子的浓度,降低RA-FLS中pSTAT-3的表达量,同时上调SOCS-3蛋白表达。 结论: 白龙须可能通过抑制STAT-3/IL-17炎症通路的活化发挥抗炎作用,抑制RA-FLS持续性增殖。
【关键词】 类风湿关节炎;滑膜细胞;白龙须;信号传导及转录激活蛋白3;白介素17
【中图分类号】R285.5 【文献标志码】A 【文章编号】1007-8517(2023)13-0017-06
DOI:10.3969/j.issn.1007-8517.2023.13.zgmzmjyyzz202313005
Effects of Bailongxu on STAT-3/IL-17 Inflammatory Pathway in RA Synovial Cells
YANG Qingwan1,3 LAN Tianzuo1* AN Yang2 XIE Liangshan3 PAN Xiaoyi3 QIU Weibin3 LEI Yumei3
1.The First Peoples Hospital of Guiyang, Guiyang 550001, China;
2.The Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550002, China;
3.Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China
Abstract: Objective To observe the effect of Miao medicine Bailongxu on the proliferation of synovial fibroblasts (RA-FLS) and the inflammatory pathway related to STAT-3 in patients with rheumatoid arthritis, and to reveal the regulation mechanism of the inflammatory pathway related STAT-3/IL-17 in synoviocytes. Method We selected 3-5 generations of RA-FLS cells, and divided them into blank group (fetal calf serum), normal group (normal rabbit serum), triptolide (TG) group, leflunomide (LEF) group, Bailongxu low-dose group, Bailongxu medium-dose group and Bailongxu high-dose group. The cultures were cultured according to the prescribed dose with serum. Differences in proliferation inhibition of RA-FLS in each groups were determined by CCK8. The concentrations of inflammatory cytokines IL-6, IL-17, IL-23, and TNF-α were determined in the supernatants jointly containing RA-FLS with CD4+ T cells by ELISA. The protein expression of pSTAT-3 and SOCS-3 in RA-FLS was detected by the protein blotting method (Wersten Blots). Results It could inhibit the proliferation of RA-FLS, reduce the concentration of four inflammatory cytokines: IL-6, IL-17, IL-23, and cell-TNF-α, and reduce pSTAT-3 expression and upregulate the SOCS-3 protein expression in RA-FLS. Conclusion It may exert an anti-inflammatory effect and inhibit RA-FLS persistent proliferation by inhibiting the activation of STAT-3 / IL-17 inflammatory pathway.
Key words: Rheumatoid Arthritis;Synovial Cells;Bailongxu;Signal Transducer and Achtivator of Transcription 3;Interleukin 17
类风湿关节炎(rheumatoid arthritis, RA)是一种由T细胞、B细胞等多种免疫细胞参与的自身免疫性疾病,该病主要病理特征是关节滑膜炎,滑膜细胞恶性增殖,形成血管翳并逐渐侵蚀关节软骨与骨组织,最终导致关节畸形、残废[1]。流行病学显示[2-3],我国RA的患病率逐年上升,随着人口规模不断增多,目前我国RA的患病率为0.42%左右,其中致残率约50.3%。RA病情控制对患者的预后和生活质量极为关键,控制炎症状态可以延缓关节损害和系统性损伤。白介素17(interleukin 17,IL-17)对RA发病发挥着重要作用,而信号传导及转录激活蛋白3(signal transducer and achtivator of transcription 3,STAT-3)是IL-17分泌及细胞炎症信号传递的关键调节蛋白。细胞微环境异常表达IL-6时,滑膜等细胞膜表面的受体与之结合,形成IL-6/IL-6R复合物,进一步激活细胞膜表面糖蛋白130(Glycoprotein130,gp130),gp130与细胞膜中的Janus激酶(janus achtivated kinase,JAK)密切相联,可招募STAT-3并使其磷酸化,从而激活JAK/STAT信号通路,诱导合成IL-6、IL-17、IL-21、23等致炎因子[4]。细胞因子信号蛋白抑制分子3(suppressor of cytokine signaling 3,SOCS-3)是依赖STAT-3磷酸化的重要调控因子,是STAT-3信号通路的抑制蛋白[5]。干预STAT-3/IL-17信号通路,可以调节IL-17等炎症细胞因子释放,控制滑膜炎症。白龙须为八角枫[ Alangium chinense (Lour.) Harms]的须根,又称白金条、白筋条,具有祛风除湿、舒筋通络、散瘀止痛等功效,是苗医运用攻毒法治疗风湿疼痛的常用药物,研究显示白龙须对类风湿关节炎患者及CIA模型大鼠有较好抗炎止痛效果,但具体机制的相关报道较少,故本文通过建立类风湿关节炎滑膜细胞(RA-FLS)模型,给予相应兔含药血清干预,观察对RA-FLS增殖、炎症因子及关键蛋白pSTAT-3、SOCS-3的影响,探讨白龙须的抗炎机制。
1 材料和方法
1.1 制备滑膜细胞及传代、培养 滑膜取自于贵州中医药大学第二附属医院骨二科行关节置换的RA患者,患者符合美国风湿病学会/联合欧洲抗风湿病联盟(ACR/EULAR)2009年类风湿关节炎分类标准,签署患者知情同意书(院内伦理批号:PY2019054)。取RA患者关节滑膜组织,PBS溶液浸泡转运,剔除电刀切除产生的烧焦组织、血凝块、脂肪等其他组织,剁切成约1 mm3的组织块,加入培养液制成匀浆,匀浆涂抹在细胞培养瓶底部,置于37 ℃含5%CO2的培养箱孵养,倒置显微镜看到组织块周围增生出梭状细胞,经Vimentin免疫细胞化学染色鉴定阳性(胞浆大量棕黄色颗粒),即得原代细胞。待梭型RA-FLS长满瓶底的90%以上时,加入0.25%EDTA胰酶消化细胞,倒置显微镜看到梭状结构变圆、间距增大及较多细胞呈圆颗粒状随培养液流动时加入培养液终止消化,低温离心6 min,去上清后加入培养液吹打混匀,按1∶ 2进行传代。按3 mL/瓶(25 cm2)加培养液,隔5d换液,或培养液颜色变为橘色后换液。取3~5代RA-FLS用于后续试验。
1.2 药物与试剂 来氟米特片购自苏州长征-欣凯制药有限公司(批号190607),雷公藤多苷片购自贵州汉方制药有限公司(批号1410044), 白龙须取自八角枫科植物八角枫的须根。DMEM高糖培养基、胎牛血清(FBS)、胰蛋白酶、双抗购自美国GIBCO公司,CCK8试剂盒购自APExBIO,细胞周期试剂盒购自BD Pharminen,Wersten Blots抗体购自CST,ECL试剂盒、快转液购自美国BIO-RAD公司,RIPA裂解液、一抗/二抗稀释液、封闭液、TEMED 、APS 、BCA测定试剂盒购自上海碧云天生物技术有限公司,PVDF膜购自Immobilon,10X TBST、PBS溶液购自北京索莱宝科技有限公司,Elisa试剂盒购自深圳子科生物科技有限公司。
1.3 制备含药血清 新西兰大白兔18只(贵州中医药大学动物实验中心提供,免检合格,许可证号:SCXK[黔]2020-0001),雄性,SF级,随机分为6组,每组3只,即正常组、雷公藤多苷组(tripterygium glycoside,TG)、来氟米特组(leflunomide,LEF)、白龙须低剂量组、白龙须中剂量组、白龙须高剂量组。根据人与兔体质量换算各组给药量,白龙须组灌服白龙须提取物溶液(成人每日用药量6 g,据人与兔换算系数 W =3.08[6],低、中、高分别为每日每千克用量0.1 g、0.3 g和1 g),TG组灌服雷公藤多苷水悬液3 mg/(kg·d),LEF组灌胃来氟米特片悬混液1 mg/(kg·d),正常组不予药物灌胃,连续1周, 于末次给药2 h后无菌条件下心脏取血,2000转/分离心分离血清,组内血清混合,用0.22 μm微孔濾膜过滤除菌,水浴锅100 ℃灭活,置-80 ℃保存备用。
1.4 CD4+T细胞的获取和制备 RA患者静脉血4 mL,加入PBS 4 mL混匀,沿试管内侧壁缓慢加入含同等体积Ficoll试管,常温离心20 min,吸取管中呈白膜状的交界层至另一试管,加入4倍体积PBS,离心10 min弃上清,进行细胞计数。加入Buffer 80 μL重悬细胞,加入CD4磁珠 20 μL混匀后4 ℃静置15 min,Buffer洗涤、重悬细胞,固定MS分选柱,Buffer清洗1次,将细胞悬液加入MS柱,待悬液流净后加入清洗MS柱,重复3次,取下分选柱加入Buffer 1 mL,用力迅速下压分选柱活塞,即得到到CD4+T细胞。
1.5 CCK8法检测滑膜细胞增殖抑制率 取3~5代RA-FLS,计数后按5×103个/孔接种至96孔板。设置空白组、正常组、TG组、LEF组、白龙须低剂量组、白龙须中剂量组、白龙须高剂量组等7组,其中空白組予胎牛血清、正常组予正常兔血清,对照孔接种细胞后加入普通培养液,另设校正孔(不接种细胞),每组6孔,配制相应浓度培养液,每孔加入适量各浓度培养液(与细胞悬混液共200 μL),空白孔加入PBS,恒温箱孵育24 h,每孔加入加入CCK8试剂溶液10 μL,37 ℃避光孵育4 h,酶标仪450 nm检测OD值,细胞抑制率=(空白孔-实验孔)/空白孔×100%。
1.6 ELISA法检测共培养体系细胞上清相关细胞因子 取3~5代RA-FLS,计数后按1×105个/孔接种至6孔板,每孔加入CD4+T细胞1×106,实验分组及给药方法同1.4。各组加入含药血清培养液1 mL后孵育48 h,取培养液4 ℃、1500转/分离心8 min去除杂质后即得细胞上清。取板条置于室温下平衡30 min,设置标准孔和样品孔,每孔设置2个复孔,按说明书酶标仪450 nm处测各孔OD值。绘制标准曲线,运用EXCEL以标准品浓度为X轴、标准孔OD值为Y轴绘制回归曲线,得到函数计算各孔浓度。
1.7 Wersten Blots检测SOCS-3、pSTAT-3表达量 按5×105个/瓶将RA-FLS置于25 cm2培养瓶培养,实验分组及给药方法同1.4。恒温箱孵育24 h后每瓶加入3 mL培养液,培养48 h。消化、离心收集细胞,加入细胞裂解液3 mL,冰上静置15 min,4 ℃、12000转/分离心5 min,取上清进行BCA定量加入5X Loading buffer,煮沸后迅速冰浴。制胶进行SDS-PAGE电泳,用半干转法电转至激活的PVDF膜,将转好的PVDF膜镊子取出置于定性滤纸,手术刀片切出目标条带,置于分格盒,加快转封闭液3~4 mL,置于脱色摇床,p-STAT-3条带摇5 min,SOCS-3与内参(兔抗GAPDH)条带摇15 min。封闭完成后吸除封闭液,每格加入对应的一抗溶液4 mL,4 ℃静置过夜后加TBST溶液4 mL摇荡5 min洗涤三次,加二抗溶液4 mL摇荡1 h。将转印膜置于洁净曝光板,滴加适当显影剂,Bio-Rad ChemiDocTM Touch 超灵敏多功能化学发光成像系统曝光机板上进行曝光、测取各条带的标准化光密度值。WB结果相对值=目标蛋白光密度值/GAPDH光密度值。
1.8 统计学分析 所有实验数据用SPSS22.0进行统计分析。对上述数据进行正态性检验,若 P >0.05即为符合正态性分布,所有数据均符合正态分布。数据采用单因素方差分析,分析结果以均数加减标准差( x ±s )进行记录, P <0.05为有统计学差异。
2 结果
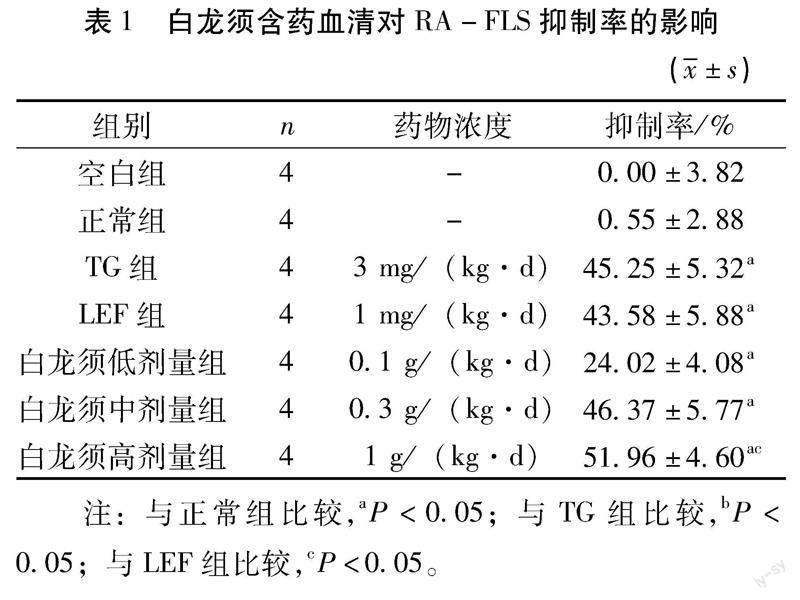
2.1 白龙须对RA-FLS增殖抑制率的影响 干预24 h并加入CCK8试剂反应4 h,将96孔板上酶标仪检测,450 nm测得各组OD值,结果见表1。与空白组、正常组比较,各组对RA-FLS抑制率明显升高( P <0.05);白龙须低剂量组低于其余治疗组,白龙须高剂量组抑制率显著高于TG组、LEF组( P <0.05),TG组、LEF组、白龙须中组组间无统计学差异( P <0.05)。
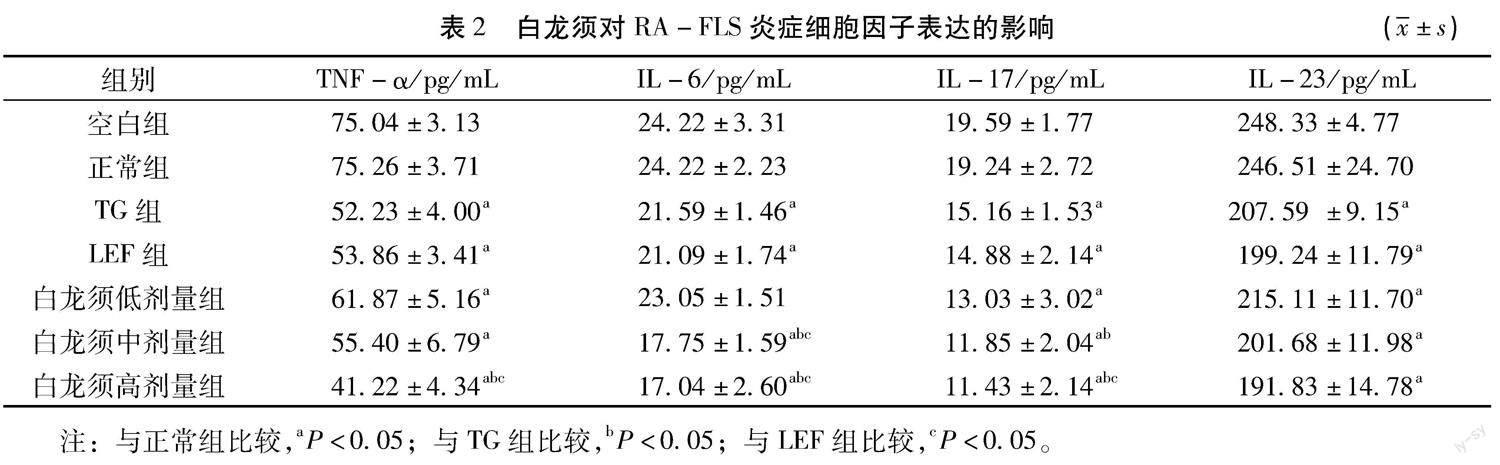
2.2 ELISA法检测细胞上清相关细胞因子 干预48 h后,取细胞上清用Elisa法检测IL-6、IL-17、IL-23、TNF-α的浓度,结果见表2。各组IL-6浓度结果显示:TG组、LEF组、 白龙须中剂量组、白龙须高剂量组与空白组、正常组比较有统计学差异( P< 0.05),白龙须中剂量组、白龙须高剂量组明显高于TG组、LEF组( P <0.05),白龙须低剂量组IL-6下降不明显( P >0.05)。IL-17浓度:各治疗组与正常组比较明显降低( P <0.05),白龙须高剂量组明显低于TG组、LEF组( P <0.05),白龙须中剂量组低于TG组( P <0.05),但TG组、LEF组、白龙须低剂量组组间无明显差异( P >0.05)。IL-23浓度:各治疗组显著低于正常组( P <0.05),但治疗组间比较无统计学差异( P >0.05)。TNF-α浓度:各治疗组与正常组比较明显降低( P <0.05),白龙须高剂量组明显低于其他治疗组( P <0.05),除白龙须高剂量组外其他治疗组组间浓度无明显差异( P >0.05)。
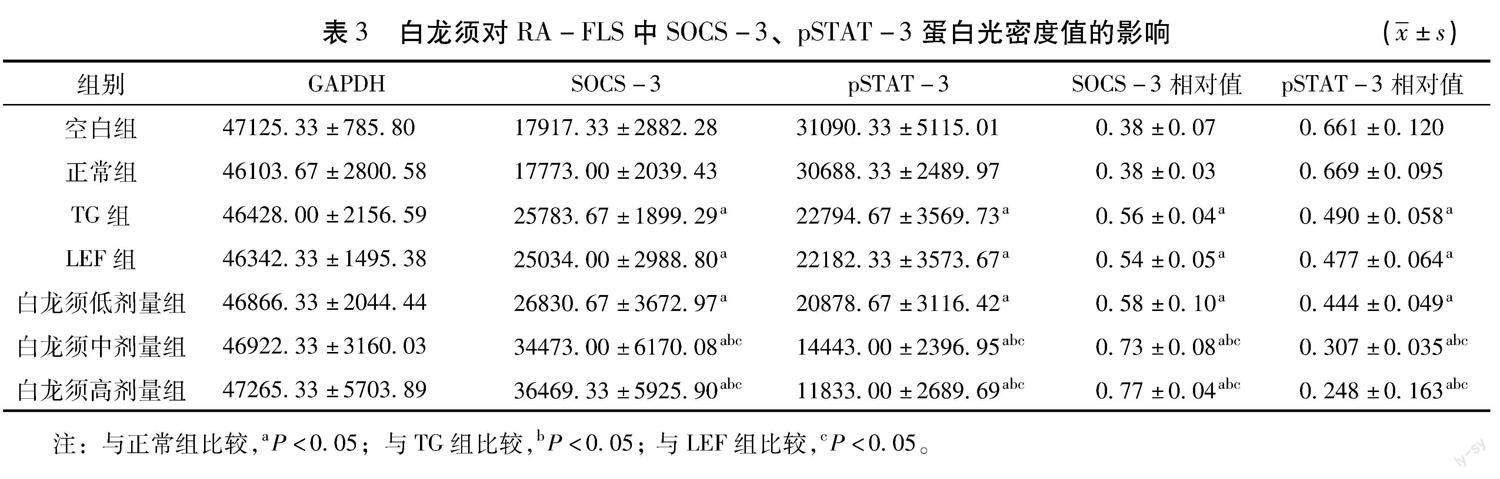
2.3 Wersten Blots检测SOCS-3、pSTAT-3 给药48 h后,Wersten Blots法检测各组细胞中pSTAT-3、SOCS-3蛋白的表达量,结果见表3,如图1。各治疗组pSTAT-3蛋白表达绝对值与相对值均明显低于空白组、正常组( P <0.05),白龙须中剂量、高剂量组显著低于其他3个治疗组( P <0.05)。在SOCS-3绝对值与相对值方面,各治疗组与空白组、正常组比较均能明显增加;RA-FLS中SOCS-3的表达,以白龙须中剂量组、白龙须高剂量组表达量最高;白龙须低剂量组与LEF组、TG组比较无差异( P >0.05)。内参(兔抗GAPDH)各组间比较均差异无统计学意义。
3 讨论
RA是一种以对称性关节炎为特征的免疫系统疾病,主要病理基础是持续性滑膜炎,具体病因及发病机制尚未明确。研究[7]显示,高度异常表达的细胞因子在RA疾病过程中发挥着重要的作用,以TNF-α、白介素家族为代表的炎症细胞因子既是炎症发生的关键原因,也是炎症反应的重要产物。高水平的IL-6作用于滑膜细胞,导致滑膜组织及周围结缔组织的血管通透性增加,从而出现关节肿胀、疼痛。未受控制的炎症过程是RA引起全身器官损伤的主要原因,控制炎症反应即可有效控制RA病情进展,STAT-3/IL-17通路是最为经典的炎症调控通路之一,干预该路径能有效促使RA缓解。在STAT-3/IL-17信号通路中,IL-6是上游刺激因子,通过关键蛋白STAT-3调节TNF-α、IL-17、IL-23等下游效应细胞因子的释放和表达,该过程受SCOS-3的负反馈调节,如图2所示。
STAT-3是STAT家族7个成员中生物活性最强的成员,Tomoaki等[8]研究报道了IL-6过度表达,游离性IL-6与其受体结合后提升细胞膜表面gp130活性,招募并磷酸化STAT蛋白,激活JAK/STAT信号通路,促使CD4+T细胞诱导向Th17分化,合成IL-6、IL-17、IL-23等致炎因子,促使CD4+T细胞诱导向Th17分化,合成IL-6、IL-17、IL-23等致炎因子。RA患者外周血中STAT-3通路过度活化,运用STAT-3抑制剂可以令RA患者T细胞功能得到恢复[9]。SOCS家族是JAK/STAT信号传导通路的主要抑制机制,可以对炎症细胞因子激发的免疫反应进行精准的负反馈调节[10-12]。SOCS1、SOCS-3是SOCS家族8个成员中活性最高的2个成员,SOCS-3可以直接与被激活的细胞因子相关受体如Toll样受体等结合,竞争性抑制JAK酶和STAT-3蛋白与相应位点结合,从而阻断JAK/STAT-3通路的传导途径,介导细胞的增殖、分化和凋亡。SOCS-3失活将使JAK/STAT通路的抑制调节路径减弱,导致RA患者关节滑膜的持续恶性增生、炎症放大,而运用JAK酶抑制剂前激活SOCS-3的高表达比单用JAK拮抗剂的效果更优[13]。
IL-17是以二聚体形式存在的一类致炎因子,与IL-17R结合后发挥生物学作用,RA活动期患者血浆、关节液及滑膜组织中均有高水平的IL-17和IL-17R。2005年科学家在胶原蛋白诱导关节炎(CIA)等免疫性疾病模型中发现IL-17主要由新的辅助性T细胞亚群即Th17分泌[14],后续研究[15]发现在IL-23的参与下γδT淋巴细胞通过维甲酸相关孤核受体α(retinod id receptor related orphan receptor α,RORα)途径可以增加IL-17的分泌。IL-17刺激角质细胞释放细胞间粘附分子1(ICAM-1)的表达促进T细胞的活化增殖,使得大量的T细胞、粒细胞被集附到关节滑膜等组织,造成滑膜炎;在TNF-α等其他因子的协同作用下,IL-17促使滑膜细胞合成前列腺素(PG)、MMP1等炎症介质,扩大炎症反应,造成软骨和骨质的破坏,加重免疫系统损伤。TNF-α作为一种多肽类促炎因子,主要参与了RA的炎症过程和骨质破坏。在活动期的RA患者血清中TNF-α水平明显高于低活动度RA患者[16]。TNF-α的高表达促进了粘附因子分泌,进而诱导滑膜成纤维细胞的增殖和活化,导致滑膜进行性增生。
RA在苗医理论中被称为冷骨风、骨节风、猫头风,外界潮湿之气侵袭人体,或体内水气太过,聚为湿毒,夹杂风毒、冷毒,留滞于骨节、筋脉,气血瘀阻于关节,出现关节疼痛、麻木、活动不利等不适,这与“风、寒、湿邪合而为痹”的中医理论在一定程度上相一致,与当今感染、抗原等外因启动关节滑膜炎症的认识亦有相通之处。攻毒法是指苗医药理论中运用有毒药物去攻除致病毒素的一种治法,有毒之物药力峻猛、易伤人体,但合理使用能够起到疗顽疾、起沉疴之效,在跌打损伤、风湿痹痛等损伤严重或病势缠绵难愈的疾病中常常使用攻毒法[17]。白龙须是苗医运用攻毒法治疗风湿疼痛的常用药物之一,含有八角枫碱、水杨苷、马钱子苷酸等多种化合物,其中水杨苷、马钱子苷酸有很好的抗炎作用,八角枫碱又称毒藜碱,是引起八角枫毒性的主要原因[18-19]。白龙须有效成分的药理作用主要包括肌肉松弛、抗炎镇痛、抗菌、抑制呼吸及中枢等[20]。张威等[21]采用热板法和扭体法考察白龙须总提物对小鼠的镇痛作用,采用二甲苯引起小鼠耳廓肿胀实验观察白龙须总提物的抗炎作用,结果表明白龙须总碱具有较好的抗炎、镇痛作用。江勇等[22]通过研究证实了白龙须提液能够减轻 CIA模型大鼠的炎症反应、关节软骨退化及骨破坏,而其机制可能与下调血清中IL-1β、TNF-α水平,调节OPG/RANKL/RANK通路平衡有关。徐李玲等[23]将白龙须蒸煮、浓缩制成胶丸,用于治疗CIA大鼠并与雷公藤多苷比较,发现白龙须丸剂及雷公藤多苷组均显著降低CIA大鼠血清IL-6水平 ,同时降低大鼠踝关节滑膜组織IL-6、TLR4蛋白表达及IRAK1、TLR4 mRNA相对表达量,提示白龙须可能通过抑制炎症因子水平及NF-κB信号通路的激活发挥对RA的治疗作用。
本研究发现,白龙须不同浓度对滑膜细胞增殖均有抑制作用,并呈剂量依赖特征,标准剂量及3倍剂量白龙须的增殖抑制作用优于RA临床运用较广的雷公藤多苷和来氟米特。进一步对STAT-3/IL-17炎症通路研究发现,白龙须能抑制RA-FLS中pSTAT-3蛋白的表达,而该通路的负调控蛋白SOCS-3表达量增加,同时RA-FLS与CD4+T细胞共培养体系上清中的上下游细胞因子浓度均明显降低,低剂量白龙须与雷公藤多苷、来氟米特的差异不明显,但标准剂量白龙须和高剂量白龙须对相应蛋白和细胞因子IL-6、IL-17的调控效果均优于雷公藤多苷、来氟米特,提示白龙须能较好地下调滑膜细胞STAT-3/IL-17炎症通路活化水平,可能抑制CD4+T细胞向Th17转化,减少RA-FLS释放炎症细胞因子,进而有效控制滑膜炎症。
本研究也存在一定不足,细胞模型不一定能完全反应人体在体实验和动物模型试验的情况,存在局限性,因此需要在临床试验和动物模型中进一步验证和探讨白龙须对STAT-3/IL-17炎症通路的关键蛋白和细胞因子的调控作用。但是,本研究证实了白龙须对滑膜细胞STAT-3/IL-17炎症通路具有抑制作用,能阻断炎症信号传导,控制滑膜持续性炎症。
参考文献
[1]
汤晓菲, 丁秋玲, 孙鹏飞, 等. 膝类风湿关节炎与骨关节炎的MRI及超声表现分析[J]. 北京医学, 2019, 41(7):538-541.
[2]胡鲲,苏军,陈新春,等.贵州黔南地区20~79岁农村居民类风湿关节炎患病现状及危险因素[J].中国公共卫生,2019,35(7):813-817.
[3]周云杉,王秀茹,安媛,等.全国多中心类风湿关节炎患者残疾及功能受限情况的调查[J].中华风湿病学杂志,2013,17(8):526-532.
[4]YANG R, MASTERS A R, FORTNER K A, et al. IL-6 promotes the differentiation of a subset of naive CD8+ T cells into IL-21-producing B helper CD8+ T cells[J]. Journal of Experimental Medicine, 2016, 213(11):2281-2291.
[5]董文哲,刘健,端淑杰.新风胶囊通过调节SOCS1/STAT3/miR326改善类风湿关节炎患者Th17/Treg失衡状态[J].免疫学杂志,2018,34(6):499-506.
[6]黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004,9(9):1069-1072.
[7]罗帅,李小枫,黄成,等.炎症因子在类风湿关节炎中的研究进展[J].中国药理学通报,2022,38(3):330-338.
[8]TOMOAKI M, TAKESHI M, HIDEYUKI Y, et al. IL-1β and TNFα-initiated IL-6-STAT3 pathway is critical in mediating inflammatory cytokines and RANKL expression in inflammatory arthritis[J]. International Immunology,2011,23(11):701-712.
[9]秦丹丹,魏明.信号转导与转录因子3信号通路对类风湿关节炎患者外周血调节性T细胞功能的影响以及调控机制[J].中华风湿病学杂志,2019,23(8):518-523.
[10] STAR R, WILLSON T A, VINEY E M, et al.A family of cytokine-inducible inhibitors of signalling[J]. Nature, 1997,387(6636):917-921.
[11]COONEY, ROBERT N. Suppressors of Cytokine Signaling (SOCS): Inhibitors of the JAK/STAT Pathway[J]. Shock, 2002, 17(2):83-90.
[12] LARSEN L, RPKE C. Suppressors of cytokine signalling: SOCS[J]. APMIS, 2002,110(12):833-844.
[13]WALKER S R, XIANG M, FRANK D A. Distinct roles of STAT3 and STAT5 in the pathogenesis and targeted therapy of breast cancer[J]. Molecular and Cellular Endocrinology, 2014, 382(1):616-621.
[14]HARRINGTON L E, HATTON R D, MANGAN P R, et al. Interleukin 17-producing CD4+ effector T cells develop vi a a lineage distinct from the T helper type 1 and 2 lineages[J]. Nature Immunology, 2005, 6(11):1123-1132.
[15]CUTHBERT R J, BRIDGEWOOD C, WATAD A, et al. Evidence that tissue resident human enthesis γδT-cells can produce IL-17A independently of IL-23R transcript expression[J]. Annals of the Rheumatic Diseases, 2019, 78(11):1559-1565
[16]王瑞萍. 類风湿关节炎患者血清中抗CCP抗体和TNF-α表达的临床意义[J]. 重庆医学, 2017, 46(12):1624-1625.
[17]杜江,张景梅.苗医基础[M].北京: 中医古籍出版社,2007:51.
[18] 马春云,杨怀镜.白族药八边叶(八角枫)的研究进展[J].中国民族民间医药,2011,20(21):6-8.
[19] 刘毅, 徐莛婷, 赵波,等. 苗药八角枫的药学研究进展[J]. 微量元素与健康研究, 2012, 29(1):57-60,64.
[20]蒙燕瑶,杜洪志,王小波,等. 苗药八角枫化学成分及药理作用研究进展[J]. 微量元素与健康研究, 2021,38(3):40-43.
[21]张威, 徐红梅, 任娜,等.八角枫对佐剂性关节炎大鼠的治疗作用及毒性[J]. 合肥工业大学学报(自然科学版), 2012, 35(6):832-836.
[22]江勇, 梁子聪, 陈其宽, 等.苗药八角枫水提液对CIA模型大鼠血清IL-1β、TNF-α水平及滑膜OPG/RANKL/RANK系统的影响[J]. 中国药房, 2018, 29(24):94-99.
[23]徐李玲, 梁宝贤, 郭殊玮,等. 八角枫丸剂对胶原诱导性关节炎大鼠的作用机制研究[J].广西医科大学学报,2020,37(12): 2111-2116.
(收稿日期:2022-10-19 编辑:刘 斌)
