Wnt/β-catenin通路在新北美圣草苷促进BMSCs成骨分化中的介导作用*
2023-07-27曾文丛曾芳俊
曾文丛 曾芳俊 何 伟
江西省赣州市人民医院脊柱外科 341000
骨质疏松症是临床中老年人和绝经后女性的常见病症,以骨组织微结构改变、骨量减少为主要特征,进而引起骨骼脆性增加、强度下降,是一种系统性代谢骨病。骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)具有多向分化能力,可以定向分化为神经元、成骨细胞、软骨细胞及脂肪细胞等,研究证实,BMSCs所分化的成骨细胞在骨组织形成、维持和重建等过程中发挥关键作用,骨质疏松症的发生发展与BMSCs分化失衡关系密切[1]。BMSCs成骨分化过程受到多个通路调节,如MAPKK通路、Wnt/β-catenin通路、Notch通路及RANKL/RANK/OPG通路等,而经典Wnt/β-catenin通路已被证实是BMSCs成骨分化的关键通路[2-3]。骨碎补取自蕨类植物槲蕨的根茎,是骨科中常用的中药,具有补腰肾强筋骨、止痛续伤的作用,可有效缓解骨质疏松症状[4],但具体作用机制尚无明确阐述。新北美圣草苷(Neoeriocitrin)是骨碎补的主要成分之一。本研究采用体外培养的研究方法,以BMSCs作为靶细胞,探讨新北美圣草苷调节其成骨分化的作用机制。
1 材料与方法
1.1 实验动物与试剂器材
1.1.1 实验动物:选取SPF级3月龄大鼠30只,体重(200±20)g,购于济南朋悦实验动物繁育有限公司,批号:SCXK(鲁)20140007。
1.1.2 主要实验药品、试剂及实验器材:骨碎补购于中药房;南美胎牛血清(Hy-Clone,批号:NZJ1221);碱性磷酸酶染液(南京建生成物,批号:20160818);β-甘油磷酸钠(上海源叶生物,批号:S20S7G21494);碱性磷酸酶检测试剂盒(南京建成生物,批号:20160813);大鼠β-catenin ELISA kit(武汉基因美,批号GR201612-1);Transcriptor Frist Strand cDNA Synthesis Kit(Roche,批号13713422);逆转录试剂盒(大连宝生物)。高速冷冻离心机(Neofuge23R,上海力康);显微镜(OLYMPUS/IX71,日本奥林巴斯);酶联免疫仪(Biotek Elx800,美国伯腾);CO2培养箱(HF160W,上海力康);恒温水浴锅(HH-2,江苏金坛荣华);流式细胞仪(BD FACSVERSE,美国);超洁净工作台(SW-CJ-2FD,上海博讯实业)。
1.2 实验方法
1.2.1 新北美圣草苷含药血清制备:依据成人患者每日所进药量换算得出大鼠用药量,采用水煎法将骨碎补药液浓缩,储存于4℃备用,使用前恢复至室温。将大鼠依照随机数字表法随机分为对照组、低剂量组、高剂量组,每组10只大鼠。每日早8点和下午2点进行灌胃处置,剂量如下:低剂量组灌服0.81g/kg骨碎补水煎液,高剂量组灌服4.05g/kg骨碎补水煎液,对照组灌服等体积生理盐水。连续灌胃干预3d。末次灌胃1.5h后,取大鼠腹主动脉血,以4℃、2 500r/min离心20min后,取上层清液,经56℃水浴灭活后过滤,-20℃保存备用。
1.2.2 BMSCs培养与扩增:选用全脊髓贴壁法制备BMSCs:将大鼠麻醉后,于75%乙醇溶液内浸泡10min,于超洁净工作台上分离大鼠股骨,继续置于75%乙醇溶液中浸泡20s后,取出股骨干骺端。随后以100kU/L青霉素、链霉素合并10%胎牛血清与L-DMEM培养基反复冲洗大鼠股骨髓腔至股骨表面微亮。将髓腔冲洗液收集后置于25ml培养瓶内,放入5%CO2培养箱,37℃继续培养。24h后换液1次,随后每2d换液1次。当80%以上细胞融合后,选取0.25%胰蛋白酶进行消化,依照1∶3进行传代培养。选取第三代生长较好的细胞,应用流式细胞仪对所培育细胞表面抗原进行检测,确定其免疫表型。
1.2.3 细胞分组及给药:将细胞分为对照组、低剂量组、高剂量组。低剂量组细胞给予L-DMEM、成骨分化诱导液和10%低剂量含药血清;高剂量组细胞给予L-DMEM、成骨分化诱导液和10%高剂量含药血清;对照组细胞给予L-DMEM、100kU/L青霉素和100kU/L链霉素,成骨分化诱导液及10%胎牛血清培养基。连续干预10d。
1.3 实验指标
1.3.1 BMSCs的鉴定:研究证实,BMSCs表面抗原标记对CD34、CD45等阴性反应,对CD29、CD104、CD44等阳性反应。选用0.25%胰蛋白酶消化细胞后,制备单细胞悬液,以1 500r/min离心3min后进行PBS重悬,细胞浓度为2×105/ml。PBS冲洗2次后,取400μl细胞悬液,加入PE、APC、FITC标记的抗体,随后避光条件下孵育40min,再以PBS冲洗1次,以流式细胞仪进行检测。
1.3.2 细胞增殖水平比较:选取第三代生长良好的细胞,制备为单细胞悬液,以1×104/mm接种于96孔培养板,每孔滴入100μl细胞悬液。各组设置6个复孔,加入各组对应的培养基,随后置于5%CO2培养箱,37℃继续培养。于培养的第3、5、7、9天取出板进行检测。向每孔内滴加10μl CCK-8,37℃条件下孵育4h。在酶标仪中选取490nm波长,检测各孔吸光度(A)。各组细胞增殖水平以A490吸光度值表示。
1.3.3 BMSCs矿化能力比较:将第三代BMSCs接种于6孔板上,各组设置3个复孔。待培养至21d时,去掉培养液以PBS冲洗,使用95%乙醇溶液将细胞固定30min,随后以0.2%茜素红染色30min,以清水冲洗。将细胞置于40倍光镜下观察拍照,并计算各组的矿化结节数量。
1.3.4 成骨相关mRNA及Wnt/β-catenin通路相关mRNA表达水平比较: 将BMSCs以1×104/ml接种于6孔板内,待瓶底80%以上被细胞铺满时,分别加入各自的培养液继续培养,每2d进行1次换液。培养7d后,提取各组细胞总RNA,选用光度计检测RNA纯度在1.8~2.2范围内则认为总RNA纯度较好,可用于后续检测,置于-80℃冰箱内保存备用。参考逆转录试剂盒说明书进行操作,于冰上加入4μl 5×Primescript buffer,Oligo dT primer、Primescript RT Enzyme mix I、Random 6 mers各1μl,1μg总RNA,随后滴加RNase Free ddH2O至20μl,反应体系即配置成功。随后进行反转录:37℃ 15min,85℃ 5s,4℃条件下保存。参照试剂盒操作步骤说明进行操作,反应条件:95℃ 5min,95℃ 20s,62℃ 15s,72℃ 15s,72℃ 5min,其中后4个步骤循环45次。检测mRNA的表达情况,由程序生成标准曲线,记录CT值,并计算各组mRNA/空白组mRNA倍数。RT-PCR引物由生工生物工程公司合成,引物序列详见表1。

表1 引物基因序列
1.3.5 β-catenin蛋白、Lrp-5蛋白水平比较:各组取培养7d的BMSCs细胞,每组取6孔,依照下方操作步骤提取总蛋白:胰蛋白酶消化细胞,4℃ 1 500r/min 离心5min,随后以PBS冲洗3次,估算细胞总体积。将样本置于冰面,加入RIPA裂解液后,反应30min。4℃ 12 000r/min 离心10min,取上层清液,依据试剂盒操作步骤检测β-catenin蛋白及LRP蛋白表达水平。
1.4 统计学方法 选用SPSS20.0软件对数据进行统计学分析,计量资料以均数±标准差表示,采用单因素方差分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 BMSCs形态及表型鉴定 接种初,其他细胞与BMSCs混杂,细胞呈圆形。24h后细胞开始贴壁生长,呈纺锤状,细胞数目较少。48h后可见部分细胞呈短梭形,有伪足(见图1a)。3d后贴壁细胞数量增加同时体积增大,细胞逐渐伸展为多角形、梭形,成簇生长(见图1b)。8d左右出现相互融合。10d左右细胞融合状态可达80%以上(图1c)。流式细胞仪检测结果显示,表面CD44、CD29、CD45阳性细胞比例分别为95.30%、94.25%、0.40%,结合形态观察结果可以确认所培养细胞为BMSCs。

图1 BMSCs形态学观察
2.2 各组BMSCs细胞增殖水平比较 与对照组相比,给药两组各时间点吸光度值明显增加,差异具有统计学意义(P<0.05);同时与低剂量组相比,高剂量组在各时间点吸光度值均明显升高,差异具有统计学意义(P<0.05);低剂量组、高剂量组在3~5d的促增殖作用更明显。详见表2。
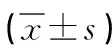
表2 各组BMSCs细胞增殖水平比较
2.3 各组BMSCs矿化能力比较 在干预21d后,各组BMSCs均形成矿化结节。经茜素红染色后表现为大小不等的红色致密结节。三组矿化结节数量显示:高剂量组(15.35±4.10)>低剂量组(11.24±2.61)>对照组(5.33±1.21),差异具有统计学意义(P<0.05)。
2.4 各组β-catenin、Lrp-5、Osterix、RUNX-2、Gsk-3β mRNA表达水平比较 干预7d后,给药两组的GSK-3β mRNA表达明显低于对照组,且高剂量组低于低剂量组;β-catenin、Lrp-5、Osterix、RUNX-2 mRNA表达明显高于对照组,且高剂量组高于低剂量组,差异具有统计学意义(P<0.05)。详见表3。
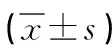
表3 各组β-catenin、Lrp-5、Osterix、RUNX-2、Gsk-3β mRNA表达水平比较
2.5 各组β-catenin蛋白、Lrp-5蛋白水平比较 干预7d后,给药两组的β-catenin蛋白、Lrp-5蛋白水平明显高于对照组,且高剂量组高于低剂量组,差异具有统计学意义(P<0.05)。详见表4、图2。

图2 β-catenin、Lrp-5蛋白的表达

表4 各组β-catenin蛋白、Lrp-5蛋白水平比较
3 讨论
骨质疏松是引起中老年人骨折的主要原因之一,严重影响患者的日常生活,且增加社会医疗负担[3]。人体骨骼的细胞成分主要为骨细胞,约占细胞总数的90%。骨细胞具有内分泌功能和传导功能,同时可以感受机械刺激并转化为生物信号,对外界变化的力学环境产生适应性变化,调控成骨细胞和破骨细胞动态平衡,进行骨骼重建[2,5]。
骨质疏松症在传统医学中被归入“痿病”“虚劳”“骨痿”等证的范畴,中医理论认为,骨生长发育状态与肾精充沛与否关系密切[6-7]。《黄帝内经》有“肾者,主骨生髓”以及“肾气热,则腰脊不举,骨枯而髓减”等论述,提示本病的病位主要在肾,故当以补腰肾强筋骨论治。以干细胞为理论基础的骨再生技术近年来成为骨缺损和骨质疏松症等多种骨科疾病的热点技术,其中促进干细胞成骨分化及自我更新是该治疗技术的核心[8-9]。
骨碎补是补肾壮骨类中药,相关体外研究证实[10],骨碎补对BMSCs有促进增殖和促进成骨分化的作用,新北美圣草苷正是其主要成分。故本研究中以BMSCs为靶细胞,探究新北美圣草苷促进其成骨分化的具体作用机制。
BMSCs经诱导可分化为脂肪细胞、软骨细胞、成骨细胞等,其成骨分化在骨组织的维持与重建中发挥重要作用[11]。本研究结果显示,低剂量组与高剂量组细胞吸光度明显高于对照组,提示含药血清可明显促进BMSCs的增殖作用,且3~5d时作用较明显,7~9d时增殖速度较缓慢可能与培养器材的限制相关,细胞密度达到了一定值。而刘伟等研究发现高浓度骨碎补提取物可产生抑制作用甚至毒副作用,在后续实验中可增加更高浓度组进行研究。同时给药两组的矿化结节数量明显高于对照组,高剂量组高于低剂量组,提示高浓度含药血清可有效促进BMSCs向矿化细胞及成骨细胞分化。
BMSCs成骨分化受多条通路的调控,其中经典Wnt/β-catenin通路发挥关键作用。β-catenin是经典Wnt/β-catenin通路的关键因子,其浓度与Wnt通路是否激活关系密切,同时其在细胞定性分化和细胞增殖中也起到关键作用[12-13]。当Wnt蛋白与Lrp-5/6及Frizzled受体结合后,细胞内散落蛋白被激活并激活下游GSK-3β的结合蛋白,而GSK-3β的结合蛋白可以下调β-catenin被GSK-3β的磷酸化程度,进而调控目标基因的表达[14]。RUNX2可以通过增加Ⅰ型胶原、骨桥蛋白及骨钙素等相关基因的转录进而促进BMSCs的成骨分化,其下游因子Osterix也是调控BMSCs成骨分化的重要因子[15-16]。本研究结果显示,BMSCs经诱导后,GSK-3β mRNA表达下调同时β-catenin、Lrp-5、Osterix、RUNX-2 mRNA上调,而β-catenin蛋白、Lrp-5蛋白水平均升高,且高剂量组优于低剂量组,提示含药血清能够调控Wnt/β-catenin通路相关蛋白及mRNA表达,进而促进BMSCs成骨分化。
综上所述,新北美圣草苷可以促进BMSCs的成骨分化及细胞增殖,可能与激活Wnt/β-catenin通路,下调GSK-3β mRNA表达,同时上调β-catenin、Lrp-5、Osterix、RUNX-2 mRNA,提高β-catenin蛋白、Lrp-5蛋白水平相关。
