PGC-1α/SIRT3信号通路在右美托咪定预处理大鼠脊髓缺血再灌注损伤中的作用及机制研究*
2023-07-27吴江燕程高升
吴江燕 程高升
福建省福州市第一医院 350009
脊髓缺血再灌注损伤(SCIRI)是指在脊髓缺血所导致的原发性脊髓损伤后,恢复血流再灌注所导致的中枢神经系统损伤,属于继发性神经细胞损害和功能障碍,在脊柱损伤、胸腹主动脉瘤、脊髓供血动脉疾患以及主动脉手术后常见,可导致不可逆性脊髓神经元迟发性死亡,严重时有潜在致残、致死性[1]。因此探寻有效减轻SCIRI损伤的方法,对临床上降低患者术后致残和致死率具有重要意义。再灌注损伤发生的机制复杂,原因较多,细胞凋亡和炎症反应是其中较为主要的两个原因,脊髓缺血导致细胞缺血缺氧,再灌注发生导致细胞内同时出现氧自由基和炎症反应爆发,钙超载等病理生理过程,最终加重损伤引起神经细胞凋亡、组织损伤并导致相关功能障碍[2-3]。右美托咪定(DEX)是一种具有高效选择性的α2-肾上腺素受体激动剂,因其具有镇静和镇痛作用,在临床麻醉和危重病例的治疗中得到广泛应用。有研究证实,除具有镇静、镇痛效应外,DEX还具有器官保护作用,DEX可以通过SIRT3介导的亲环素D(CypD)去乙酰化,通过抑制线粒体通透性转换孔开放,保护线粒体减少损伤,从而减轻大鼠肾缺血再灌注损伤[4]。同时还有研究证实,PGC-1α/SIRT3信号通路与细胞凋亡相关,作为转录调节因子,PGC-1α能够调控线粒体代谢、局部炎症反应以及机体氧化应激反应,而SIRT3作为PGC-1α信号通路中的下游靶基因,SIRT3激活后能够改善线粒体自噬和线粒体的合成,减轻氧化应激损伤,抑制细胞凋亡[5-6]。共同提示DEX预处理减轻大鼠脊髓缺血再灌注损伤可能与PGC-1α/SIRT3信号通路相关,但相关研究罕见报道。基于此背景,本研究通过观察DEX是否能够激活PGC-1α/SIRT3信号通路进而减轻SCIRI,以更加全面深入的探讨PGC-1α/SIRT3信号通路是否在DEX预处理减轻SCIRI中具有潜在作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:96只10~11周龄的SD雄性大鼠,SPF环境室温下自由饮水、标准饲料适应性饲养1周,体重在220~250(236±18)g,四川省实验动物专委会养殖场饲养。全程依照3R原则给予实验大鼠人道主义关怀。
1.1.2 主要试剂与仪器:PGC-1α抑制剂SR-18292(MCE中国,生产批号:20180219);盐酸右美托咪定注射液(江苏恒瑞医药股份有限公司,生产批号:国药准字H20090248);细胞TUNEL试剂盒(北京中山生物技术有限公司);细胞裂解液(碧云天生物技术研究所);荧光定量PCR试剂盒、反转录试剂盒、Trizol(日本TaKaRa 公司);Western blot 实验所用抗体(美国CST);蛋白定量试剂盒(自北京威格拉斯生物技术有限公司);透射电子显微镜(日本Olympus公司);显微镊(型号:15cm,直尖0.15mm)、显微剪(浙江宁波医用缝针厂); NikonTi-U/Ti-s倒置荧光显微镜(日本三菱公司,型号:H-7650);组织包埋机(德国Leica公司,型号:LEICAEG1150)。
1.2 方法
1.2.1 SCIRI大鼠模型构建和分组方式:大鼠麻醉后,常规消毒,右侧卧位固定后肋缘行纵切口,逐层分离,于心包处分离胸主动脉,弓锁骨动脉起始点无创动脉夹夹闭主动脉15min,sham组开胸但不夹闭,0.2ml氨苄青霉素(100mg/L)静脉注射预防感染。动物模型构建成功后,按照标准饮食进行单独喂养。分组:sham组、模型组、实验组以及DPA组,共四组,每组24只。其中:sham组(开胸但未进行夹闭处理,于建模前3h注射与DPA组DEX等量的生理盐水);模型组(开胸进行夹闭前3h注射与盐酸右美托咪定等量的生理盐水);实验组(于建模前3h鞘内注射与DPA组等量的盐酸右美托咪定);DPA组(开胸进行夹闭前3h鞘内注射腹腔注射DEX 40μg/kg,同时注射20μmol/L PGC-1α抑制剂SR-18292)。
1.2.2 BBB评分:评估大鼠神经运动功能,分别于再灌注6、8、12和24h时每组随机抽取6只大鼠,进行改良BBB评分法评分[7],最高分21分,分值越高大鼠后肢功能越好,连续测定3次计算平均值。
1.2.3 脊髓组织病理观察:24h运动功能评分结束后,每组取6只大鼠,断头处死后4%多聚甲醛400ml 将L4~6部位脊髓固定。经常规脱水、透明浸蜡、标记、石蜡包埋、切片(5μm)、HE染色。光学显微镜下观察拍照,计算其正常神经元计数的平均数。
1.2.4 检测大鼠脊髓组织细胞凋亡情况:再灌注12h完成BBB评分后,随机处死6只大鼠,取各组大鼠L4~6脊髓节段,固定后常规制备冰冻切片,2次于二甲苯中浸洗,对切片冲洗后,于2%的蛋白激酶K中消化15min,重复冲洗1次,以缓慢滴加TUNEL反应液于其中,37℃避光孵育1h,PBS冲洗液漂洗3次,2min/次,以20%浓度甘油缓冲液封片。于荧光显微镜下随机对每组6个不同视野进行观察,凋亡细胞百分比=凋亡细胞数/细胞总数×100%。
1.2.5 PGC-1α和SIRT3 mRNA表达:Trizol法抽提各组脊髓细胞中RNA,参照逆转录试剂盒使用说明合成cDNA,并以cDNA为模板进行扩增。2-ΔΔCt相对定量分析法进行统计分析。引物序列见表1。

表1 qRT-PCR引物序列及扩增产物长度
1.2.6 Western blot检测PGC-1α和SIRT3蛋白表达量:Western blot在大鼠脊髓组织加入预冷裂解液,研磨裂解脊髓组织,离心获得上清液。按照BCA试剂盒说明测定总蛋白浓度。取25μg总蛋白上样,通过10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离,分离蛋白转移至PDVF膜上。5%脱脂奶粉室温封闭2h,加入一抗SIRT3(1∶500)、PGC-1α(1∶1 000)和β-actin(1∶1 000),在4℃下培育1d,然后将膜与二抗一起培育2h。ECL化学发光试剂盒显影,采集图像获得条带,以GAPDH进行标定,ImageJ软件分析目的蛋白相对表达水平。

2 结果
2.1 四组BBB评分比较 与sham组相比,其余三组再灌注各时点BBB评分均显著降低(P<0.05);与模型组比较,实验组和DPA组再灌注各时点BBB评分显著升高(P<0.05);与实验组比较,DPA组再灌注各时点BBB评分显著降低(P<0.05)。见表2。
2.2 四组大鼠脊髓组织细胞凋亡情况及正常神经元计数 sham 组脊髓神经元结构较其余三组更佳,在光镜下较为完整,正常运动神经元较多,未见出血、空泡或肿胀,细胞核形态正常,轮廓清楚,呈多极性,细胞浆匀质红染。模型组脊髓神经元损伤严重,正常运动神经元较少,可见空泡形成,较多的神经元坏死,细胞核大量溶解。实验组与DPA组脊髓神经元结构较模型组稍好,其中实验组较DPA组稍好。与sham组比较,其余三组AI显著升高,神经元数量显著降低,其中模型组AI最高,神经元数最少(P<0.05);与模型组比较,实验组和DPA组AI显著降低,神经元数量增加(P<0.05);与实验组比较,DPA组AI显著升高,神经元数量显著降低(P<0.05)。见表3。
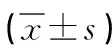
表3 四组大鼠脊髓组织细胞凋亡情况及正常神经元计数
2.3 四组大鼠PGC-1α和SIRT3 mRNA及蛋白质的表达 与sham组比较,模型组和DAP组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著降低(P<0.05);实验组PGC-1α和SIRT3 mRNA表达量显著升高,PGC-1α蛋白质的表达量显著降低(P<0.05),SIRT3蛋白质的表达量差异不显著(P>0.05)。与模型组比较,实验组和DPA组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著增加(P<0.05);与实验组比较,DPA组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著降低(P<0.05)。见表4。
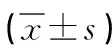
表4 四组大鼠PGC-1α和SIRT3 mRNA及蛋白质的表达比较
3 讨论
SCIRI主要是在大血管术后发生,因其导致的截瘫是此类手术后严重的并发症之一,可发展成永久性截瘫,严重时还可能导致手术患者死亡,然而目前仍无确切有效的防治措施[8]。尽管目前化学因子等辅助治疗以及缺血性预处理措施的使用可在很大程度上减少SCIRI的发生,但术后仍然有一定的概率出现SCIRI,导致患者生命安全受到严重威胁。因此,进一步探索SCIRI发病机制、开发有效治疗方式和特殊治疗药物具有十分重要的意义。早期的研究认为,当SCIRI发生时,缺血区域的神经元表现为神经元坏死病理症状,而周围的神经元表现为迟发性神经元死亡。但当前研究证实,SCIRI引起的神经元坏死的主要原因是细胞凋亡。临床研究发现[9],DEX除具有麻醉效果好、诱导苏醒迅速和血流动力学稳定等特点外,DEX预处理还能对包括心脏、肺脏、大脑等许多器官损伤产生保护作用。也有研究表示DEX可通过激活JAK2/STAT3信号通路,抑制凋亡蛋白和炎症因子表达,减少神经细胞凋亡对SCIRI产生保护作用[10],但是此类研究仍罕见。
在本研究中,笔者通过建立SCIRI大鼠模型观察了大鼠体内PGC-1α、SIRT3的表达变化,实验结果显示,与sham组比较,模型组和DPA组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著降低;实验组PGC-1α和SIRT3 mRNA表达量显著升高,PGC-1α蛋白质的表达量显著降低。与模型组比较,实验组和DPA组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著增加;与实验组比较,DPA组PGC-1α和SIRT3 mRNA及蛋白质的表达量显著降低。表明当DPA组加入 PGC-1α 抑制剂后,DEX对大鼠的SCIRI损伤不再起到保护作用,且 PGC-1α和SIRT3的 mRNA及蛋白表达均不再出现显著升高。此外与sham组相比,其余三组再灌注各时点BBB评分均显著降低,且sham组>实验组>DPA组>模型组;其余三组AI显著升高,神经元数量显著降低,其中模型组AI最高,神经元数最少;与模型组比较,实验组和DPA组AI显著降低,神经元数量增加;与实验组比较,DPA组AI显著升高,神经元数量显著降低。表明随着PGC-1α和SIRT3的 mRNA及蛋白表达的降低,大鼠的运动神经功能受损越严重,脊髓组织的受损情况越严重,提示脊髓缺血再灌注损伤的发生与PGC-1α/SIRT3通路存在联系,而DEX预处理能够激活PGC-1α/SIRT3信号通路,达到抑制脊髓神经细胞凋亡,改善脊髓组织的受损情况的作用。
脊髓损伤的基础研究表明[11-12],SCIRI作为原发性脊髓损伤的继发性伤害,其发生与缺血缺氧、细胞凋亡、细胞自噬、水通道蛋白异常表达、氧化应激、炎症反应、能量代谢紊乱等有关,在诱发内质网应激(ERS)后致使细胞凋亡,造成患者出现以运动、感觉功能障碍以及急性或迟发性神经功能缺失为主的临床症状。SCIRI可诱导内质网中未折叠蛋白反应的发生,激活ERS,但持续ERS将诱导细胞凋亡出现,最终加重SCIRI[13]。ERS激活造成线粒体损伤,进而激活Caspase-3,诱导神经细胞的凋亡[14]。PGC-1α是最早被鉴定出的过氧化物酶体增殖物激活受体γ的转录辅助激活因子,主要在含有丰富线粒体的神经系统、心肌组织、骨骼肌组织等组织表达,在多种与能量代谢有关的基因及转录因子具有调控作用[15]。SIRT3是NAD+依赖的组蛋白去乙酰化酶,主要存在于线粒体内,在线粒体呼吸、能量产生、脂肪酸β氧化和抗氧化等方面发挥重要作用,可以通过调节能量代谢及线粒体功能等阻止脑衰老和神经变性[16]。冯刚、张松松等人的实验证实[17-18],SIRT3是PGC-1α的靶基因,PGC-1α可诱导SIRT3表达,并增加SIRT3的去乙酰化酶活性,从而调控氧化应激反应在内的线粒体活动,在线粒体生成过程中发挥重要作用。进一步证实了笔者的猜想,即SCIR大鼠在DEX预处理后PGC-1α诱导SIRT3表达增加,在此通路的调控下,在减轻ERS的同时,线粒体损伤减轻,不再激活Caspase-3诱导神经细胞凋亡。
综上所述,DEX预处理大鼠SCIRI能够有效激活PGC-1α/SIRT3信号通路,抑制脊髓神经细胞凋亡,促进神经运动功能恢复,改善大鼠脊髓组织的受损情况。
