半刺厚唇鱼源维氏气单胞菌的分离鉴定
2023-07-27张晶晶
张晶晶
(福建省淡水水产研究所,福州 350002)
0 引言
维氏气单胞菌(Aeromonas veronii)是隶属于气单胞菌科,气单胞菌属的革兰氏阴性致病菌。其最适生长温度为28~37℃[1],夏、秋两季在水体环境中繁殖最快。作为一种条件致病菌,维氏气单胞菌广泛存在于自然界水体、土壤和水生动物体中,并且在人、兽和水生动物中都有相关的感染报道[2]。维氏气单胞引起的水生动物疾病在全国范围可见广泛报道,感染鱼体常出现体表溃烂出血、剖检可见内脏器受损出血,且伴随肠炎、腹水等症状,严重时鱼体可发生较高的死亡率[3]。目前感染的水产养殖动物有克氏原螫虾[4]、西伯利亚鲟[5]、罗非鱼[6]、锦鲤[7]、虹鳟[8]、大黄鱼[9]、草鱼[10-11]、鳗鲡[12]等。
半刺厚唇鱼(Acrossocheilus hemispinus),俗称“石板鱼”、“坑鱼”,隶属于鲤科(Cyprindae)、鲃亚科(Barbinae)、光唇鱼属(Acrossocheilus),主要分布于福建省的闽江、九龙江、交溪、霍童溪等江河水系和湖南省的湘江、资水、沅水、澧水[13]。半刺厚唇鱼肉质嫩滑、味道鲜美,在闽浙一带深受当地居民喜爱。由于传统栖息环境的破坏、非法捕捞和滥捕、各种污染源破坏等,野生种质资源量锐减,为了保护其野生种质资源,福建省将半刺厚唇鱼纳入《福建省水产种质资源保护区规划》保护经济物种,并建立了浦城县南浦溪和顺昌县麻溪2个半刺厚唇鱼国家级水产种质资源保护区。近年来相关科研院所在半刺厚唇鱼人工繁育、苗种培育、饲料营养、病害防治等技术研究方面取得了一定的突破[14-15],但是由于半刺厚唇鱼养殖处于刚发展阶段,有关养殖过程中的病害研究相对较少,目前仅有小瓜虫寄生虫[16]、寄生性嗜酸性卵甲藻[17]和扁弯口吸虫[18]感染的报道,未见细菌性感染报道。
2021 年8 月顺昌县兆兴鱼种养殖有限公司养殖半刺厚唇鱼陆续发生少量死亡,死亡鱼体皮肤溃烂形成溃疡灶、尾鳍充血,眼部发红浑浊,剖检可见肝肾、脾脏肿大与出血;养殖池发病鱼体出现游动缓慢、体色偏黑、食欲不振等症状。本研究开展病鱼的细菌分离纯化和鉴定与致病性研究,明确了发病病原为维氏气单胞菌温和生物型,同时开展了分离菌株的药物敏感性试验,为养殖生产中疾病的防控提供研究基础。
1 材料与方法
1.1 试验材料
具有典型症状的发病半刺厚唇鱼(体质量85~120 g)和回归感染用健康半刺厚唇鱼(体质量35~40 g),均由顺昌县兆兴鱼种养殖有限公司提供。营养琼脂(NA)、羊血琼脂平板、甲基红、纤维二糖、D-甘露醇、七叶苷、水杨苷、赖氨酸脱羧酶、精氨酸双水解酶、鸟氨酸脱羧酶购自广州环凯生物科技有限公司。药敏纸片购自杭州微生物试剂有限公司。DNA 2×Premix Taq 聚合酶购自大连宝生物工程有限公司,DNA Marker购自北京擎科生物科技有限公司。引物合成与测序送至上海生工生物工程技术股份有限公司完成。
1.2 致病菌的分离与纯化
取发病症状典型的患病半刺厚唇鱼,在无菌超净台用灭菌镊子挑取少量肝、脾、肾组织,营养琼脂平板划线,28℃恒温培养。24 h后挑取平板上优势菌落,重复划线纯化3 次。纯化菌株于营养琼脂斜面5℃冰箱和25%甘油的LB液体-80℃低温冰箱保存。
1.3 回归感染实验
健康半刺厚唇鱼于100 L连续爆气的玻璃缸暂养2 周,温度控制26~28℃。纯化的菌株过夜培养后,用0.9%无菌生理盐水清洗,10倍稀释制成不同浓度菌悬液。回归感染设置6组,每组7尾健康半刺厚唇鱼,背部肌肉注射不同浓度细菌悬液0.1 mL,对照组注射0.1 mL 0.9%无菌生理盐水。同时,平板菌落计数法测定细菌悬液浓度。试验期间不投饵,每天换水1次,每次换水40%,水温控制26~28℃。每天记录各组发病情况,对濒临死亡、症状明显的患病鱼体再次分离和纯化细菌。
1.4 菌株鉴定
1.4.1 形态特征观察纯化的菌株于28℃恒温箱培养24 h后,挑取单菌落革兰氏染色,在光学显微镜下观察菌体染色以及形态特征。
1.4.2 生理生化特性测定使用梅里埃公司的VITEK2全自动细菌鉴定系统对分离纯化的菌株进行分析,对照伯杰氏细菌鉴定手册[1]和《常见细菌系统鉴定手册》[19],补充甲基红、纤维二糖、D-甘露醇、水杨苷、七叶苷、鸟氨酸脱羧酶、精氨酸双水解酶、赖氨酸脱羧酶、羊血琼脂溶血实验。
1.4.3 16S rDNA与gyrB基因分子鉴定用接菌环挑取纯化菌株单菌落于无菌离心管中,加入500µL无菌双蒸水,涡旋30 s,置95℃水浴5 min,12000 r/min 离心2 min,取上清液为DNA 模板。16S rDNA 通用引物上、下游引物序列分别为 AGAGTTT GATCCTGGCTCAG 和 TACGGCTAC CTTGTTAC GACTT[20];gyrB 上、下游引物序列分别为TCCGGCGGTCTGCACGGCGT 和TTGTCC GGGT TGTACTCGTC[21-22]。PCR 反应体系50 µL:2×Premix Taq 25 µL,DNA 模板4 µL,上下游引物各1 µL(10µmol/L),ddH2O 19µL。16S rDNA 序列的PCR 反应条件:94℃预变性3 min,94℃变性30 s,55℃复性30 s,72℃延伸90 s,34个循环,72℃延伸10 min。gyrB基因PCR反应条件:95℃预变性3 min,95℃变性30 s,66℃复性30 s,72℃延伸60 s,34 个循环,72℃延伸5 min。PCR 产物送至上海生工生物工程技术股份有限公司测序,测序结果在BLSAT(Basic Local Alignment Search Tool)网站进行线上序列同源性比对,采用MEGA11.0.10 软件邻接法(Neighbor joining,NJ)构建进化树,设定Bootstrap为1000。
1.5 毒力基因扩增
合成细胞毒性肠毒素(ast、act、alt)、气溶素(aerA)、溶血素(hlyA)、IV 型菌毛基因(tapA)引物[23-25](表1)。PCR反应体系25µL,其中2×Premix Taq 12.5µL,DNA模板2µL,上下游引物各0.5µL,ddH2O 9.5µL。PCR反应如下:94℃预变性2 min,94℃变性30 s,act退火温度55℃,延伸20 s,ast退火温度55℃,延伸25 s,alt退火温度55℃,延伸30 s,aerA退火温度68℃,延伸时间30 s,hlyA退火温度62℃,延伸时间40 s,tapA退火温度55℃,延伸时间40 s,35 个循环,72℃延伸10 min。产物经1%琼脂糖凝胶电泳检测后测序分析。
1.6 药物敏感性实验
纯化菌株过夜培养后,挑取单菌落于无菌生理盐水制成菌悬液,采用麦氏比浊法将菌液浓度稀释0.5麦氏浊度(1.0×108CFU/mL),取100µL 稀释菌悬液均匀涂布营养琼脂平板上,待平板表面干后,将药敏纸片粘贴于平板表面,每种药物3个平行,28℃恒温培养24 h,测量平板上的抑菌圈并计算平均值,根据产品说明书判断该细菌的药物敏感性。
2 结果与分析
2.1 分离菌株形态特征
从症状典型濒死亡鱼体肝脏分离纯化得到单一优势菌株,将其命名为AS0829L1。菌株过夜培养后出现圆形凸起,表面光滑湿润的灰黄色菌落,菌体直径约为2~4 mm(图1)。细菌革兰氏染色结果阴性,两端钝圆,短杆状(图2)。

图1 AS0829L1培养菌落形态

图2 AS0829L1菌株革兰氏染色阴性(100×)
2.2 回归感染实验
对健康半刺厚唇鱼实验鱼背部注射菌液,注射浓度分别为5×1010、5×109、5×108、5×107、5×106CFU/mL。回归感染后第1 天,5×1010CFU/mL 浓度组全部死亡,5×109CFU/mL浓度组死亡率71.4%,第2天全部死亡;5×108CFU/mL浓度组第3天出现死亡,至14 d死亡率为28.6%,其他浓度组以及对照组无死亡情况(表2)。实验组活动异常,部分鱼呈现体表发红、溃烂、鳞片脱落、烂尾等症状,剖检可见肝脏发黄发白、脾脏发黑肿大(图3)。

图3 人工感染后半刺厚唇鱼出现的症状
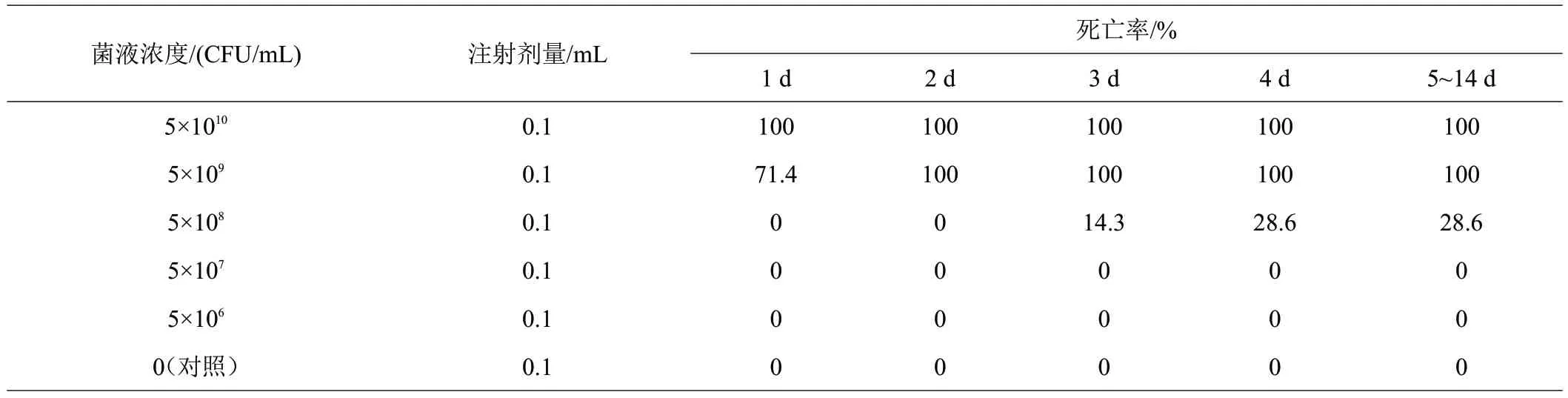
表2 分离菌株AS0829L1回归实验结果
2.3 分离菌株16S rDNA和gyrB基因序列的扩增与分析
16S rDNA通用引物和gyrB基因特异性引物PCR扩增结果分别获得大小为1452 bp(GenBank 号OP268346)和1080 bp(GenBank 号OP311617)的序列。通过NCBI 的Blast 程序进行同源性分析,结果显示菌株序列与维氏气单胞菌(A.veronii)同源性最高,分别达到99.93%(登录号MF716690.1)和99.34%(登录号KJ747137.1)。根据16SrDNA 与gyrB 基因序列采用NJ 法分别构建系统进化树,AS0829L1 菌株与维氏气单胞菌聚为一类,可确定分离菌为维氏气单胞菌(图4)。

图4 分离菌株16S rDNA序列(a)与gyrB基因序列(b)构建的系统进化树
2.4 生理生化鉴定
2.4.1 生理生化鉴定VITEK2全自动细菌鉴定系统鉴定菌株与气单胞菌属的温和气单胞菌的相应特征相符,置信度89%,α-半乳糖苷酶实验阳性,γ-谷氨酰转移酶阳性,与温和气单胞菌生理生化特征不符(表3)。补充生化检测结果,甲基红、纤维二糖、D-甘露醇为阳性,水杨苷、鸟氨酸脱羧酶为阴性,羊血-琼脂溶血实验呈β-溶血(图5),根据伯杰氏细菌分类手册[1]和《常见细菌系统鉴定手册》[26],综合生化反应结果该分离菌可鉴定为维氏气单胞菌。

图5 AS0829L1菌株溶血性β-溶血
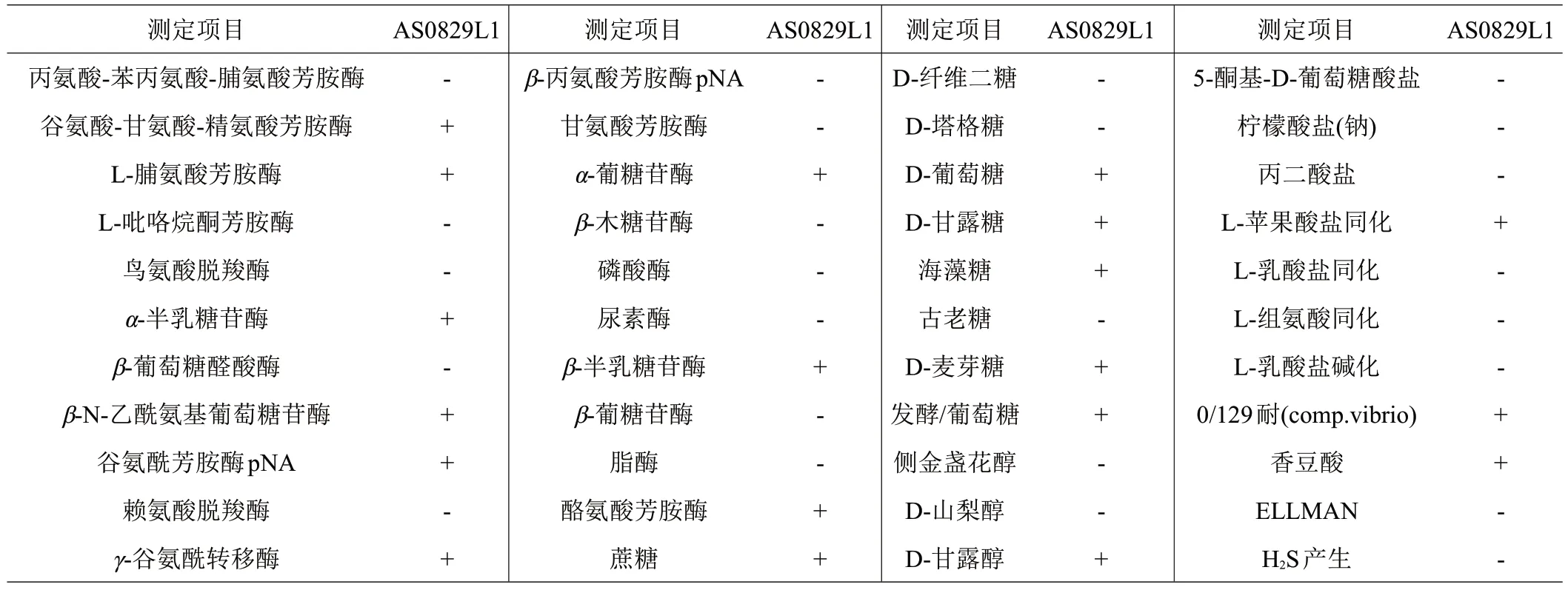
表3 分离菌株AS0829L1生理生化鉴定结果
2.4.2 菌株生物型鉴定维氏气单胞菌温和生物型具有act、aer A、alt、hly A、tap A基因,维氏气单胞菌维罗纳生物型具有ast、alt、act、hlyA、aer A基因[25,27](表1)。分离菌株毒力基因扩增得到act、aer A、alt、hly A、tap A(图6),因此,此检测结果与维氏气单胞菌温和生物型一致。精氨酸双水解酶、赖氨酸脱羧酶和七叶苷实验结果显示,精氨酸双水解为阳性,赖氨酸脱羧酶实验为阴性,七叶苷水解实验为阴性。维氏气单胞菌温和生物型精氨酸双水解为阴性,赖氨酸脱羧酶实验为阳性,七叶苷水解实验为阳性,维氏气单胞菌维罗纳生物型精氨酸双水解为阳性,赖氨酸脱羧酶实验为阴性,七叶苷水解实验为阴性[26],实验结果符合维氏气单胞菌温和生物型特征。
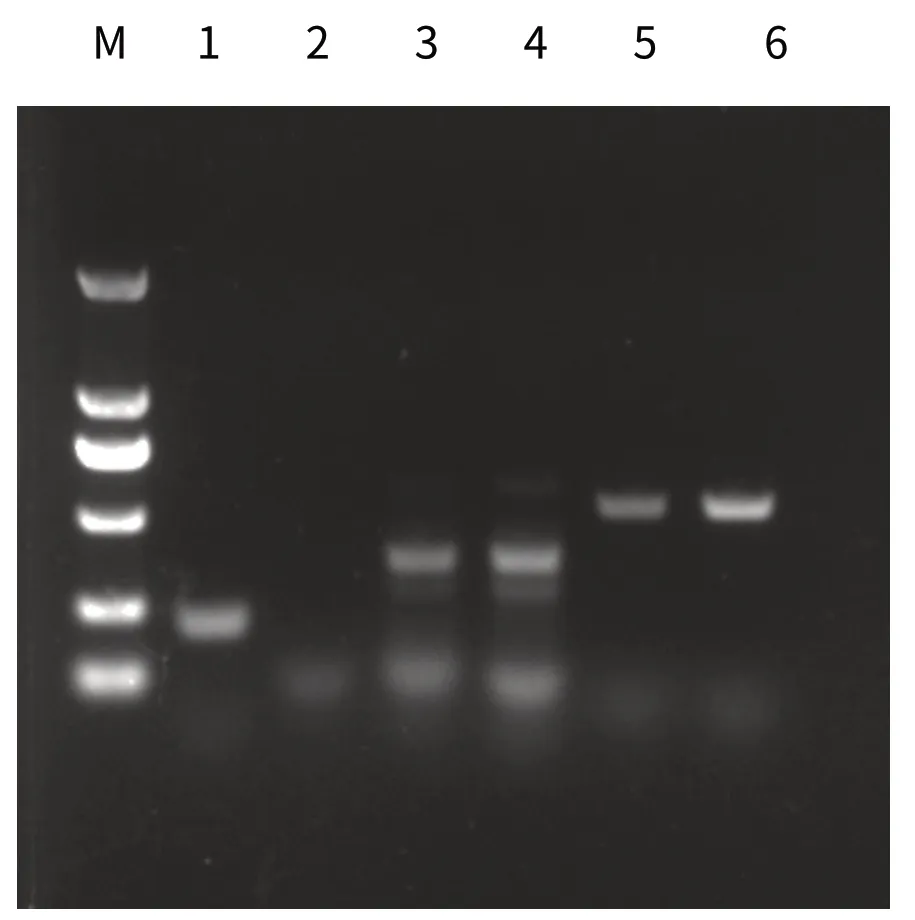
图6 毒力基因扩增结果电泳图
2.5 药物敏感性
由表4 可知,菌株AS0829L1 对所测试的37 种抗菌药物中的β-内酰胺类的头孢曲松、头孢派酮、头孢他啶、头孢呋辛、头孢唑啉、头孢铵苄、头孢拉定,氨基糖苷类卡那霉素、庆大霉素、新霉素、丁胺卡那,磺胺类复方新诺敏、甲氧苄啶,喹诺酮类环丙沙星、恩诺沙星、氧氟沙星;氯霉素类氯霉素,糖肽类多粘霉素B,青霉素类派拉西林钠,硝基呋喃类呋喃唑酮20种药物高度敏感;对β-内酰胺类羧苄西林,氨基酸苷类链霉素,氯霉素类氟苯尼考,福霉素类利福平,米诺环素类二甲胺四环素5种药物中度敏感;对β-内酰胺类的青霉素,喹诺酮类的诺氟沙星,大环内酯类的红霉素、罗红霉素、麦迪霉素,四环素类的四环素、多西环素,糖肽类的万古霉素,林可酰胺类的克林霉素、青霉素类阿莫西林、苯唑西林、硝基咪唑类抗生素甲硝唑12种药物耐药。

表4 分离菌株AS0829L1药敏试验结果
3 讨论
维氏气单胞菌是一种人、兽、鱼共患病原菌,与其他致病菌相比,维氏气单胞菌感染的鱼类物种范围更广,可引起虾类[4]、蟹类[28]、贝类[29]和鱼类等水产动物致病。感染维氏气单胞菌的鱼体症状各有差异,但主要以皮肤溃疡,脏器出血和严重腹水等症状为主。相关报道表明,维氏气单胞可引起鲤鱼和鲈鱼的红肿病,病鱼腹部出现红斑,肛门红肿等症状[30-31];罗非鱼、鲈鱼、鲫鱼、鲤鱼、和西伯利亚鲟鱼的出血性败血症,主要症状表现为体表及内脏的出血、充血等[32-33];青虾的“软壳综合征”,主要症状表现为软壳、掉肢、肌肉水肿等[34];黄颡鱼的“溃疡综合征”,主要症状表现为体表溃疡和溃烂等[35]。
16S rDNA序列分析是细菌种属鉴定的常用方法,但在区分种间亲缘关系较近的菌株准确性较差[36]。gyrB基因编码DNA促旋酶中B亚单位蛋白的基因,在细菌中普遍存在且不会发生频繁的水平转移,更适合亲缘关系较近的菌种鉴别[10]。温和气单胞菌和维氏气单胞菌理化特性比较接近,因此这2 种气单胞菌在鉴定时容易混淆[37-38],本研究同时选用16S rDNA和gyrB基因对病原菌进行分子鉴定和系统发育分析区分二者。在生理生化鉴定方面,东秀珠等[26]认为增加靛基质、V-P 试验、纤维二糖、甘油、蔗糖产酸,葡萄糖产气等项目将二者区分开。Brenner等[1]认为通过羊血平板溶血实验验证菌株溶血能力也可区分两者。
维氏气单胞菌有维氏气单胞菌维罗纳和维氏气单胞菌温和2 种生物型,其中维氏气单胞菌温和生物型致病性较强,危害较大[39]。国内水生生物感染维氏气单胞菌的报道多集中在维氏气单胞菌温和生物型,其可引起大口黑鲈肝脾肿大、肾脏出血、体表鳞片脱落及出血,腹腔注射攻毒3×107、1.5×108、3×108CFU/mL 可分别导致7%、40%、100%的死亡率[40];黄鳝全身出血,腹部肿胀,肛门红肿,解剖可见肠道出血,该菌对黄鳝的半致死浓度约为5.79×107CFU/mL[41];青虾掉肢、软壳、肝胰腺发黄和肌肉水肿,该菌对青虾的半数致死浓度为1.47×106CFU/mL 等[42]。本研究AS0829L1 菌株攻毒健康半刺厚唇鱼,出现体表发红溃烂、鳞片脱落、尾柄腐烂等症状,5×108CFU/mL菌液可导致健康鱼体28.6%死亡,与相关报道的维氏气单胞菌温和型相比,该菌株毒力较为温和,这与自然发病鱼体治疗前持续5 d保持日死亡量20~40条(全池约3000条),未出现爆发死亡的实际情况相符。
维氏气单胞菌的致病性与毒力基因的种类、数量存在一定的相关性。目前研究对维氏气单胞的致病机制了解较少且主要针对单一毒力因子的研究,如气溶素、溶血素、肠毒素、外膜蛋白、菌毛、鞭毛、蛋白酶、黏附因子等[3]。本研究检测到了5种毒力基因,其中aerA是一种能引起β型溶血能改变细胞膜的通透性的穿孔毒素,导致宿主内脏器官与体表出血[43-44];细胞毒性肠毒素(Act)能够引起溶血、细胞毒性和肠毒性;不耐热细胞肠毒素(Alt)能够增加肠上皮细胞cAMP和前列腺素的水平,刺激宿主促炎反应,引发细胞凋亡[45]。溶血素hlyA可导致宿主细胞的渗透性裂解和完全溶血,在维氏气单胞菌的致病过程中起到关键的作用[46]。tapA参与维氏气单胞Tap IV 型菌毛形成,Tap 菌毛的生物合成对维氏气单胞的毒力产生机制有待进一步研究[3]。
细菌的药物敏感性与分离菌株的地域、季节、寄生宿主有很大的关联性。本研究的药敏实验共分析了37 种药物,其中耐药药物12 种,包括青霉素、诺氟沙星、红霉素、罗红霉素、麦迪霉素、四环素、多西环素、万古霉素、克林霉素、阿莫西林、苯唑西林、甲硝唑。耿昕颖等[47]从东北区域分离的52 株的维氏气单胞菌菌株对庆大霉素、阿莫西林、红霉素全部耐药,对阿米卡星、磺胺间甲氧嘧啶和阿奇霉素的耐药率也较高。周光等[48]从团头鲂养殖池分离鉴定了56株维氏气单胞,药敏实验结果表明分离菌株对氨苄西林耐药,对诺氟沙星、复方新诺明、洛美沙星的耐药性也较高。Sáncheza等[49]从虹鳟鱼分离的11 株维氏气单胞菌进行耐药性检测发现所有分离的菌株对头孢拉素类药物呈现耐药性。所以从不同地域、不同鱼体分离的菌株对抗生素均存在不同程度的抗性,而且耐药水平存在一定差异。因此在细菌性疾病防治之前,应对病原进行药物敏感试验,确定敏感药物,做到精准、科学、有效用药。
4 结论
本研究对人工养殖出现皮肤溃烂、尾鳍出血、肝脏肿大的半刺厚唇鱼进行了细菌的分离鉴定以及药物敏感性实验。从症状典型的病鱼肝组织分离纯化到菌株AS0829L1,并由人工回归感染证实为致病菌。分离菌株理生化特性鉴定,16S rDNA、gyrB 基因序列分析以及毒力基因检测结果表明AS0829L1菌株为维氏气单胞菌温和生物型。药物敏感性实验证明该菌株对头孢曲松、头孢派酮、庆大霉素、新霉素、恩诺沙星、氧氟沙星等20种药物高度敏感,对羧苄西林、链霉素、氟苯尼考等5 种药物中度敏感,对青霉素、诺氟沙星、红霉素等12种药物不敏感。
