维氏气单胞菌的smpB、tmRNA及hfq敲除菌株减毒活疫苗筛选
2019-05-07徐一轲孙愉宸盛强龙李宏马香唐燕琼刘柱
徐一轲,孙愉宸,盛强龙,李宏,马香,唐燕琼,刘柱
维氏气单胞菌的及敲除菌株减毒活疫苗筛选
徐一轲,孙愉宸,盛强龙,李宏,马香,唐燕琼*,刘柱
海南大学热带农林学院, 海南 海口 570228
为筛选维氏气单胞菌减毒活疫苗,为水产重要细菌性病害的防控提供新策略,本文通过荧光实时定量PCR检测三种敲除型菌株、及中毒力相关基因表达;并采取腹腔注射法对尼罗罗非鱼进行野生型及三种敲除型感染,观察染病罗非鱼症状,计算累计死亡率及LD50。结果表明,维氏气单胞菌野生型与三种敲除型菌株相比,细菌毒力相关蛋白表达均呈现显著差异,部分毒力相关基因显著下调;三种敲除型菌株LD50分别增加1.24、5.32和19倍。由此可见,三种敲除型维氏气单胞菌可作为候选减毒疫苗,下调显著的菌株是制备减毒疫苗的首选。
维氏气单胞菌; 基因敲除; 毒力测定; 减毒疫苗
维氏气单胞菌()隶属气单胞菌科,气单胞菌属,为革兰氏阴性短杆菌[1],其普遍存在于淡水、污水、土壤乃至海水中[2]。维氏气单胞菌是一种重要的人、兽及水生生物共患病原菌,可引起罗非鱼等多种鱼类发病,导致器官衰竭乃至死亡,对水产养殖业造成巨大的损失;还可引起人脑膜炎、败血症等[3]。近年的研究表明,污染的家畜肉类、水产品、蔬菜等均为维氏气单胞菌的重要传染源,因此一些国家已经将其作为水体质量和食品安全的检疫对象[4,5]。目前对维氏气单胞菌尚缺乏有效的防治办法,主要依赖抗菌药物等,导致耐药性病原菌的形成、药物残留、环境污染等诸多弊端,而疫苗则是解决此类问题的有效途径之一。常用的疫苗种类包括减毒活疫苗、灭活疫苗、亚单位疫苗等,其中减毒活疫苗具有保护力强、保护时间长、成本低廉、易于生产等优点,因此选择使用基因工程的方法构建维氏气单胞菌减毒活疫苗。
反式翻译系统是细菌中普遍存在的核糖体拯救机制,其核心分子为转移-信使RNA(Transfer-messenger RNA,)和Small protein B(),前者为包含tRNA样结构域(TLD)以及编码8-35个氨基酸短肽的信使样结构域(MLD)的小分子RNA[6],后者是一种特异性亲和的小RNA结合蛋白。反式翻译系统一方面可以释放滞留的核糖体,以保证细胞的正常生理活性,另一方面可以在未完成正常翻译的肽段后端添加标记肽,使其被水解酶识别并降解[7]。由于反式翻译系统对细菌的生存具有重要意义,因此选择了及作为构建减毒活疫苗的候选基因。
(Host Factor for RNA Phage Qβ)是细菌中普遍存在的RNA伴侣蛋白[8]。是一个全局性调控因子,在细菌的转录后水平发挥着巨大的作用。有研究表明对细菌的生长、运动能力、基因的整体表达、生物膜的形成及毒力均有重要影响[9]。多种革兰氏阴性致病菌,如流产布鲁杆菌()、沙门氏菌(spp)和霍乱弧菌(),其缺失突变株感染小鼠时表现毒力减弱[10-14]。
为了筛选用于制备维氏气单胞菌减毒活疫苗的潜在菌株,以本实验室先前制备的维氏气单胞菌、及敲除株为研究对象,通过实时定量PCR检测其毒力相关基因的表达变化,并通过腹腔注射尼罗罗非鱼,测定其半致死浓度(LD50),评价其免疫效果。本研究的结果为进一步开发研制高效、安全的维氏气单胞菌减毒活疫苗奠定了理论基础,对于严重危害水产的细菌性病害的防治具有重要的理论和实践意义。
1 材料与方法
1.1 实验材料
尼罗罗非鱼鱼苗及饲料购自海南宝路水产科技有限公司,维氏气单胞菌菌株(C4)野生型、敲除型、敲除型以及敲除型由本课题组自行分离、制备并保存。
1.2 敲除型菌株验证
解冻维氏气单胞菌C4野生型、敲除型、敲除型以及敲除型后,直接接种于添加了氨苄青霉素的LB培养基平板中,30 ℃过夜活化。长出菌落后分别随机挑取单菌落进行菌落PCR验证菌株,使用的引物为本课题组自行设计的维氏气单胞菌特异性引物以及、和的敲除型验证引物(表1)。

表 1 各敲除型验证引物及维氏气单胞菌特异性引物
1.3 荧光实时定量PCR

表 2 荧光实时定量PCR检测的基因及其引物
选取维氏气单胞菌中18个毒力相关基因,设计相应的实时定量PCR引物(表2)。提取维菌野生型及各敲除型的总RNA,采用TaKaR公司生产的反试剂盒进行反转录,得到模板cDNA,利用TaKaRa公司生产的TB Green染料,通过嵌合荧光法进行检测。使用仪器为罗氏(Roche)公司的LightCycler®96qPCR仪。使用“相对表达量=2-ΔΔCq”公式计算得到各基因的表达变化,并且使用GraphPad prism7.0进行作图以及校验。
1.4 尼罗罗非鱼注射感染维氏气单胞菌
采用腹腔注射方式对尼罗罗非鱼()鱼苗进行维氏气单胞菌感染。首先,将各菌种活化后以0.02 OD/mL接种于添加了氨苄青霉素的液体LB培养基中,30 ℃培养20 h达到稳定期后,收集菌体并用生理盐水配制成浓度分别为109cfu/mL、108cfu/mL、107cfu/mL的菌悬液。然后,以体重为1 g的罗非鱼鱼苗为实验对象,向每条鱼体内各注射10 μL的菌悬液,并置于容积60 L的玻璃缸中养殖,水温控制在26~28 ℃,每天投喂鱼苗专用粉剂饲料2次,每隔2 d换水1次。感染后首日每隔1 h观察一次罗非鱼发病或死亡情况,之后每隔1日观察记录1次,并及时捞出死鱼。持续观察1周。
1.5 半致死浓度(LD50)的测定
罗非鱼鱼苗被感染后,观察1周记录累积死亡率,并且利用改良寇氏法计算维氏气单胞菌野生型及各敲除型的半致死浓度(LD50)[15]。比较LD50以验证各菌株毒力的变化。
2 结果与分析
2.1 野生型及敲除型菌株验证

使用维氏气单胞菌特异性引物以及各敲除型验证引物验证菌株。图1A为维氏气单胞菌敲除型验证,1~6泳道为野生型,7~12泳道为敲除型,从条带可以看出敲除型比野生型减少了约400 bp,证明敲除成功。图1B为维氏气单胞菌敲除型验证,1~6泳道为野生型,7~12泳道为敲除型,结果显示敲除型比野生型减短了约500 bp,证明敲除成功。图1C则为对图1A、B中24个菌株的维氏气单胞菌特异性引物验证结果,结果显示24株菌均为维氏气单胞菌。图1D为对维氏气单胞菌敲除型验证,1、2泳道为野生型,3、4泳道为敲除型,可以看出敲除型较野生型减短了约500 bp,证明敲除成功,5~8泳道则为维氏气单胞菌特异性引物验证,证明得到1~4泳道的4株菌均为维氏气单胞菌。
2.2 荧光实时定量PCR检测毒力相关基因表达
实时定量PCR结果表明,与维氏气单胞菌野生型相比较,敲除型菌株中,气溶素(Aerolysin)与III型分泌系统相关蛋白表达极显著地上调,而弹性蛋白酶(Elastase)表达极显著地下调(图2);在敲除型菌株中仅检测到上调的毒力及相关基因,包括气溶素(Aerolysin)、外膜蛋白、外膜蛋白组装因子、RNA结合蛋白、应激保护蛋白、应激蛋白(图3);而在敲除型菌株中同时检测到上调和下调的毒力基因,其中,气溶素(Aerolysin)、III型分泌系统相关蛋白及,多重耐药性调控蛋白均极显著上调,而脂肪酶、外膜蛋白、应激蛋白等基因的表达量明显下调(图4)。
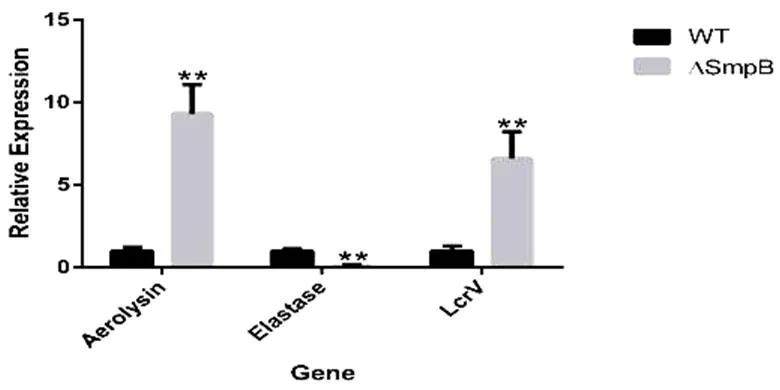
图 2 维氏气单胞菌smpB敲除型中差异变化极显著的基因实时定量PCR结果
*:=0.05;**:=0.01 (下同)
Fig.2 The Quantitative Real-time PCR results fromΔ
*:=0.05;**:=0.01 (The same as follows)

图 3 维氏气单胞菌tmRNA敲除型中差异变化显著的基因实时定量PCR结果

图 4 维氏气单胞菌hfq敲除型中差异变化显著的基因实时定量PCR结果
2.3 菌株半数致死量(LD50)测定
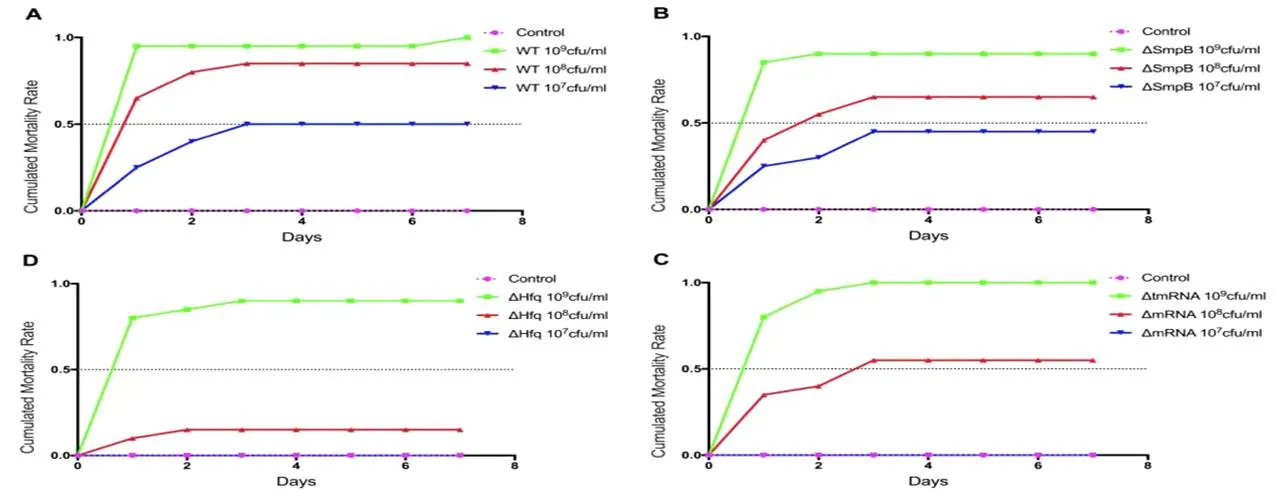
图 5 各菌株腹腔注射罗非鱼后的累计死亡率
经过改良寇氏法计算得到,维氏气单胞菌野生型的半致死浓度为1.41×107cfu/mL(图5A);维氏气单胞菌敲除型的半致死浓度为3.16×107cfu/mL(图5B),与野生型相比毒力下降了2.24倍;维氏气单胞菌敲除型的半致死浓度为8.91×108cfu/mL(图5C),与野生型相比毒力下降了6.32倍;维氏气单胞菌敲除型菌株的半致死浓度为2.82×108cfu/mL(图5D),与野生型相比毒力下降了20倍。
3 讨论
目前,国内最近几年由维氏气单胞菌感染引起水产养殖病害的报道逐年增多,对水产养殖业造成巨大经济损失;同时在公共健康领域关于维氏气单胞菌的报道也逐年增多,尤其以腹泻和肺炎等病例为甚。根据中国知网数据库(CNKI)的数据,2001年至2015年间国内分离并报道的维氏气单胞菌病例呈现逐年上升趋势,如2011年广东省某鲶鱼养殖场爆发的溃疡综合征、2014年8月四川雅安某水库加州鲈鱼的大面积死亡等,经过分离鉴定其优势菌株均为维氏气单胞菌[16]。因此无论是从水产养殖业发展,还是公共卫生安全角度出发,维氏气单胞菌的防治都应该被重视。本实验探索通过基因敲除技术构建维氏气单胞菌的减毒株,并且取得了一定的成效,为以后维氏气单胞菌疫苗的研发提供了理论依据和研究基础。
减毒活疫苗可以引发机体免疫反应,刺激特异性的记忆B细胞和T细胞的产生,使机体获得长期或终生保护作用。与灭活疫苗相比,减毒活疫苗具有免疫力强、作用时间长的优点。减毒活疫苗发展初期主要由物理和化学方法制备而成[17]。而随着近年来分子生物学技术的发展,基因工程已经成为更加精准和便捷的减毒活疫苗制备方法。本实验旨在通过敲除反式翻译拯救系统的核心元件和,以及起到广泛调控作用的RNA结合蛋白,筛选可用于研发有效减毒疫苗的潜在菌株。一方面通过实时定量qPCR验证相应基因敲除后,包括气溶素(Aerolysin)、耐热溶血素(Thermostable hemolysin)、脂肪酶(Lipase)、弹性蛋白酶(Elastase,),以及外膜蛋白、应激蛋白、III型分泌系统相关蛋白、多重耐药性调控蛋白等毒力相关基因的表达情况;另一方面通过注射感染罗非鱼,测定LD50的变化情况。本研究结果表明,气溶素(Aerolysin)的表达在各敲除型菌种均明显上调,但是注射结果却均显示LD50呈现不同程度的下降。在维氏气单胞菌敲除型中,仅检测到3个毒力基因的表达发生了显著性变化,相应地其毒力也仅下降2.24倍;而敲除型中,具有显著差异的基因表达量均为上调,但是注射罗非鱼后的LD50却下降6.32倍,这些结果表明反式翻译系统核心元件和可能对于维氏气单胞菌的毒力影响不大。敲除型中,较多毒力相关基因的表达量均发生变化,并且LD50下降了20倍,表明可以对维氏气单胞菌的毒力产生显著影响。本研究所检测毒力相关基因表达量变化趋势与相应菌株LD50的变化趋势看上去不一致,这可能是由于本研究检测的毒力相关基因有限所导致的。这样的结果暗示,细菌的毒力受到十分复杂的因素影响,可能包括我们所检测的毒力相关基因以外的其他更复杂的生物途径,仅通过检测有限基因的表达量变化可能并不能真实反映细菌毒力水平。基于本研究的结果,敲除型表现减毒效果最佳,证明了其具有进一步研发作为减毒活疫苗的潜力。
[1] 简灯.维氏气单胞菌分离鉴定及其灭活疫苗效应的研究[D].重庆:西南大学,2015:1
[2] 吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44
[3] 曾范利,赵丹,康元环,等.不同动物源性维氏气单胞菌气溶素基因的克隆及比较分析[J].中国兽药杂志,2014,48(8):6-10
[4] Roberts M, Enoch D, Harris K,.biovar sobria bacteraemia with septic arthritis confirmed by 16SrDNA PCR in an immunocompetent adult[J]. J Med Microbiol, 2006,55(2):241-243
[5] Mencacci A, Cenci E, Mazzolla R,.biovar veronii septicaemia and acute suppurative cholangitis in a patient with hepatitis B[J]. J Med Microbiol, 2003,52(8):727-730
[6] Huter P, Müller C, Arenz S,. Structural basis for ribosome rescue in bacteria[J]. Trends Biochem Sci., 2017,42(8):669-680
[7] Hayes CS, Keiler KC. Beyond ribosome rescue: tmRNA and co-translational processes[J]. FEBS Lett, 2010,584(2):413-419
[8] Vogel J, Luisi BF. Hfq and its constellation of RNA[J]. Nat.Rev.Microbiol., 2011,9(8):578–589
[9] 徐巧林,宋艳钊,郭岩彬.细菌非编码RNA及其分子伴侣[J].微生物学报,2018,58(9):1511-1520
[10] Robertson GT, Roop RM. The Brucella abortus host factor I (HF-I) protein contributes to stress resistance during stationary phase and is a major determinant of virulence in mice[J]. Mol Microbiol, 1999,34(4):690-700
[11] Sittka A, Pfeiffer V, Tedin K,. The RNA chaperoneis essential for the virulence of[J]. Mol Microbiol, 2007,63(1):193-217
[12] Ding Y, Davis BM, Waldor MK.is essential forvirulence and downregulates sigma expression[J]. Mol Microbiol, 2004,53(1):345-354
[13] Ansong C, Yoon H, Porwollik S,. Global systems-level analysis ofanddeletion mutants in: implications for virulence and global protein translation[J]. PLoS ONE, 2009,4(3):e4809
[14] Karasova D, Sebkova A, Vrbas V,. Comparative analysis ofserovar Enteritidis mutants with a vaccine potential[J]. Vaccine, 2009,27(38):5265-5270
[15] 顾兵,张政,李玉萍,等.半数致死量及其计算方法概述[J].中国职业医学,2009,36(6):507-509
[16] 康元环,张冬星,杨滨僮,等.维氏气单胞菌最新研究进展[J].中国人兽共患病学报,2018,34(5):452-410
[17] 李征.减毒活疫苗的应用及其研究进展[J].中国生物制品学杂志,2018,31(2):205-209
Screening out Live Attenuated Vaccine fromStrain withoutor
XU Yi-ke, SUN Yu-chen, SHENG Qiang-long, LI Hong, MA Xiang, TANG Yan-qiong*, LIU Zhu
570228,
In order to screen out live attenuated vaccines fromso as to provide a new strategy for controlling against bacterial diseases of aquatic products, toxic gene expressions ofstrainsdeletedorwere detected by Quantitative Real-time PCR. The symptom, accumulative death rate and LD50 of the wildandsome infected with deleted strains by Intraperitoneal injection were recorded or calculated. The resulted showed there were significant differences among bacterial toxicity relative protein expressions of three deleted strains and wildsome of them obviously went down, LD50 of three strains added up to 1.24, 5.32 and 19 times, respectively. Therefore the deletedstrains could be developed for candidates of attenuated vaccines,strain was a first choice.
; gene deletion; toxicity detection; attenuated vaccine
S943
A
1000-2324(2019)02-0186-05
10.3969/j.issn.1000-2324.2019.02.002
2018-05-12
2018-08-20
国家自然科学基金项目(31560021;31772887;31860676);海南省自然科学基金(317015);海南省重点研发计划(ZDYF2017020)
徐一轲(1992-),男,硕士研究生,研究方向:农业生物技术. E-mail:xuyike1992@foxmail.com
Author for correspondence. E-mail:tyq68@126.com
