中枢神经系统液体循环研究进展
2023-07-27高胜青周梦良
汪 雪,高胜青,周梦良
1.南京大学医学院,南京 210093; 2.南京大学医学院附属金陵医院神经外科,南京 210002
中枢神经系统的液体循环从脉络丛产生脑脊液(cerebrospinal fluid,CSF)开始,经各脑室进入蛛网膜下腔(subarachnoid space,SAS),在SAS通过类淋巴系统与脑间质液进行物质交换,最后通过硬脑膜淋巴管、蛛网膜颗粒等途径回到外周循环,形成了一个从外周循环中来、经过物质交换后又汇入外周循环的过程。由于构成血脑屏障(blood-brain barrier,BBB)的血管内皮细胞之间具有紧密连接,同时脑内缺乏实质性淋巴系统,此两者可导致颅内液体交换不足,而类淋巴系统弥补了这一不足,为大脑承担高级神经功能提供了物质基础。在创伤性脑损伤(traumatic brain injury,TBI)发生后,保证中枢系统的液体循环途径正常进行的结构被破坏,脑脊液的流动模式改变,类淋巴系统的功能在TBI后被长期抑制,而毒性蛋白如β-淀粉样蛋白(β-amyloid,Aβ)、Tau蛋白等在脑组织中大量沉积[1],从而导致创伤后远期的认知功能损伤,增加了创伤后阿尔茨海默病(Alzheimer’s Disease,AD)的发病风险[2]。同时创伤后液体循环途径的破坏也可以导致免疫细胞的直接入侵[3-4],这或许可以解释创伤后脑部长期存在的神经炎症[5]。中枢神经系统液体循环途径的破坏在TBI后病理生理改变中发挥重要作用,这可能为改善TBI后患者生存质量提供了重要靶点。
1 CSF、脑室和SAS
在中枢神经系统中,CSF的产生、循环与吸收维持着动态平衡。脑组织被SAS的脑脊液包裹,这种“悬浮”状态保证了在正常颅内压下脑组织可以维持正常的形态,并且可在外界应力的作用下起到缓冲的作用,减轻其对脑组织的伤害。另一方面,脑脊液是脑组织细胞外液的主要来源,在营养物质运输和代谢产物清除的过程中起重要作用。
1.1脑脊液的产生 现在的研究认为:约80%的脑脊液由脑室的脉络丛产生,剩下的20%是由跨BBB的血浆超滤液构成。脉络丛由室管膜上皮、软脑膜及其表面的血管共同构成,在侧脑室、第三脑室与第四脑室都有分布[6]。脉络丛上皮细胞上的钠离子-钾离子-ATP酶、Na+/K+/Cl+共同转运体的共同作用形成渗透梯度[7],来自外周循环的液体在渗透梯度和水通道蛋白-1(aquaporin-1,AQP1)的协同作用下进入脑室[8-10]。
1.2脑脊液的循环与吸收 在脑室产生的脑脊液通过两侧的第四脑室外侧孔和位于后方的正中孔进入SAS。SAS的脑脊液约占脑脊液总量的80%,而脑室内的脑脊液占总量的20%。
位于SAS的脑脊液可以在动脉搏动的驱动下进入血管周围间隙(perivascular spaces,PVS)进行物质交换,在带走PVS的代谢产物后回到SAS,通过硬脑膜淋巴管、神经周围结构、蛛网膜颗粒或上矢状窦旁空隙等途径回到外周循环。
2 类淋巴系统的结构
类淋巴系统也被称为胶质淋巴系统。对于这些命名,前者是因为其在生理功能上承担着与外周淋巴系统相似的角色,后者是因为其星形胶质细胞的依赖性。在类淋巴系统被发现之前,脑细胞外基质的物质交换被认为是跟CSF循环完全分开的。以前,人们普遍认为脑实质内代谢废物的清除只能依靠蛋白酶的降解或者依赖BBB上的底物特异性的转运体转运到外周[11]。直到Iliff等[12]利用双光子显微镜发现位于星形胶质细胞足突与血管壁之间的间隙结构对脑组织内的代谢废物具有引流作用。
2.1宏观结构 类淋巴系统由动脉旁的脑脊液流入途径、依赖星形胶质细胞足突AQP4的脑脊液-脑间质液交换途径以及静脉旁的脑组织间液清除途径三个部分构成[12]。
2.2微观结构
2.2.1基底膜:基底膜是细胞外基质(extracellular matrix,ECM)的一种特殊形式,主要成分有层粘连蛋白(laminin)、Ⅳ型胶原纤维等。中枢神经系统中含有血管基底膜(laminin 411、511)、软脑膜基底膜(laminin 111)和神经胶质基底膜(laminin 211)这三种不同来源的基底膜[13-14]。在SAS,CSF走行在血管基底膜与软脑膜基底膜之间,当液体随着穿支动脉进入脑实质时,软脑膜基底膜、神经胶质基底膜融合,与血管基底膜共同围成了血管周围间隙结构,被周细胞等分泌的Ⅳ型胶原纤维、层粘连蛋白等高度有序排列的细胞外基质成分所充盈[15]。软脑膜基底膜部分在毛细血管消失,毛细血管基底膜由血管内皮细胞和星形胶质细胞来源的层粘连蛋白共同构成[16]。
2.2.2AQP4的极性表达:类淋巴系统的功能实现高度依赖于星形胶质细胞足突上AQP4蛋白的极性表达[17-18]。AQP4 的M1单体和M23单体聚集成四聚体,与内部整流钾离子通道共同构成粒子正交序列(orthogonal arrays of intramembranous proteins,OAPs)[19],极性分布在血管周围60%以上的足突上,而星形胶质细胞的胞体几乎没有OAPs的覆盖[20]。
AQP4的极性表达主要依赖肌营养不良蛋白相关蛋白复合物(dystrophin associated protein complex,DAPC)[21]。DAPC主要包括肌营养不良蛋白(dystrophin)、α/β-肌营养不良蛋白聚糖(α/β-dystroglycan,α/β-DG)、α-互养蛋白(α-syntrophin,α-syn)等。DAPC一方面通过α-syn 使得OAPs稳定在星形胶质细胞的足突上[22],另一方面,通过α-DG与血管基底膜中特有的层粘连蛋白、聚集蛋白相结合,再通过膜上的β-DG与细胞骨架结合,实现AQP4的极性表达以及星形胶质细胞足突在血管周围的锚定(图1)[23]。当缺少DAPC中的成分时,AQP4的极性也会消失[21]。

图1 类淋巴系统的微观结构
血小板来源生长因子-B(plate-derived growth factor-B,PDGF-B)是PDGF-Rβ酪氨酸激酶受体的高亲和力配体,由内皮细胞产生,在周细胞上发挥作用,参与发育过程中的血管形成。PDGF的C端具有与硫酸肝素蛋白聚糖相连接的结构,负责周细胞向细胞外基质释放分泌性生长因子的过程[24]。研究证实,PDGF-B通路中断不仅会破坏星形胶质细胞足突上AQP4的极性,而且会影响类淋巴系统的成熟过程[15]。聚集蛋白也是硫酸肝素蛋白聚糖的一种,可能参与了PDGF信号通路。
3 细胞外基质的液体运输
血管周围间隙的液体在跨过脑实质基底膜后,进入脑组织的细胞外间隙。
3.1血管周围液体交换 AQP4在星形胶质细胞足突上的极性表达是血管周围液体交换的最基本条件,但是至今仍没有确切的研究证明血管周围间隙的液体究竟是直接通过AQP4进入细胞外间隙,还是AQP4是以间接的方式帮助液体通过其他途径进入。液体可能直接跨过星形胶质细胞的足突,也可能先后经过足突和胞体。甚至可能不经过星形胶质细胞,而是在静水压或者渗透压梯度的驱动下从细胞间向脑间质扩散[25-26]。
3.2ECM 脑内ECM包括神经细胞外基质、脑膜和基底膜等。糖胺聚糖(glycosaminoglycan,GAGs)是脑组织细胞外基质中的重要组成成分,由重复的二糖结构构成,最常见的GAGs有硫酸软骨素和硫酸肝素。在生理pH下GAGs带负电荷,并且具有很强的水合能力。ECM的一个重要特征是生理条件下GAGs是未被完全水合的,因此对水和无机阳离子都有很强的吸引作用[27]。在这种情况下,一方面ECM(胶原纤维、层粘连蛋白、纤连蛋白、弹性蛋白等)形成纤维骨架网络,限制GAGs的水合能力;另一方面,ECM纤维网络可以通过细胞膜上的整合素(integrin)受体和CD44受体等[28],与细胞骨架相连接,形成一个胞内胞外协同作用的复杂纤维网络,共同对GAGs的水合能力起限制作用[29]。
急性损伤会激活细胞外基质中的基质金属蛋白酶-2/9(matrix metalloproteinase enzymes-2/9,MMP-2/9)和蛋白酶。MMP-2/9的激活会导致神经血管单元的降解与BBB的打开,蛋白酶的激活会导致基质蛋白的降解,断开基质蛋白与细胞受体的联系,组织张力降低,最终引起GAGs的水合[25,30]。
4 类淋巴循环的影响因素
4.1血流动力学(vasodynamics) 心脏的搏动是类淋巴循环的主要驱动力,心脏搏动后动脉血管壁扩张,可将脑脊液从SAS泵入脑实质的血管周围[31-32]。心血管药物可以显著影响脑脊液流入动脉周围间隙,如β-肾上腺素受体激动剂多巴酚丁胺有正性肌力作用,被证实可以促进脑脊液向血管周围间隙的流动[33]。
心脏搏动不是决定血流动力学的唯一因素,血管平滑肌细胞的收缩舒张调节所导致的动脉的直径变化也可以显著促进脑室内脑脊液的流动。另外,静脉血容量的改变也会显著影响脑内代谢产物的清除速率[31]。
4.2各种压力改变 心率、脉压、血压等都会影响到心脏的搏动。颅内压的改变也会对类淋巴循环产生影响,甚至呼吸的节律改变,通过改变胸腔内压,进而引起中心静脉压的改变,再对脑内静脉压产生影响,最终影响颅内压[34],对类淋巴循环产生作用。
4.3睡眠/觉醒状态改变 类淋巴系统主要活跃在非快速动眼期,这一时期血管周围AQP4的极性表达更为显著[35],同时细胞外液的体积可以增加60%,使得相应的流体阻力降低[36],两者共同促进类淋巴系统的功能,类淋巴系统将大量的脑脊液泵入神经纤维网络,新鲜的脑脊液与细胞外液接触,从而带走清醒状态下产生的大量代谢废物,如Aβ等[37]。因此,获得充足的睡眠对于维持正常的认知功能来说是十分必要的。大脑蓝斑产生的去甲肾上腺素能信号在睡眠和觉醒状态的调控中起重要作用,通过使用药物阻断觉醒状态下小鼠的去甲肾上腺素能信号可以一定程度上缓解细胞外液体积的丢失,从而增强类淋巴系统的功能[36,38]。使用氯胺酮/甲苯噻嗪或是异氟烷/右旋美托咪啶麻醉的小鼠的类淋巴系统表现出了跟正常睡眠情况下相似的功能增强作用[39]。
5 颅内代谢产物进入外周循环的途径
5.1蛛网膜颗粒 蛛网膜颗粒/绒毛是蛛网膜凸向硬脑膜窦内的颗粒/绒毛状结构(图2),主要分布在上矢状窦周围,是唯一已经明确的可以直接将脑脊液转运入外周循环的途径[40]。蛛网膜颗粒对脑脊液的转运具有单向性和压力依赖性,在压力差存在的情况下,脑脊液可以通过细胞外空隙、微胞饮囊泡以及细胞内空泡等途径单向由SAS向窦内运输[41-42]。
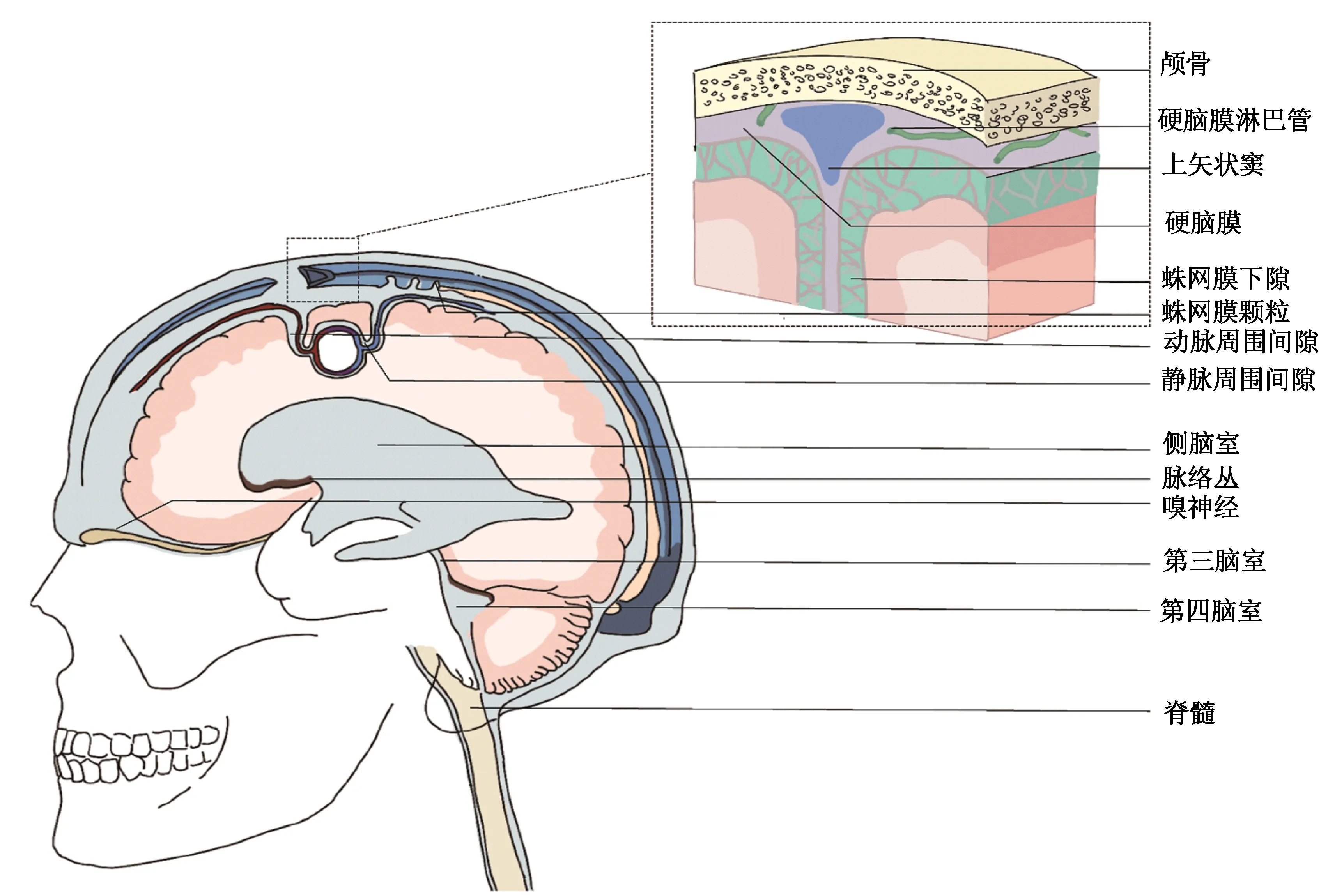
图2 颅内代谢产物进入外周循环的途径
5.2硬脑膜淋巴管 由于大脑缺乏实质性的淋巴管结构,所以在很长的一段时间里被认为是一个免疫豁免的器官。直到2015年硬脑膜淋巴管的发现,证实了硬脑膜中存在能直接将液体和免疫细胞引流至颈部淋巴结的淋巴管样结构。硬脑膜淋巴管可表达淋巴管特异性的prospero同源异形盒蛋白1(prospero-related homeobox-1,Prox-1)、淋巴管内皮透明质酸受体、平足蛋白和血管内皮生长因子受体3(vascular endothelial growth factor receptor 3,VEGFR-3)[43]。硬脑膜淋巴管多存在于背侧与基底侧的硬脑膜中,走行在硬脑膜的大血管(如上矢状窦、窦汇、横窦以及岩窦、乙状窦等)周围,引流脑脊液中的大分子物质(图2)[43]。其中基底侧的硬脑膜淋巴管呈现出不连续且直径较小的特征,缺乏平滑肌细胞与瓣膜,形态学上与毛细淋巴管更相似,而背侧的硬脑膜淋巴管直径更大、含有瓣膜,形态上与集合淋巴管更相似,可能在淋巴引流中发挥更重要的作用[44]。硬脑膜淋巴管是脑内代谢废物的重要排出途径,也在中枢神经系统炎性反应的调节中起重要作用[45]。硬脑膜淋巴管的淋巴管新生(lymphangiogenesis)受到血管平滑肌细胞和垂体腺、松果体释放的血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)的调控[46],向小鼠的小脑延髓池注射具有VEGFR-3特异性的重组VEGF-C蛋白后,7d后可以观察到硬脑膜淋巴管直径的显著增加[43]。
5.3神经周围途径 位于SAS的脑脊液可以随着脑神经周围的蛛网膜鞘出颅,被周围的毛细淋巴管吸收后再汇入淋巴结[41]。例如脑脊液可与嗅神经伴行,通过筛板汇入颈部淋巴结,嗅神经周围途径是引流量最大的一条神经周围途径[47]。其他脑神经,如视神经、三叉神经、面神经等周围也发现有脑脊液来源示踪剂充盈的淋巴管[48]。
5.4其他 Ringstad和Eide[49]在使用钆布醇作为示踪剂对脑脊液的研究中发现,在上矢状窦旁的硬脑膜中有一些空隙,这些结构可能在脑组织和硬脑膜淋巴管的液体交换之间起连接作用。Ma等[50]利用近红外和磁共振成像,阐述了向脑室内注射的示踪剂在脊髓的SAS和中央管内的分布,并最后汇入骶髂淋巴结的脊柱旁途径。
6 总结与展望
脑组织与外周组织一样,都需要液体的流动促进物质的交换、带走代谢废物。在外周组织中,根据Starling机制,液体在静水压的驱使下通过动脉末端的毛细血管床,滤过到组织液中,通过淋巴管的回流实现细胞外间质中蛋白的清除。中枢神经系统需要维持正常的电生理活动,因此相较于外周组织对液体运输有着更为特殊的要求。另外,由于构成BBB的血管内皮细胞之间的紧密连接很大程度上限制了毛细血管的滤过作用[30],加上脑组织内实质性淋巴系统的缺乏,这些都增加了颅内液体运输途径的复杂性。为了适应这些特征,脑组织中的脉络丛、血管周围间隙、毛细血管床附近星形胶质细胞足突上AQP4的极性分布等共同保证了脑内液体净流动的单向性,使得脑组织能够维持和周围组织类似的毛细血流灌注和淋巴回流的过程。
经过在ECM进行的CSF-脑间质液交换之后,顺着静脉周围间隙离开的液体进入SAS,进一步通过蛛网膜颗粒、脑膜淋巴管、神经周围途径等进入外周循环。随着年龄的增加,与神经退行性疾病密切相关的毒性蛋白如Aβ、Tau蛋白和α-突触核蛋白在脑内沉积逐渐增多,提示有效地清除代谢废物在正常衰老的过程中发挥着重要的作用[5,51]。类淋巴系统可以清除细胞外间隙的Aβ,其清除效率的下降会显著影响到Aβ的沉积,最终成为AD的可能发病机制,也成为一个潜在的治疗靶标[12,17,52]。随着实验影像学技术的不断进步,人们对脑内液体的产生、运输、吸收过程及其相关影响因素的认识不断被更新和扩充,也为相关疾病的诊断和治疗提供了新的依据和方向。
作者贡献声明:汪雪:资料搜集、论文撰写;高胜青:资料收集、论文修改、文献检索;周梦良:研究指导、论文修改及审校
