紫楠种子的休眠与萌发特性
2023-07-26李铁华何功秀郭淑芸张艺博
邢 露,李铁华,何功秀,郭淑芸,张艺博
(中南林业科技大学 a.林学院;b.中亚热带林学国家长期科研基地,湖南 长沙 410004)
紫楠Phoebesheareri,樟科常绿乔木,是金丝楠木的产材树种。紫楠自然分布于长江流域及以南海拔一般不超过1 000 m 的山地阔叶林中[1]。树干通直,木纹理直,结构细,质坚硬,耐腐性强,常用于建筑材料和制作木质器具[2]。紫楠树形挺拔,枝叶浓密,是优良的园林绿化树种[3]。紫楠是我国的珍贵用材树种,同时紫楠也可提芳香油。紫楠在我国资源甚少,由于用途广、自然更新能力弱和人为砍伐等原因,野生紫楠的资源日近枯竭。
种子最重要的作用是保持物种的存续与繁衍,因此植物在进化过程中形成了一系列确保种子萌发的生理机制[4]。种子休眠是种子适应环境的一种策略,有助于植物生存和物种的延续及进化,但是有些休眠的种子即使是在最适宜的条件下也会萌发困难,进而阻碍了苗木繁育与商业化种植的发展。Baskin 等[5]将种子休眠主要分为5 种类型,即生理休眠(PD)、物理休眠(PY)、形态休眠(MD)、形态生理休眠(MPD)、综合休眠(PY+PD)。种子休眠过程不仅与外界环境因素相关,还与种子自身结构等因素密切相关,Hudson 等[6]报道约25%的植物种子处于物理休眠状态,已经被报道的具有物理休眠的有漆树科Anacardiaceae和锦葵科Malvaceae等。也有许多研究工作表明,一些植物种子的某些部位存在内源萌发抑制物,阻碍了种子代谢进而抑制了种子萌发[7]。为了打破种子的休眠,可以利用一些物理和化学的方法,例如GA3已被证明能解除种子休眠并提高种子的萌发率,但是刘继生等[8]的研究表明,GA3对低温后熟的东北刺人参种子萌发没有作用。层积处理也可以打破种子休眠,王书云等[9]的研究证实了低温层积通过改变金银花种子的激素水平,提高了种子萌发率。温度是种子萌发必要的外部条件之一,对种子发芽的调控使种子只在适宜幼苗生长的季节萌发,在决定种子发芽时间和物种分布方面具有重要的影响,可在特定的环境下最大程度地增加幼苗的存活率,适宜的温度能够缩短种子发芽时间和提高种子发芽率[10]。
近年来,我国对珍贵树种木材的需求量越来越大,现有珍贵树种资源量严重匮乏,后备资源不足。紫楠作为我国特有的珍贵用材树种,是建筑与家具的良材,但是紫楠种子具有休眠特性,萌发困难,制约了紫楠苗木的培育,而目前对紫楠种子休眠的原因和萌发困难的生理机制缺乏研究,因而也没有研发促进其萌发的技术方法。本研究通过测定紫楠种子的透水性、呼吸速率、萌发抑制物质、发芽率及低温层积对种子萌发的影响,确定紫楠种子的休眠类型并阐明其休眠机理,研究解除紫楠种子休眠与促进萌发的方法,为紫楠苗木培育及规模化种植提供理论依据和技术手段。
1 研究方法
1.1 试验材料
供试的紫楠种子于2020 年11 月采自江西省分宜县亚热带林业研究中心(104°45'E,27°54'N)。先将采来的新鲜的紫楠种子于清水中浸泡24 h,去除果皮,取出种子,将种子用5%的高锰酸钾溶液浸泡消毒30 min,然后将种子清洗干净并阴干,水迹稍干后,即可进行贮藏或发芽试验。试验紫楠种子平均横径6.56 mm,平均纵径9.58 mm,种子平均含水率38.46%,千粒质量303.7 g。
大白菜种子的品种为胶研2869,净度98%、发芽率85%、含水率7%。大白菜种子通常被用于植物浸提液抑制作用的鉴定。
1.2 试验方法
1.2.1 层积处理
种子与湿沙按照1∶3 的比例均匀堆放,沙的持水量为60%,层积温度为(4±1)℃[11]。
1.2.2 种皮的透水性
将紫楠种子分为去皮和不去皮两种处理,加入蒸馏水浸没种子,置于25±1 ℃的恒温培养箱中。每隔4 h 测定一次种子质量,直至种子质量不再变化为止。
吸水率(%)=(吸水后质量-吸水前质量)/吸水前质量×100%[12]。
1.2.3 种子的呼吸速率
将紫楠种子设置7 个处理:新鲜完整种子、新鲜去种皮种子、新鲜完整层积不同时间种子(层积25、50 天、75、100、125 d),每个处理30粒种子。用移液枪提取10 mL 的0.4 mol/L NaOH溶液加入培养皿中,将培养皿放入呼吸室,放置隔板并封盖,放置1 h 后,将培养皿溶液移入锥形瓶中,加入25 mL 饱和BaCl2溶液和2 滴酚酞指示剂,用0.3 mol/L 草酸溶液滴定,同时设置空白对照[12]。
呼吸强度[CO2mg·(g·h)-1]=[(V1-V2)×N×44]/W×t。
式中:N=H2C2O4摩尔浓度,W=样品质量/g,t=测定时间/h,44=CO2摩尔质量,V1为空白滴定时消耗的草酸量(mL),V2为样品滴定时消耗的草酸量(mL)。
1.2.4 紫楠种子浸提液的抑制作用
选取新鲜饱满的紫楠种子约10 g,将种子在研钵中磨碎,加入100 mL浓度为80 %的甲醇溶液,在0~4 ℃恒温条件下密封浸提,每隔12 h 震荡1 次,使其充分浸提,浸提72 h 后过滤,再加入150 mL 浓度为80 %的甲醇溶液继续密封浸提72 h,将2 次浸提液合并,用旋转蒸发仪蒸干,加入少量乙醇溶解浸提物质,将乙醇溶液倒出并用蒸馏水进行清洗,合并乙醇溶液和清洗液倒入容量瓶中,再用蒸馏水定容至250 mL,此浸提液即为紫楠种子的甲醇浸提液。
选取新鲜饱满的紫楠种子10 g,将种子在研钵中磨碎,加入100 mL 蒸馏水,在温度为4 ℃恒温条件下密封浸提,每隔12 h 震荡一次,使其充分浸提,浸提72 h 后过滤,再加入100 mL 的蒸馏水继续密封浸提72 h 后过滤,将2 次浸提液合并,再用蒸馏水定容至250 mL,此浸提液即为紫楠种子的水浸提液。
用不同浓度的紫楠种子甲醇浸提液和紫楠种子水浸提液,分别用大白菜种子进行生物测定,将获得的2 种浸提液分别稀释,浓度(浸提液体积mL/溶液体积mL)为:0 mL/100 mL、25 mL/100 mL、50 mL/100 mL、75 mL/100 mL、100 mL/100 mL。在直径9 cm 的培养皿中铺两层滤纸作为发芽床,分别加入上述各浓度的浸提液5 mL,在发芽床上均匀放置30 颗大白菜种子,在(25±1 ℃)恒温黑暗培养箱内进行大白菜种子发芽试验,24 h 后统计大白菜种子的发芽率,以胚根突破种皮视为萌发。48 h 后统计已萌发大白菜种子的根长[11]。
1.2.5 种子发芽试验
每个处理随机选取30 粒紫楠种子,置于25±1 ℃的恒温培养箱发芽床上,进行发芽试验,以胚根突破种皮的长度与种子等长视为萌发,每天测定种子萌发率,连续10 d 无新的种子萌发视为试验结束。
1.2.5.1 不同种皮处理对种子萌发的影响
对未层积处理的紫楠种子进行去种皮和不去种皮的两种不同处理,并进行发芽试验。
1.2.5.2 低温层积对种子萌发的影响
将低温(4±1 ℃)层积25、50、75、100 d的紫楠种子,分别进行发芽试验。
1.2.5.3 温度对紫楠种子萌发的影响
设置15、20、25、30 和35 ℃恒温、日30 ℃夜20 ℃、日25 ℃夜15 ℃变温共7 个温度处理,对已层积解除休眠的紫楠种子进行萌发试验。
1.3 数据分析
所有试验均进行3 次重复,采用Excel 2016 软件进行数据处理,采用SPSS 26.0 软件进行单因素方差分析(ANOVA),分析时采用具有标准偏差的平均值,采用Origin 8.0 软件进行图表制作。
2 结果与分析
2.1 紫楠种皮的吸水性
如图1 所示,无论是否有种皮,紫楠种子的吸水率都随着吸水时间的延长而增加,去种皮的紫楠种子在浸水后立即吸胀,浸种前12 h 吸水最快,此时吸水率达到11.99%,12 h 后吸水率增长变缓,28 h 后吸水率趋近于平稳状态,此时吸水率为14.27%。完整种子的吸水率表现出缓慢上升的变化趋势,44 h 趋近于平稳,但是吸水率较低,44 h 吸水率仅7.43%。完整种子和无种皮种子吸水率具有显著性差异(P<0.05),种皮虽然具有吸水性,但种皮对吸水率阻碍作用大,吸水率较差可能是导致种子休眠的原因之一。
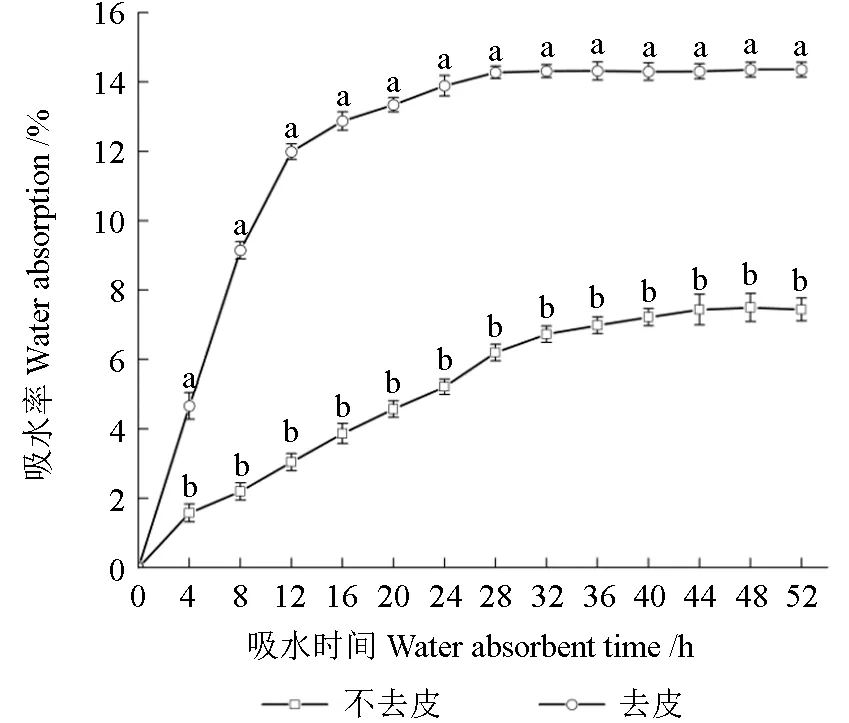
图1 种皮对种子吸水率影响Fig.1 Effects of seed coat on the water absorption of seeds
2.2 紫楠种子的呼吸速率
如图2 所示,不同处理对紫楠种子的呼吸速率具有不同影响。新鲜去皮种子与新鲜完整种子的呼吸速率存在显著差异(P<0.05),新鲜去皮种子的呼吸速率为0.69 mg·g-1·h-1,新鲜完整种子呼吸速率最低,为0.31 mg·g-1·h-1,去皮种子的呼吸速率是完整种子2.2 倍,说明紫楠种皮的透气性存在障碍。随着低温(4±1 ℃)层积时间的延长,种子呼吸速率增强,层积25、50、75、100 和125 d 的带种皮的完整种子呼吸速率分别为0.36、0.42、0.47、0.52、0.62 mg·g-1·h-1,层积125 d 的完整种子呼吸速率最高。层积125 d 种子的呼吸速率显著高于新鲜完整种子的呼吸速率(P<0.05)。

图2 不同层积时间对紫楠种子呼吸速率的影响Fig.2 Effects of different stratification time on the respiration rate of Phoebe sheareri seeds
2.3 不同种皮处理对种子萌发的影响
如图3 所示,在60 d 的发芽率过程中,完整种子前20 天发芽率为0%,第30 天时发芽率为2.22%,直至第60 天时的发芽率也仅有3.33%。与完整种子相比,去皮种子发芽早,发芽快,发芽率高,10~20 d 发芽速度增快,第20 天发芽率为63.33%,20~50 d 发芽速度减缓,第50 天时发芽率为93.33%,50 d 后发芽速度趋近于平稳,60 d 后发芽结束,此时发芽率为94.44%。60 d 去皮种子发芽率比完整种子发芽率高出91.11%,去皮种子发芽率是完整种子发芽率的约31 倍。完整种子与去皮种子发芽率呈现显著差异(P<0.05),表明种皮对紫楠种子萌发具有抑制作用。
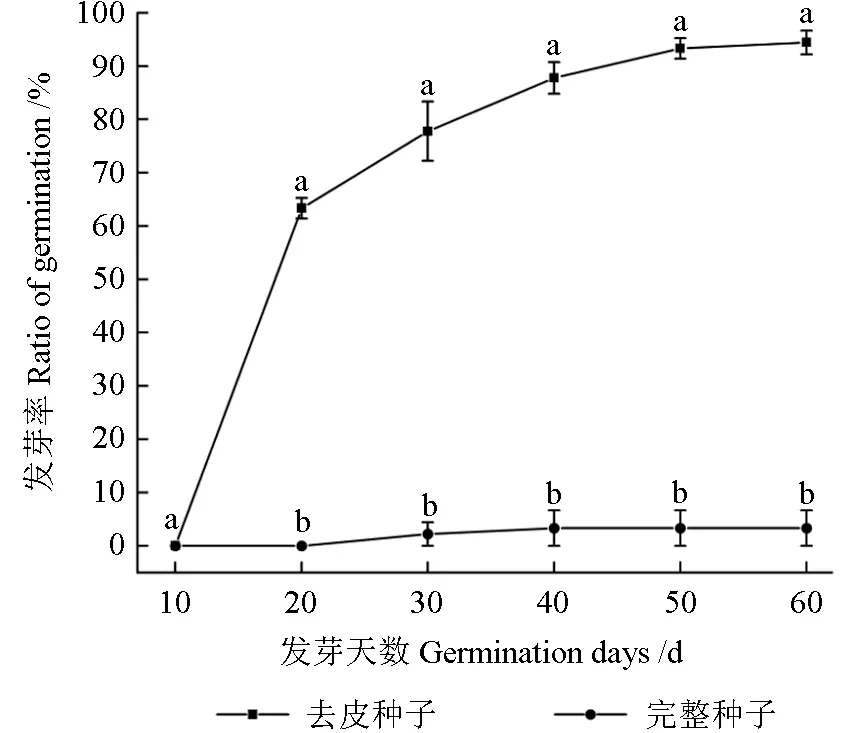
图3 种皮对种子发芽率影响Fig.3 The effect of seed coat on the germination rate of seeds
2.4 紫楠种子浸提液对大白菜种子萌发和根生长的抑制作用
2.4.1 紫楠种子水浸提液对大白菜种子发芽率影响
如图4 所示,不同处理间大白菜种子发芽率差异性显著(P<0.05)。层积0 d 的新鲜紫楠种子水浸提液抑制作用最强,随着水浸提液浓度的增加,发芽率大幅度下降,当紫楠种子水浸提液浓度为100 mL/100 mL 时,大白菜种子发芽率仅有7.78%。随着低温层积时间的延长,水浸提液的抑制作用逐渐减弱,层积0、25、50 和75 d 的紫楠种子水浸提液对大白菜种子的发芽率逐渐升高,当水浸提液浓度为100 mL/100 mL 时,大白菜种子的萌发率分别为7.78%、50.00%、62.22% 和70.00%,层积0 d 的新鲜紫楠种子水浸提液抑制作用最强。图4 也显示,层积100 d 的紫楠种子的任何浓度水浸提液均没有抑制作用,大白菜种子发芽率为92.22%~96.67%。除了层积100 d 的紫楠种子水浸提液外,其他处理中,随着水浸提液浓度的增加,大白菜种子的发芽率降低,这表明浓度越高的水浸提液对大白菜种子的萌发具有越强的抑制作用。通过低温层积的方式可以减少紫楠种子内含的抑制物含量,从而降低对大白菜种子发芽的抑制效果。

图4 低温层积时间和的水浸提液浓度对大白菜种子发芽的影响Fig.4 Effects of water extract concentrations of Phoebe sheareri seeds with different stratification time on the seed germination of Chinese cabbage
2.4.2 紫楠种子甲醇浸提液对大白菜种子发芽率影响
如图5 所示,与水浸提液对大白菜发芽率的影响趋势类似,在同一层积时间时,甲醇浸提液浓度越大,对大白菜发芽的抑制效果越明显,大白菜种子的发芽率越低。在同一甲醇浸提液浓度下,层积时间越久大白菜种子发芽率越高,当浓度为100 mL/100 mL 时,层积0 d 的抑制效果最强,大白菜种子的萌发率最低,发芽率为24.44%,层积25、50 和75 d 的发芽率为40.00%、65.56%和73.33%。层积100 d 的紫楠种子甲醇浸提液没有抑制作用,其大白菜种子的发芽率为93.33%~95.56%。

图5 不同低温层积时间和不同浓度的紫楠种子甲醇提取物对大白菜种子发芽的影响Fig.5 Effects of the methanol extracts from Phoebe sheareri seeds with different stratification time on the germination of Chinese cabbage seeds
2.4.3 紫楠种子水浸提液对大白菜种子根生长的影响
如图6 表明了不同层积时间的紫楠种子水浸提液处理的大白菜幼苗根长具有显著性差异(P<0.05)。同一层积时间下,紫楠种子水浸提液浓度越高,大白菜种子的根长越短,表明浓度越高的紫楠种子水浸提液对大白菜种子根的生长具有更强的抑制作用。层积100 d 的紫楠种子水浸提液处理的大白菜根长在17.60~18.90 mm 之间,不同浓度处理的大白菜根长差异不大。层积0、25、50 和75 d 的紫楠种子水浸提液对大白菜的根长生长具有抑制效果,层积0 d 的抑制作用最强,大白菜幼苗的根长生长最慢,当水浸提液浓度为100 mL/100 mL 时,根长仅有1.26 mm。层积25、50 和75 d 的根长分别为5.13、8.57、11.63 mm。表明水浸提液对大白菜种子根长的抑制作用可以通过延长层积时间来缓解,而在层积100 d 时,水浸提液对大白菜的根长生长几乎没有抑制作用。

图6 不同低温层积时间和不同浓度的紫楠种子水浸提液对大白菜根长的影响Fig.6 Effects of different stratification time and different concentrations of water extracts from Phoebe sheareri seeds on the root length of Chinese cabbage
2.4.4 紫楠种子甲醇浸提液对大白菜种子根生长的影响
如图7 所示,与水浸提液对大白菜根长的影响趋势类似,各处理之间具有显著性差异(P<0.05),当浓度为100 mL/100 mL 时,层积0 d 的紫楠种子甲醇浸提液对根长的影响最强,大白菜根长为3.79 mm。层积25、50、75 d 的根长分别为4.98、8.68、10.40 mm,在层积100 d 的种子浸提液中,甲醇浸提液中大白菜种子根长为13.24 mm 以上。结果表明,紫楠种子甲醇浸提液对大白菜幼苗的根长生长也具有抑制作用,且浓度越高抑制效果越明显,同时抑制作用会随低温层积时间的延长而降低。

图7 不同低温层积时间和不同浓度的紫楠种子甲醇浸提液对大白菜根长的影响Fig.7 Effects of methanol extracts from Phoebe sheareri seeds with different stratification time and different concentrations on root length of Chinese cabbage
2.5 不同层积时间对紫楠种子发芽率的影响
如图8 所示,不同的层积时间导致紫楠种子发芽率具有显著性差异(P<0.05),层积处理100 d 的紫楠种子发芽最早,在第10 天时开始发芽,50 d 基本完成发芽,发芽率为96.67%,当发芽天数到60 d 时,紫楠种子发芽率为98.89%。层积25 d 的发芽最晚,40 d 以后才开始发芽,到第60 d 时,发芽率为8.89%。层积0 d 的紫楠种子在第30 天开始发芽,但是在第40 天时发芽结束,最终发芽率仅为3.33%。层积50 d 的种子在20 d 后开始发芽,60 d 时发芽率为53.33%。层积75 d 的紫楠种子第10 天开始发芽,在第60 天时发芽率为62.22%。研究结果表明,低温层积能够打破紫楠种子的休眠,当低温层积时间延长,紫楠种子发芽提早,发芽速度加快,发芽率提高,同时结果显示紫楠种子发芽率最高的低温层积时间为100 d。
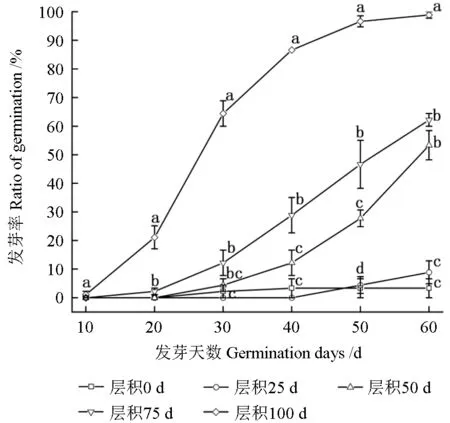
图8 不同层积时间对紫楠种子发芽率的影响Fig.8 Effects of different stratification time on the seed germination rate of Phoebe sheareri
2.6 不同温度对紫楠种子发芽率的影响
如图9 所示,不同温度对紫楠种子发芽率具有不同影响,不同温度的紫楠种子发芽率差异显著(P<0.05)。25 ℃和30 ℃的紫楠种子最先发芽,且25 ℃的种子发芽率较高,第7 天时发芽率为14.44%,28 d 时基本完成发芽,此时的发芽率已达到了91.11%,42 d 时发芽率达到97.78%。35 ℃时发芽最晚,发芽率较低,42 d 发芽率仅7.78%。15 ℃时的发芽率较低,42 d 仅达到30.00%。在30 ℃、日30 ℃夜20 ℃、20 ℃、日25 ℃夜15 ℃的温度对紫楠种子发芽率的影响依次减弱,但在42 d 时发芽率均能达到78.89%以上。由此说明,紫楠种子萌发的最适温度是25 ℃。

图9 不同温度对紫楠种子发芽率的影响Fig.9 The Effect of different temperatures on the germination rate of Phoebe sheareri seeds
3 讨 论
本研究旨在了解紫楠种子是否具有休眠特性,寻找其休眠类型以及其萌发条件。在本研究中,如图1 所示,可以看出完整新鲜种子透水性和去皮种子的透水性有显著性差异(P<0.05),新鲜完整种子的种皮虽然具有透水性,但是透水能力远不如新鲜去种皮紫楠种子,说明紫楠种皮对透水性具有极大的阻碍作用,可以推论紫楠种子具有物理休眠(PY)特性。去皮种子与完整种子的透气性具有显著性差异(P<0.05),说明种皮通过影响呼吸速率从而影响种子萌发(图2)。在本研究中(图3),新鲜完整的紫楠种子发芽率较低,60 d 时发芽率为3.33%,无种皮的紫楠种子则高达94.44%,两者相差91.11%。种皮对于种子萌发的影响最大,是抑制种子萌发的重要因素,打破紫楠的种皮障碍有助于紫楠种子的萌发,这与姜宗庆等[13]的观点一致。在本研究中,发现紫楠种子浸提液可以降低大白菜种子的发芽率(图4~5)并抑制大白菜种子根系的生长(图6~7),随着紫楠种子浸提液浓度的增大,对大白菜种子的发芽率与根长的抑制效果越明显,表明紫楠种子浸提液中含有诱导种子休眠的抑制物,这与楠木的试验结果相同[14],可以推论紫楠种子本身含有的发芽抑制物质是引起其休眠的另一个原因。广泛研究证明种子休眠抑制物中存在的脱落酸、酚类、脂类等化合物可以诱导种子休眠和阻止萌发[15-17]。结合种子呼吸率低和具有萌发抑制物质可以推断紫楠种子具有生理休眠(PD)。综合上述分析表明,紫楠种子的休眠类型属于综合休眠(PY+PD)[5]。
低温层积(4±1 ℃)处理对解除种子休眠具有很大的影响。一些深层形态生理休眠的种子,至少需要8 周的低温层积才能够解除休眠,随低温层积时间的延长种子的萌发率显著上升[18]。本研究结果显示,紫楠种子至少需要层积50 d 才能打破休眠。当层积100 d 时,紫楠种子的发芽率可达到96.67%以上,且发芽时间缩短至45 d。随着低温层积时间延长种皮对种子呼吸作用的影响逐渐减弱,呼吸速率逐渐增强,还可以代谢种子自身含有的萌发抑制物(图2、图4~7)。表明低温层积对种皮的阻碍和内源抑制物具有改善作用,互相之间可能存在相关性。大量研究显示低温层积能影响赤霉素和脱落酸之间的平衡解除种子休眠[19-20],同时诱导种子蛋白酶、α-淀粉酶等水解酶产生,增加可溶性糖,可溶性蛋白等内含物的含量,影响种子生理上的代谢状态,从而使得满足萌发的自身条件,进而促进种子萌发。罗弦等[21]的研究结果显示低温层积过程中苔菜种子的脱落酸含量显著减少,发芽率和脱落酸含量负相关。Yang 等[22]研究证实了低温层积通过改变水稻的GA、IAA 和ABA 水平,提高α-淀粉酶活性促进了种子萌发。
赤霉素能够诱导细胞伸长和分化,促进种皮破裂,已被证明能提高许多植物的发芽率[23-24],但是它对于不同植物有不尽相同的作用机制和效果。本实验研究了不同浓度GA3对紫楠种子萌发的影响,设置了5 个浓度,结果显示赤霉素浓度为500 mg/L 时发芽率最高,但是发芽时间较长,当发芽80 d 时发芽率仅达到18.89%,120 d 时为60.00%,160 d 时达到81.11%,由此结果表明赤霉素对解除紫楠种子休眠没有明显的促进作用,这与和子森等[25]对羽叶丁香Syringapinnatifolia和Gao 等[26]对翅果油树Elaeagnusmollis的研究一致[25-26]。赤霉素处理与低温层积处理相比并没有提高发芽率。
温度被认为是影响种子休眠和萌发时间最重要的环境因素[27]。本试验中,设置了7 个处理,由图9 所示,紫楠种子的最适温度是恒温25 ℃,这可能与紫楠生长环境有关系。Al-Namazi AA等[28]认为种子的萌发对温度的响应可能代表了对该物种栖息地的遗传响应,Kim 等[29]认为每种植物的最佳萌发温度与原生生境高度相关,根据一般规律,紫楠生长环境地处于亚热带,亚热带的种子萌发大多数发生在20~30 ℃[30]。本试验中,紫楠种子采集于江西省分宜县,该地紫楠萌芽期平均气温为25~30 ℃,而试验结果中紫楠的最适温度为25 ℃,与其生态适应环境相符合。
本试验仅对紫楠的休眠特性和解除休眠措施进行了研究,探究了紫楠种子具有休眠抑制物,没有进一步分析抑制物所在具体部位及抑制物的成分,下一步应通过分离、纯化与鉴定确定萌发抑制物质的成分。GA3促进萌发的效果不佳,以后将采用其他生长调节物质进行进一步的研究。
4 结 论
紫楠种子的种皮具有透水障碍,种子有物理休眠,种皮抑制了种子的呼吸速率,同时紫楠种子含有发芽抑制物质,种子具有生理休眠,因此,紫楠种子属于综合休眠。低温层积能有效解除紫楠种子的休眠,同时随着低温层积时间延长,发芽率呈上升趋势,低温层积100 d 可解除种子休眠,种子发芽早且快,发芽率最高达98.8%。紫楠种子萌发最适宜的温度是25 ℃。GA3溶液处理对于解除紫楠种子休眠的效果不明显。
