基于SSR标记的白蜡群体遗传多样性和群体结构分析
2023-07-26高铖铖燕丽萍吴德军王因花
高铖铖,燕丽萍,吴德军,王因花
(山东省林业科学研究院 山东省林木遗传改良重点实验室,山东 济南 250014)
白蜡属Fraxinusspp.又称为梣属,该属树种统称为白蜡,属于木犀科Oleceae 木犀亚科Oleoideae,全世界约70 种,我国约30 种,其中有10 余种从国外引进[1-2]。作为我国北方盐碱地主要造林树种和先锋树种,该属树种主要分布在我国东北地区、西北地区、黄河流域和长江流域,四川、广东和福建等省份也有分布,垂直分布海拔在400~2 000 m[3-4]。白蜡大多数喜光或稍耐阴,因生长迅速、树龄较长、成长繁殖快、适应性强、抗性强、树木材质较好等优点备受青睐,是我国北方地区用来防风固沙和盐碱地改造的优良树种[5]。因此,综合研究白蜡的种质资源情况,对其耐盐性价值进行深入分析和挖掘,对盐碱地区林业建设具有重要意义。近年来,由于白蜡广泛栽培的复杂性和试验条件的局限性,目前对白蜡种质资源遗传多样性和遗传结构的研究还十分不足,严重制约着对白蜡耐盐性资源有效保护和利用的科学认识。
随着分子生物技术的发展,基于分子标记的遗传学分析能够解决表型和生理生化指标受环境和显隐性基因影响这一难题,从而更好地评估群体的遗传多样性[6]。SSR(Simple sequence repeats)即为简单重复序列,又称为微卫星DNA(Microsatellite DNA),通常是由1~6 个碱基为基元经过多次重复串联构成的DNA 序列,因在基因组中具有共显性、多等位基因、多态性等优点,已被普遍应用于林木遗传学研究[7-9],但针对白蜡属遗传多样性的研究较少。燕丽萍等[3]应用SSR荧光标记技术对202 份白蜡种质资源的遗传多样性进行研究,构建出40 份核心种质,以期为白蜡早期选择提供理论依据和物质基础;郑鹏丽等[10]利用6 对cpSSR 分子标记探讨对节白蜡Fraxinus hupehensis10 个自然居群的遗传多样性水平,发现其遗传多样性处于中等水平且变异多发生于居群内;Abbate 等[11]通过cpSSR 和nSSR 评估濒危白蜡树种Fraxinus“mannaash”的遗传多样性,发现用于甘露聚糖生产的该种质属于尖果梣Fraxinus angustifoliaVahl.,西西里岛可能存在一个冰川避难所。鉴于此,本研究通过评估12 对核心SSR 引物在白蜡属中的多态性和通用性,对北方9 个较具代表性的白蜡居群进行遗传多样性分析,进一步认识其遗传组成和群体结构,以期为保护和利用白蜡种质资源提供有效的科学理论依据。
1 材料与方法
1.1 试验材料
2013—2019 年,课题组在全国收集白蜡种子和枝条,在山东省林业科学研究院寿光盐碱地造林试验站播种、嫁接繁育,建立种质资源圃。
于春季采集白蜡当年生嫩叶,用变色硅胶干燥,带回实验室后放入超低温冰箱中-80 ℃下保存,以备后续试验。以380 份白蜡种质资源为材料,其中北京29 份、甘肃17 份、河北68 份、辽宁49 份、内蒙古28 份、宁夏52 份、山东70 份、山西24 份、陕西43 份,具体来源地信息见表1。

表1 白蜡来源地信息Table 1 Information on the origin of Fraxinus spp.
1.2 总DNA 的提取与SSR 引物筛选
采用TIANGEN 植物基因组DNA 提取试剂盒提取白蜡叶片基因组DNA,具体操作步骤参照试剂盒说明书。测定DNA 的纯度和浓度采用紫外分光光度法,稀释并在-20 ℃下冰箱中保存备用。
从已经发表的白蜡引物中筛选多态性良好的标记用于遗传多样性分析(由山东沃恩科技有限公司合成)[3]。荧光引物PCR 扩增体系:2×Mix10 μL,10 μM 的F/R0.15 μL,DNA 原液1 μL,加ddH2O 补足20 μL。荧光引物PCR 扩增程序:95 ℃下预变性5 min;95 ℃下变性30 s,52 ℃下退火30 s,72 ℃下延伸30 s,共35 个循环;72 ℃下延伸10 min。
采用毛细管电泳上机检测法,取PCR 产物0.3 μL、分子量内标(LIZ500)0.5 μL 和去离子甲酰胺9.5 μL 混合加入PCR 板中,95 ℃下变性5 min,4 ℃下冷却后离心,1×Buffer 缓冲液上机检测。
1.3 SSR 分析与数据处理
将毛细管电泳上机结果的原始文件导入Genemarker 2.2.0,按位点导出峰图和Excel 位点信息表。读取DNA 样品扩增的产物序列大小,采用GenAlEx 6.51 计算等位基因数量(Na)、有效等位基因数量(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、群体内近交系数(Fis)、群体近交系数(Fit)、群体分化率(Fst)和基因流(Nm),采用PowermarkerV3.25 软件计算多态性信息含量(PIC)和Nei’s 多样性指数(H),GenAlEx 6.51 也用于AMOVA 分析、PCoA 分析和Mantel 检验。采用Powermarke V3.25 软件对白蜡群体结构进行UPGMA 聚类分析,绘制UPGMA 树并导出到iTOL 在线工具进行美化和编辑。群体结构分析采用Structure 2.3.4 软件估测,根据似然值最大原则,结合ΔK值确定一个合适的K值,确定该群体的亚群体数目,计算每份材料属于各亚群的概率(即Q值)。
2 结果与分析
2.1 SSR 分子标记多态性
提取白蜡叶片基因组DNA 后在紫外分光光度计上测定OD 值,OD260/OD280为1.8~2.0,表明DNA 较纯,可以进行扩增(图1)。从42 对SSR引物中筛选出12 对扩增稳定、特异性好、多态性强的分子标记(图2),筛选出的引物信息见表2。

图1 DNA 琼脂糖凝胶电泳结果Fig.1 DNA agarose gel electrophoresis results
图2 部分SSR 引物筛选的毛细电泳图谱Fig.2 The electrophoresis for some screened SSR primers

表2 12 对引物信息Table 2 12 pairs of primers
12 对SSR 引物扩增出的序列遗传多态性指数如表3 所示,扩增出的序列观察到Na共51 个,平均每对引物观察到4.287 个等位基因;Ne共28.410 个,范围在1.173~3.718,平均为2.368个;I为0.241~1.541,平均值为0.961,说明遗传提供的信息度高;PIC 为0.119 7~0.750 9,平均为0.532 9,高于0.5,说明遗传标记的多态性高;Ho为0.112~0.943,平均为0.526;He为0.123~0.721,平均为0.518;H为0.123 4~0.772 3,平均为0.576 0。可以看出这些SSR 分子标记多态性良好,能够有效分析遗传多样性。

表3 12 个SSR 标记的多态性分析Table 3 Polymorphic analysis of the 12 SSR markers
2.2 白蜡居群遗传分化
由表3 可以看出,Fis中4 个位点为负,总体平均为0.016,显示杂合频率高,地方居群的近交较多;Fit中4 个位点为负,总体平均为0.091,显示杂合频率高,整个居群的近交较多;Fst中2个位点显示居群间有较高的遗传分化水平(0.15 <Fst<0.25),其余的位点则表明居群间遗传分化程度较低(Fst<0.15),平均为0.095,白蜡各居群整体的遗传分化水平较低。Nm中1 个位点小于1,其余位点大于等于1,平均为4.199,说明各位点反映出居群间基因交流非常丰富。
2.3 白蜡居群遗传多样性与遗传结构
基于SSR 标记分析的白蜡各居群的遗传多样性指数如表4 所示,白蜡9 个居群Na为3.167~5.250,平均为4.287;Ne为2.016~2.983,平均为2.367;I为0.746~1.209,平均为0.961,其中I最高的白蜡居群是山东,表明该居群内遗传多样性比较最为丰富;Ho为0.397~0.620,平均为0.526,He为0.423~0.641,平均为0.518,仅2个居群的Ho小于He,说明群体各居群内杂合子个体较多。其中,Na、Ne和I指标均以北京、山东、陕西居群的最大,山西居群的最小。遗传多样性分析表明白蜡居群整体遗传多样性水平较高。
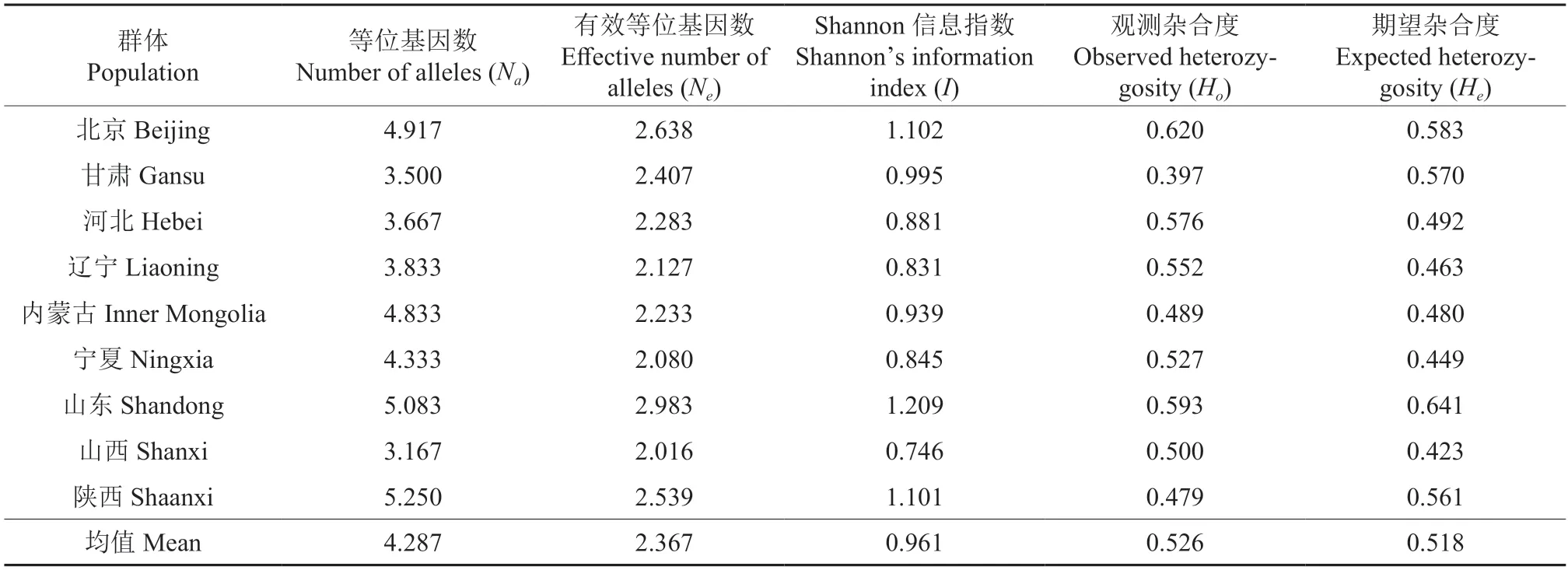
表4 白蜡居群遗传多样性指数Table 4 Genetic diversity parameters of Fraxinus spp.
AMOVA 分析结果(表5)显示,9%的变异来自居群间,属于较低程度的遗传分化水平,91%的变异来自个体间,为主要变异来源,这与白蜡居群遗传分化分析和遗传多样性分析结果基本一致。
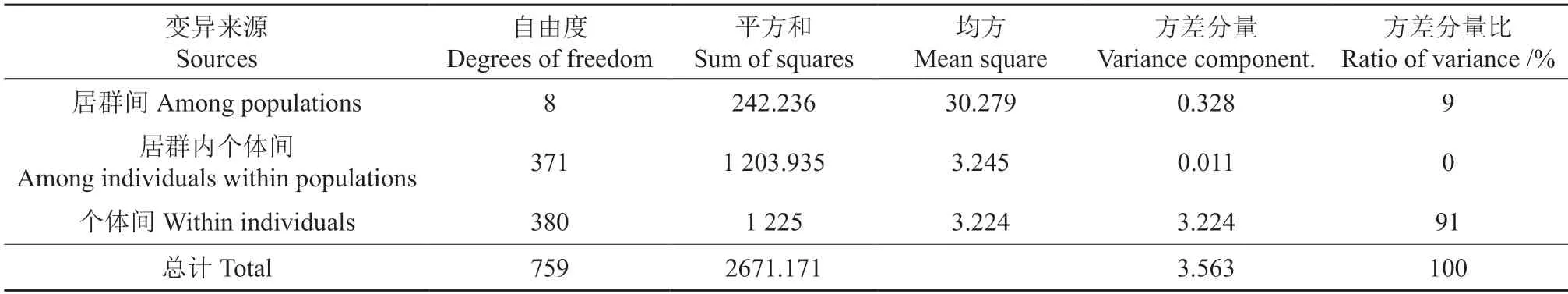
表5 白蜡居群遗传变异的 AMOVA 分析Table 5 AMOVA analysis for genetic variation of Fraxinus spp.
2.4 白蜡居群UPGMA 聚类与PCoA 分析
基于Nei’s 遗传距离,利用UPGMA 方法对来自9 个居群的380 份白蜡种质进行聚类分析,结果如图3 所示。亚群1 共7 份,包含河北1 份、辽宁1 份、内蒙古2 份、宁夏2 份、山西1 份;亚群2 共40 份,包含甘肃2 份、河北12 份、辽宁3 份、内蒙古10 份、宁夏8 份、陕西5 份;亚群3 共333 份,包含北京29 份、甘肃15 份、河北55 份、辽宁45 份、内蒙古16 份、宁夏42 份、山东70 份、山西23 份、陕西38 份。

图3 基于12 个SSR 标记的380 份白蜡种质资源遗传关系的进化树Fig.3 Dendrogram of the genetic relationship among 380 Fraxinus spp.germplasm resources based on 12 SSR markers
根据Nei’s 遗传距离,对9 个白蜡居群构建UPGMA 遗传关系聚类图,结果如图4 所示。不同地区的白蜡居群被分为三大类,其中,北京和山东地区被聚为一类,甘肃地区单独一类,河北、辽宁、内蒙古、宁夏、山西、陕西地区被聚为一类。将9 个居群间遗传距离矩阵与地理距离矩阵进行Mantel 检验,结果如图5 所示。遗传距离与地理遗传距离相关性的r值为0.044,显著性水平P值为0.460,则说明不同居群白蜡间的遗传距离与地理距离不相关(P>0.05)。上述结果表明,白蜡自然居群的地理分布和遗传距离之间没有呈现出显著的联系,距离相近的地区并没有被优先聚为一类,且存在距离较远的地区被聚为一类的现象。

图4 不同白蜡居群间遗传关系聚类分析Fig.4 Dendrogram of UPGMA analysis of 9 Fraxinus spp.Populations

图5 9 个白蜡居群间遗传距离与地理距离的Mantel 检验Fig.5 Mantel test of the genetic distance and geographical distance among 9 populations of Fraxinus spp.
380 份白蜡种质的PCoA 分析结果(图6)显示,PCoA1 和PCoA2 分别占所有白蜡种质总遗传变异的23.95%和10.86%。PCoA 分析结果与UPGMA聚类分析的结果基本一致。

图6 基于12 个SSR 标记的380 份白蜡种质资源的主坐标分析(PCoA)Fig.6 Principal coordinate analysis (PCoA) of the 380 Fraxinus spp.germplasm resources based on 12 SSR markers
2.5 白蜡居群群体结构
为了揭示380 份白蜡种质的群体结构,基于贝叶斯方法分析了来自不同地理分布的9 个居群群体的遗传结构,其中推定的种群数量(基因库)用K值表示。采用Structure 2.3.4 软件对该自然群体进行群体遗传结构分析,计算每份材料的Q值。结果显示对数似然函数值L’(K)在K=3 时有明显的峰值(图7),表明该自然群体的适宜亚群数被划分为3 类,各类亚群材料数量分别为261、77、42 和30 份。其中,亚群Ⅰ包含北京3 份、甘肃10 份、河北68 份、辽宁48 份、内蒙古23 份、宁夏49 份、山东1 份、山西24 份、陕西35 份;亚群Ⅱ包含北京23 份、辽宁1 份、内蒙古3 份、宁夏2 份、山东48 份;亚群Ⅲ包含北京3 份、甘肃7 份、内蒙古2 份、宁夏1 份、山东21 份、陕西8 份(图8)。所有白蜡材料的Q值均高于0.6,推测该部分白蜡材料遗传组分相对单一。

图7 基于Structure 软件分析估算的L’(K)和ΔK 值Fig.7 Estimated values of L’(K) and ΔK based on structure analysis

图8 基于12 对SSR 分子标记估算的380 份白蜡群体结构Fig.8 Population structures of 380 Fraxinus spp.based on 12 pairs of SSR markers
3 讨 论
本研究从42 对SSR 引物中筛选出12 对,对9 个白蜡来源地群体共380 份材料进行了遗传多样性分析,结果与前人相似[3,12]。12 对SSR 引物的PCI 指数较高,平均PIC 指数为0.532 9(0.119 7~0.750 9),PIC 越高说明引物多态性越好、稳定性越高。12 对多态性引物共产生51 个Na,每对引物主要从2.333~7.778 个等位基因中产生,平均频率为4.287 0 个;Ne为2.367 5,I为0.960 9,PIC 为0.532 9,H为0.576 0。以上结果表明,该12 对SSR 分子标记在收集的380 份白蜡种质资源间遗传多样性丰富。
遗传分化指数(Fst)可以用于评估群体间遗传分化的程度,Fst由F统计量演变而来,而F统计量主要有Fis、Fit和Fst3 种。Fis是整个群体中观察的杂合体频率相对于地方群体为理想群体的期望杂合体频率减少量的比值,数值为负则观察的杂合体频率高于期望杂合体频率;Fit是整个群体中观察的杂合体频率相对于整个群体为理想群体的期望杂合体频率减少量的比值,数值为负则观察的杂合体频率高于期望杂合体频率;Fst是地方群体为理想群体的期望杂合体频率相对于整个群体为理想群体的期望杂合体频率减少量的比值,依据Fst值的大小可将其划分为弱(0~0.05)、中(0.05~0.15)、高(0.15~0.25)和极高(≥0.25)4 个群体遗传分化等级水平[13]。在本研究中,计算的Fst值为0.021~0.236,平均值为0.095,表明所测白蜡群体间存在中等程度的遗传分化。基因流(Nm)是影响群体间遗传分化的重要因素。Nm<0.249、0.250 <Nm<0.990、Nm≥1.0 分别代表低、中、高3 个等级水平[14],并且当Nm>1时,基因流就能有效地防止近交引起的遗传分化和遗传漂变。本研究中Nm值为4.199,说明居群间基因交流程度很高,造成这种现象的原因可能与不同群体种质资源之间栽培引种导致的基因交流频率增加有关。该白蜡居群间的基因流动性大,居群间的基因分化程度低,推测可能是居群间较为频繁的基因流动在一定程度上阻止了白蜡居群间的遗传分化。除了基因流的阻碍作用,环境的选择同样是影响群体间遗传分化的重要因素,生境破碎化、生态系统越小、环境变异对不同白蜡居群的遗传结构影响越显著[15]。因此,白蜡居群间遗传分化可在一定程度上说明其对不同环境的适应程度,群体间的变异越大,说明该物种适应环境的能力越强[16],白蜡群体趋于中等程度的遗传分化反映了该物种具有一定的环境适应能力,但是容易受到不同环境的影响。
遗传多样性是生物多样性的重要组成部分,在遗传多样性分析的基础上与植物的表型、生理指标和组织结构相结合,能够在育种过程中得出更科学的结论[17]。衡量一个物种遗传多样性水平的主要指标是Shannon 信息指数(I)。本研究中,9 个来源地的白蜡居群的I为0.746~1.209,平均为0.961,在木犀科植物中远小于Chen 等[18]分析的四川盆地西南部锯叶桂OsmanthusserrulatusRehder 的10 个自然居群(SSR,I=1.492),但是远大于女贞Ligustrumlucidum(ISSR,I=0.2060~0.2953)[17]、绒毛白蜡FraxinusvelutinaTorr.(AFLP,I=0.300)[19]、流苏Chionanthusretusus(SRAP,I=0.207~0.245)[20]和连翘Forsythiasuspensa(ISSR,I=0.394±0.220)[21]等。这说明该白蜡群体在该水平上具有较高的遗传多样性,并且山东、北京和陕西的白蜡群体遗传多样性极其丰富,这3 个居群的遗传关系也较为接近(图4)。AMOVA 分析结果表明,9%的遗传变异来源于居群间,91%来自于居群内个体间。遗传多样性分析和AMOVA 分析结果与上述白蜡居群的遗传分化分析的研究结果一致。推测产生这种变异的主要原因是白蜡广泛分布于中国南北方各省区且多为栽培,不同地区的栽培品种可能来源于相同省份(地区),使不同居群间的白蜡基因交流频繁,遗传变异变小。因此,在白蜡遗传改良过程中,应以优树选择和单株改良为主,种源研究为辅。
根据SSR 分子标记分析的遗传距离系数,利用UPGMA 方法和PCoA 分析可以将本研究收集的9 个白蜡居群划分为3 类亚群。UPGMA 方法结果显示,380 份白蜡种质被分为3 个亚群,亚群1来自河北、辽宁、内蒙古、宁夏和山西居群,共7份,亚群2 来自甘肃、河北、辽宁、内蒙古、宁夏和陕西,共40 份,亚群3 来自北京、甘肃、河北、辽宁、内蒙古、宁夏、山东、山西和陕西,共333 份。其中,北京和山东两居群白蜡材料全部包含在亚群3 中,这与不同白蜡居群间UPGMA 聚类分析图分析基本一致,该亚群群体数量多,分布面积大,是主要的白蜡群体。3 类亚群遗传相似度较近,但因地理因素与国内其他地区群体有一定基因交流,因此群体之间有一定遗传差异,其他2 类亚群可作为补充进行单独保存和利用。
群体结构分析结果显示,来自不同地理分布的9 个白蜡居群在进化上相对独立,存在一定程度的遗传混合,遗传组分相对单一(图8),这与UPGMA 和PCoA 的结果基本一致(图3 和图6)。通常地理位置或地理环境对植物群体之间的遗传混合影响较大[13,22]。在本研究中,9 个居群的白蜡种质资源分别采自黄河流域、华北和东北。黄河流域具有丰富的水资源和植被资源,城镇化建设和退耕还林还草政策的实施使得该河流生态系统中人类活动较为普遍[23]。因此,白蜡9 个居群之间一定程度的遗传混合可能与黄河流域及周边地区的人类活动密切相关。经校对,选择的自然群体被分为3 个亚群,推测本研究中的9 个白蜡居群起源3 个基因库。
本研究利用SSR 分子标记技术对白蜡种质资源进行遗传多样性与群体结构的分析,但由于条件的制约,各居群的供试材料偏少,SSR 标记的数量也较少,缺乏对白蜡遗传多样性的全面综合分析。另外,没有利用其他分子标记技术进行检验,也没有应用形态学、细胞学和生物学标记相结合的方法进行比较,因此得出的结论不够全面。在后续研究中,可在我国适生分布区加大对白蜡资源的采集和保护力度,在开展种源试验时进一步开发多个分子标记,并在表型和分子水平上综合筛选出适宜栽培区域的良种,推进白蜡的育种进程,为更加科学合理地推广利用白蜡资源奠定基础。
4 结 论
综上所述,本研究利用SSR 分子标记分析了北方9 个较具代表性的白蜡居群的遗传多样性和群体结构,为白蜡种质资源的保护和利用提供了理论依据。本研究中,12 对SSR 引物在所有白蜡中都能进行扩增,平均PIC为0.532 9,多态性较好、稳定性较高;白蜡居群的平均Fis为0.016,平均Fit为0.091,显示杂合频率高,居群近交较多;白蜡居群的平均Fst为0.095,平均Nm为4.199,表明存在中等程度的遗传分化,居群间基因交流非常丰富;AMOVA 分析结果表明,9 个白蜡居群的遗传差异91%存在于个体间,是主要的变异来源;群体结构分析结果显示,9 个来自不同地理区域的白蜡居群中存在3 个不同的基因库,居群间在进化上相对独立,存在一定程度的遗传混合,遗传组分相对单一。在后续的白蜡育种工作及研究中,应重视优树选择和单株改良,以种源研究为辅,建立资源保护区,涵盖更多的白蜡种源类别,以适地适树为原则选育优良品种,为白蜡资源的进一步推广利用奠定基础。
