铬胁迫对油桐幼苗生理特性及叶片结构的影响
2023-07-26杨昕悦左文中张帆航米小琴谭晓风李树战李乐生
杨昕悦,左文中,张帆航,米小琴,谭晓风,李树战,李乐生,李 泽
(1.中南林业科技大学 a.经济林培育与保护教育部重点实验室;b.湖南省南方丘陵山地生态经济林产业工程技术研究中心;c.湖南省“一带一路”热带干旱经济林国际联合研究中心,湖南 长沙 410004;2.湘西自治州森林生态研究实验站,湖南 永顺 416700;3.武冈市乐生种养农民专业合作社,湖南 武冈 422409)
铬是常见的工业金属原料,具有长期性、隐匿性、难消逝和不可逆等特点[1]。铬在土壤中的常见形式为Cr3+和Cr6+[2],主要以Cr3+的形式存在[3]。随着经济全球化进程的加快,铬被广泛应用于化工、冶金和机械制造等行业,在环境中的排放速度也随之增加。经过冶炼、电镀等加工的工业废水用于灌溉农田会引起重金属铬污染[4],铬(Cr)污染正日益对环境构成严重威胁,成为对生物群的主要健康危害[5]。王娜娜等[6]研究桃树对铬胁迫的响应中发现,随着铬胁迫程度的加剧,桃树光合系统受到破坏,阻碍了PS Ⅱ电子传递过程,导致桃树光合作用减弱,干物质积累减少。Adhikari等[7]的研究表明,铬胁迫下,玉米的生长发育受到抑制,其株高和生物量都显著降低。Ahmad 等[8]通过研究铬胁迫对甜菜的影响发现铬影响其光合作用,降低了甜菜植株有机物的积累,阻碍其生长;铬胁迫可能导致叶绿体的超微结构改变,抑制或降解叶绿素的酶活性升高,造成光合色素减少。同时,铬胁迫会降低抗氧化酶活性,使细胞内氧化物积累,产生氧化胁迫,导致丙二醛(MDA)含量增加,破坏细胞膜结构。不同植物对胁迫的反应有所不同,周希琴等[9]的研究中发现铬胁迫下木麻黄种子中SOD 含量先增后减,CAT、POD 含量增加,这是由于高浓度铬引起的膜及酶系统破坏使其代谢紊乱。Nascimento等[10]对可可豆的研究中发现,铬胁迫造成过量活性氧(Reactive oxygen species,ROS)积累,使叶绿体遭到破坏,细胞壁破裂,降低了可可叶片的光合作用,损伤膜结构,还破坏了叶片和根细胞的线粒体结构,严重影响了可可的生长发育。同时,在Adhikari 等[7]和Nascimento 等[10]的研究中均发现植物对铬的积累主要在根部,这是一种植物对金属的排斥反应,即植物阻止有毒的重金属向上部运输,以降低对植物生长发育的危害。
油桐Verniciafordii是大戟科油桐属的落叶经济树种,与油茶Camelliaoleifera、核桃Juglans regia和乌桕Sapiumsebiferum并称我国四大木本油料树种。从油桐种子中提取的桐油是制造绿色、环保和无污染涂料的优质原料,具有干燥快、附着性强、富有光泽、耐酸碱和耐高温等优良特性,具有广泛的用途[11]。桐油可用作建筑材料的防腐、防锈涂料,也可以用于制作肥皂、农药和医用呕吐剂等[12]。随着人们环境意识增强,桐油作为制造环保型油漆最适宜的原料之一,其需求量正日益增长;同时,油桐产业的发展对于带动我国贫困地区的经济发展有极大作用,对于乡村振兴的实施具有重要的战略意义[13]。此外,油桐是一种潜在的生物质能源树种,在当今国际化石油能源紧张的背景下,可能会成为缓解世界能源紧张的理想材料之一,具有广阔的发展前景[14]。然而,国内外现在对油桐的研究主要集中在如何提高油桐产量和种子含油率等经济效益上,暂时还未见关于油桐对土壤铬胁迫响应等方面的报道。湖南省矿产资源丰富,近年来,梁玉峰[15]监测到工业铬排放呈上升趋势,且多数排放的铬富集在土壤中,可能会对植物的正常生长造成不利影响。一方面,土壤铬含量的增加会导致农林业用地减少;另一方面湖南省作为全国油桐的主产区,土壤铬污染可能会阻碍油桐的生长发育,导致油桐产量降低,造成极大的经济损失。因此,研究油桐对铬胁迫的生理响应以及探究不同部位对铬的富集程度,在油桐对重金属的修复及产业发展等方面具有重要的实践推广价值。
本研究通过盆栽试验模拟大田铬污染的土壤环境条件,研究了4 种铬浓度对油桐幼苗光合生理特性、叶片解剖结构以及不同器官中的铬含量的影响,明确了油桐吸收铬元素后的富集部位,可为今后油桐在铬污染环境中的栽培及对铬污染土壤修复提供参考依据。
1 材料与方法
1.1 试验材料
试验材料‘华桐1 号’为当年生的实生苗,2018 年11 月在湖南湘西永顺县青坪镇国家油桐种质资源保存库采集成熟的果实,果实去果皮后在室内阴干,然后种子浸入0.3%的高锰酸钾中消毒40 min 后沙藏备用。
1.2 试验方法
于2019 年4—10 月在中南林业科技大学树木楼楼顶进行试验。4 月1 日选择沙藏露白后长势一致的油桐种子播种于30 cm×30 cm×50 cm的塑料盆中,基质为蛭石∶珍珠岩∶黄土=1∶1∶3(V∶V∶V)。正常生长2 个月后于6 月1 日添加铬溶液处理,以不添加Cr3+作为对照,添加不同浓度氯化铬(CrCl3+·6H2O)水溶液作为处理,按照盆中土壤质量计算,在每千克土壤中分别施加50、100、200 和500 mg Cr3+水溶液,盆下方放一个托盘,流出来少量的液体第2 天继续浇到盆子中,分别用C50、C100、C200 和C500 表示。每个处理18 盆,总共90 盆植株。分别在30 和60 d 后测定各项指标,试验期间其他水肥条件正常管理。
1.3 光合生理指标的测定
1.3.1 光合生理特征参数的测定
于2019 年7 月初及8 月初的晴天9:00—11:00(最高气温36 ℃),选取成熟叶片,测定叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)等参数[16],光照强度统一设定为油桐幼苗的饱和光合有效辐射1 500 μmol·m·s-1[17],CO2由小钢瓶提供,浓度统一设定为400 mg/m3,相对湿度为70%。气孔限制值(Ls)根据Farquhar 和Sharkey 的研究计算为1-Ci/Ca(Ca为大气中CO2浓度)[18];水分利用效率(WUE)=Pn/Tr。
1.3.2 叶绿素荧光参数测定
叶绿素荧光参数的测定用6400XT 光合仪(LI-COR,USA)荧光叶室测定。测定当天白天在每个处理选取成熟健康的叶片,挂好标签标记,在21:00—23:00 测定初始荧光F0,然后施加脉冲为7 200 μmol·mol-2·s-1的光强下0.8 s,测得暗适应下最大荧光Fm及最大光化学效率Fv/Fm[19]。
1.3.3 叶绿素含量的测定
采用成熟健康的鲜叶,去除主脉后称量0.2 g叶片剪成细丝,浸泡在15 mL丙酮乙醇(V∶V=1∶1)溶液中。在黑暗中放置24 h 后在4 ℃下冰箱中待叶子中叶绿素溶于提取液后,用分光光度计(Specord 50 Plus)记录吸光度,分别在波长为663 和645 nm 时测定OD 值,最后根据如下公示计算:
Chl a(mg·dm-2)=12.72A663-2.59A645,
Chl b(mg·dm-2)=22.88A645-4.68A663,
Chl a+b(mg·dm-2)=Chl a+Chl b。
1.4 干物质测定
在生理生化指标全部测定完成后,用分析天平(0.1 mg 精度)测量叶、叶柄、茎和根(称质量前清洗的根)的鲜质量,再放入烘箱中105 ℃下杀青30 min,65 ℃下烘72 h 直至恒质量后称取干质量。叶片含水率=(鲜质量-干质量)/鲜质量×100%。
1.5 生理生化指标与方法
施加铬溶液30 d 后,随机选取油桐幼苗由上往下数第3~5 片叶片进行第一次取样,60 d时第二次取样。用万分之一的电子天平精确称取0.5 g,用锡箔纸包裹,浸入液氮冷冻30 min 后放进冰箱中-80 ℃下储存,每个处理18 份样。超氧化物歧化酶(SOD)、过氧化物酶(POD)使用南京建成公司的试剂盒进行POD、SOD 的测定;丙二醛(MDA)活性采用硫代巴比妥酸显色法[20];采摘鲜样,使用电导率仪测定叶片相对电导率;可溶性糖含量采用蒽酮比色法测定;可溶性蛋白含量采用考马斯亮蓝法测定。
1.6 叶片气孔开度测定
分别于第30 天和第60 天上午9:00 采摘新鲜叶片,在叶背面涂一层纤维素胶液,凝固后轻轻撕下,置于滴水的载玻片上,放在显微镜下观察拍照。统计气孔数量和开闭情况。
1.7 叶片解剖结构观察
从新鲜植物成熟叶片的中下部靠近主脉处切取0.5 cm×0.5 cm 的组织。每组处理采集2 个材料。切下后立刻放入FAA(福尔马林∶冰乙酸∶乙醇=1∶1∶18)中固定,再放入冰箱中4 ℃下保存24 h。接下来经过一系列浓度梯度(70%、85%、95%和100%)的酒精脱水,用石蜡进行包埋,切片机切片,厚度为8 µm,每个样品3 张。番红固绿染色,中性树脂封片,倒置显微镜观察。所用公式如下:
叶片组织细胞结构紧密度(CTR)=栅栏组织厚度/叶片厚度×100%;
叶片组织细胞结构疏松度(SR)=海绵组织厚度/叶片厚度×100%。
1.8 铬含量的测定
待所有取样工作完成后,将不同处理的油桐幼苗移出并进行盆栽,按叶、茎、根、土壤分别称取鲜质量。包入油纸后放进烘箱中105 ℃下干燥30 min,然后在65 ℃下干燥至恒质量。将处理好的干样送交成都栢晖检测技术服务有限公司进行铬元素测定。
将干样风干过筛。土壤样本取0.5~1.0 g,油桐根、茎、叶样本均取0.2 g,分别置于50 mL消煮管中(勿将样品黏附在瓶颈上)。先滴入少些水湿润样品,然后加8 mL 浓硫酸,2 mL 72 %的高氯酸,于石墨炉上400 ℃消煮至澄清(2 h 左右),转移至50 mL 容量瓶定容,备用。空白溶液除不加试样外,应用的试剂和操作步骤同上。将标准溶液、试剂空白和样本溶液过滤后,使用ICP-oes 测定。
1.9 数据处理与分析
采用Excel 2007 软件对数据进行处理并作图;采用SPSS 22.0 软件进行单因素方差分析和差异显著性分析。表中和图中的结果为平均值±标准差。所有数据每次均测定3 次重复。
2 结果与分析
2.1 不同浓度的铬含量对油桐幼苗生理特性的影响
2.1.1 不同浓度的铬含量对油桐幼苗光合参数及叶片含水率的影响
由图1 可以看出,随着铬浓度的升高,各处理组油桐幼苗叶片的Pn、Gs、Tr都呈下降趋势。处理时长为30 和60 d 时,C50 处理组油桐叶片Pn相比对照略有降低,但差异不显著(P>0.05);在30 d 时,C100、C200 和C500 处理组分别比对照降低了31.04%、38.24%和54.25%,差异显著(P<0.05);在60 d 时,C100、C200 和C500处理组分别比对照降低了37.15%、41.03% 和89.02%(图1A),差异显著(P<0.05)。Gs和Tr的变化趋势与Pn基本一致,均随着铬浓度的增加及胁迫时间的延长而逐渐降低。在60 d 时,C100、C200 和C500 处理组相比对照Gs分别降低了25.64%、34.29%和87.02%(图1B);Tr分别降低了33.40%、40.75%和89.45%(图1C),差异显著(P<0.05)。在30 d 时,Ci随着铬浓度的增加逐渐降低;相比对照,在60 d 时,各处理组Ci的值稍有升高,变化无明显规律(图1D);在30 d 时,随着铬浓度增加,WUE 呈上升趋势,C50、C100、C200 和C500 处理组相比于对照分别升高了10.59%、24.04%、33.07%和77.13%(图1E),差异显著(P<0.05)。在60 d 时,C50、C100、C200 和C500 处理组与对照无显著性差异(P>0.05)。随着铬浓度的增加,油桐幼苗的叶片含水率呈先下降后上升的趋势,在C50 组达到最低值,相比对照降低了6.75%,差异显著(P<0.05);在C500 组达到最高值,相比对照升高1.43%(图1F),差异显著(P<0.05)。
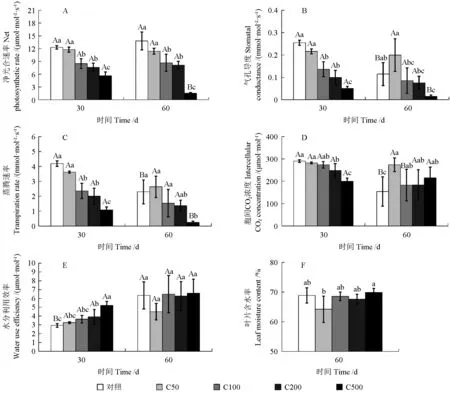
图1 不同浓度的铬处理对油桐幼苗叶片光合参数及叶片含水率的影响Fig.1 Effects of different Cr3+ concentrations on the photosynthetic parameters and leaf water content of tung tree leaves
2.1.2 不同浓度的铬含量对油桐幼苗叶绿素荧光参数的影响
由图2 可以看出,铬胁迫30 d 时,与对照相比,随着铬浓度的增大,C50、C100、C200 和C500 处理组的Fm的值升高,但差异不显著(P>0.05);在60 d 时,C500 处理组的Fm比对照降低了16.40%,差异显著(P<0.05),其他处理与对照差异不显著(P>0.05)。Fv/Fm随着铬浓度的增加整体呈降低趋势,在30 d 时C50 和C100处理组与对照差异不显著(P>0.05),C200和C500 处理组与对照相比分别降低了1.37%和1.34%,差异显著(P<0.05);在60 d 时C200和C500 处理组与对照相比分别降低了2.69%和1.10%,差异显著(P<0.05)。
2.1.3 不同浓度的铬含量对油桐幼苗叶绿素含量的影响
由表1 可以看出,随着铬浓度增加,油桐幼苗叶片的Chl a、Chl b、Chl (a+b)含量总体呈下降趋势。在30 d 时,C50 的Chl (a+b)含量略低于对照,差异不明显(P>0.05),C100、C200 和C500处理组相比于对照分别降低了23.03%、36.15%和22.16%,差异显著(P<0.05)。C500 组的叶绿素含量始终最低,在60 d 时 Chl a、Chl b、Chl (a+b)相比于对照分别低了23.19%、27.06%和24.35%,差异显著(P<0.05)。
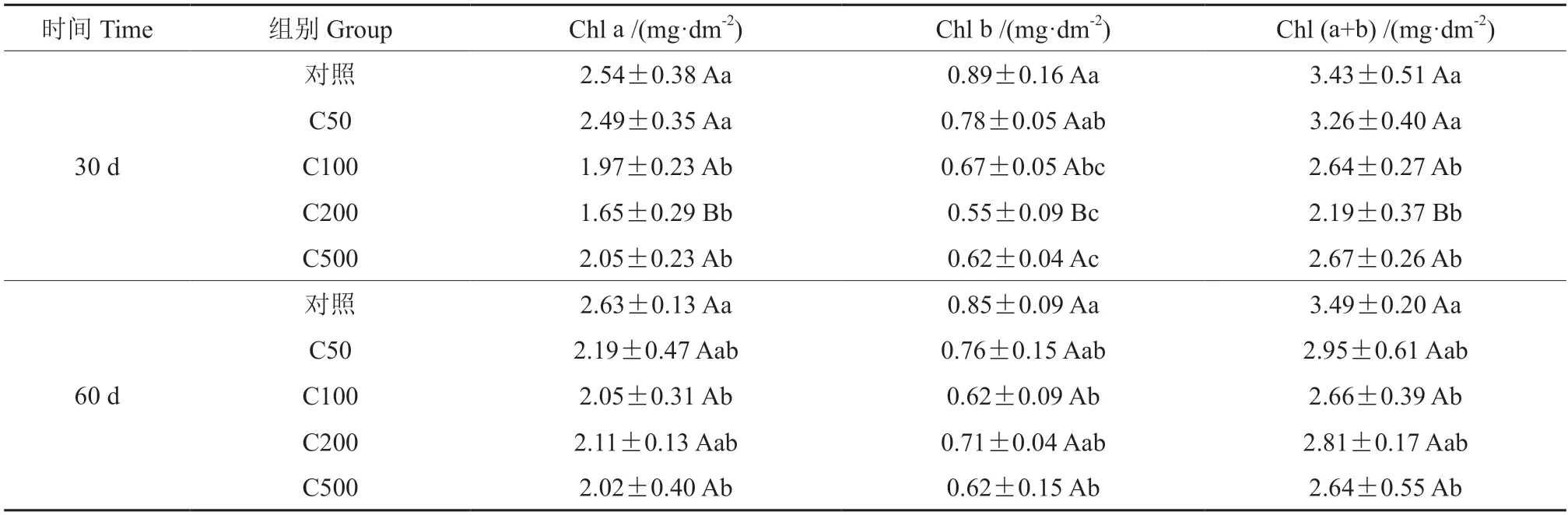
表1 不同浓度的铬处理对油桐幼苗叶片叶绿色含量的影响†Table 1 Effects of different Cr3+ concentrations on the chlorophyll content of tung tree leaves
2.2 不同浓度的铬含量对油桐幼苗生理生化指标的影响
由图3 可以看出,在油桐幼苗叶片中,C50、C100、C200 和C500 处理组的MDA 含量在30 d时与对照相比差异并不显著(P>0.05);在60 d时,MDA 含量随着土壤铬浓度增加及胁迫时间的延长逐渐升高,C50、C100、C200 和C500 处理组油桐幼苗叶片中MDA 含量分别比对照上升了14.14%、18.09%、10.67% 和47.18%,差异显著(P<0.05)。在30 d 时,C50、C100、C200 和C500 处理组相对电导率比对照分别降低了29.36%、45.34%、32.89% 和41.91%,差异显著(P<0.05);在60 d 时,相对电导率随着土壤铬浓度升高呈先降低后升高的趋势,C50 组达到最低值,比对照降低了17.44%,C500组达到最高值,比对照升高了5.90%,差异显著(P<0.05)。
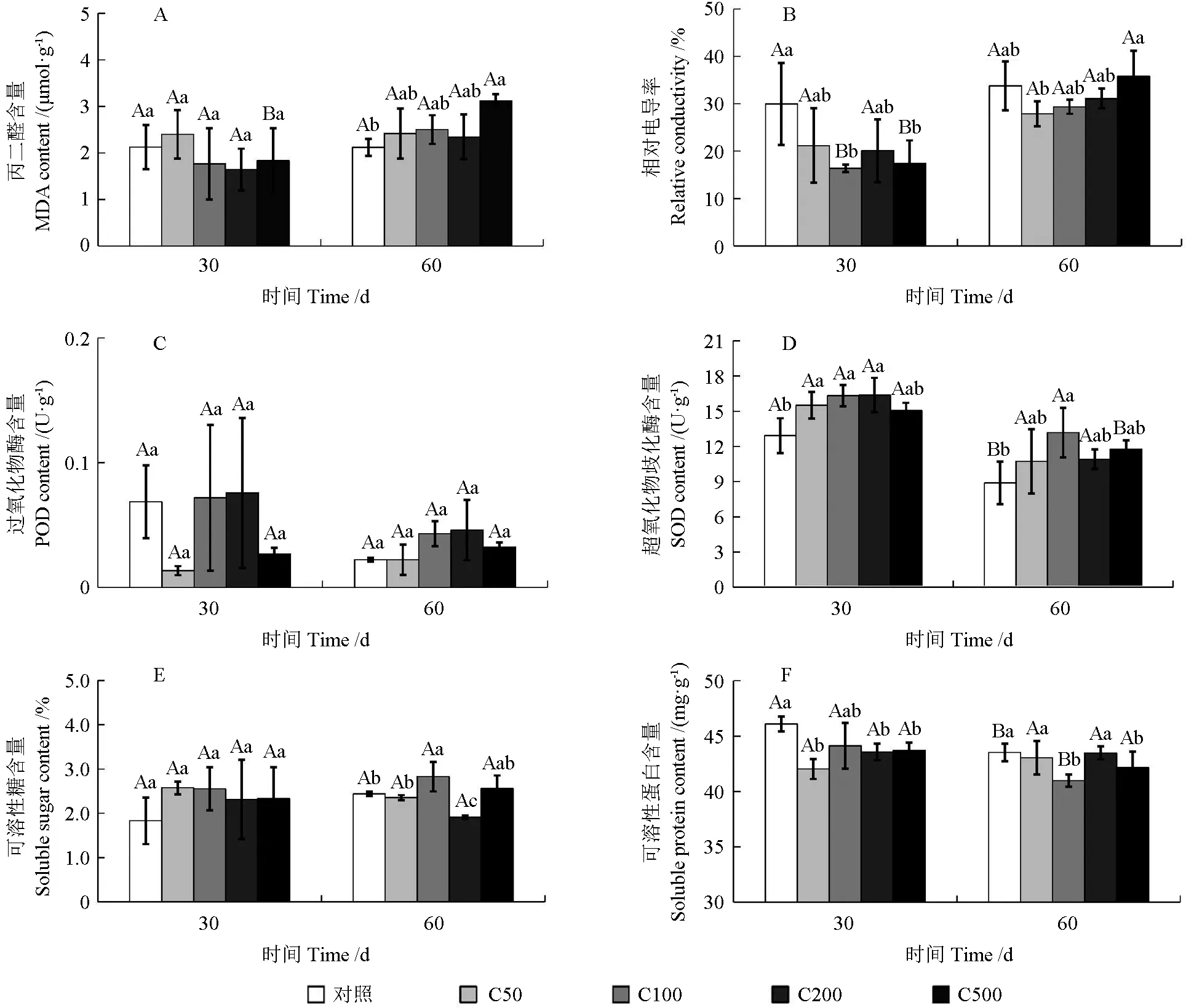
图3 不同浓度的铬处理对油桐幼苗叶片生理生化指标的影响Fig.3 Effects of different Cr3+ concentrations on the physiological and biochemical indexes of tung tree leaves
随着铬浓度的增加,铬胁迫对油桐幼苗叶片POD 含量的影响并不显著(P>0.05)(图3C)。SOD 含量随着土壤铬浓度增加呈先上升后下降的趋势,但C50、C100、C200 和C500 处理组均高于对照。在30 d 时,C200 组达到最大值,与对照相比升高了26.72%,差异显著(P<0.05);在60 d 时,C100 组达到最大值,比对照升高了48.17%,差异显著(P<0.05)(图3D)。
在30 d 时,随着铬浓度增大,C50、C100、C200 和C500 处理组的可溶性糖含量较对照均升高但差异不明显(P>0.05)。在60 d 时,C100、C500 处理组的油桐幼苗叶片中可溶性糖含量显著高于对照,分别为增加了15.81%和5.03%(P<0.05);C200 与对照相比降低了21.75%,差异显著(P<0.05)(图3E)。在30 d 时,随着土壤铬浓度增加,C50、C100、C200 和C500处理组的可溶性蛋白含量与对照相比分别下降了8.83%、4.28%、5.48% 和5.18%,差异显著(P<0.05)。在60 d 时,C100、C500 处理组与对照相比分别降低了5.84%和3.13%,差异显著(P<0.05),C50 和C200 与对照相比无显著差异(P>0.05,图3F)。
2.3 不同浓度的铬含量对油桐幼苗叶气孔开度的影响
由表2 和图4 可以看出,在30 d 时,随着土壤铬浓度增大,气孔打开数、打开数/总数呈下降趋势,C50、C00、C200 和C500 处理组的气孔打开数与对照相比分别下降34.74%、41.85%、48.23%和49.64%,有显著差异(P<0.05)。在60 d 时,气孔打开数呈先上升后下降的趋势,在C100 组达到最大,比对照高28.05%;C500 气孔打开数/总数最小,比对照降低了35.78%,差异显著(P<0.05)。
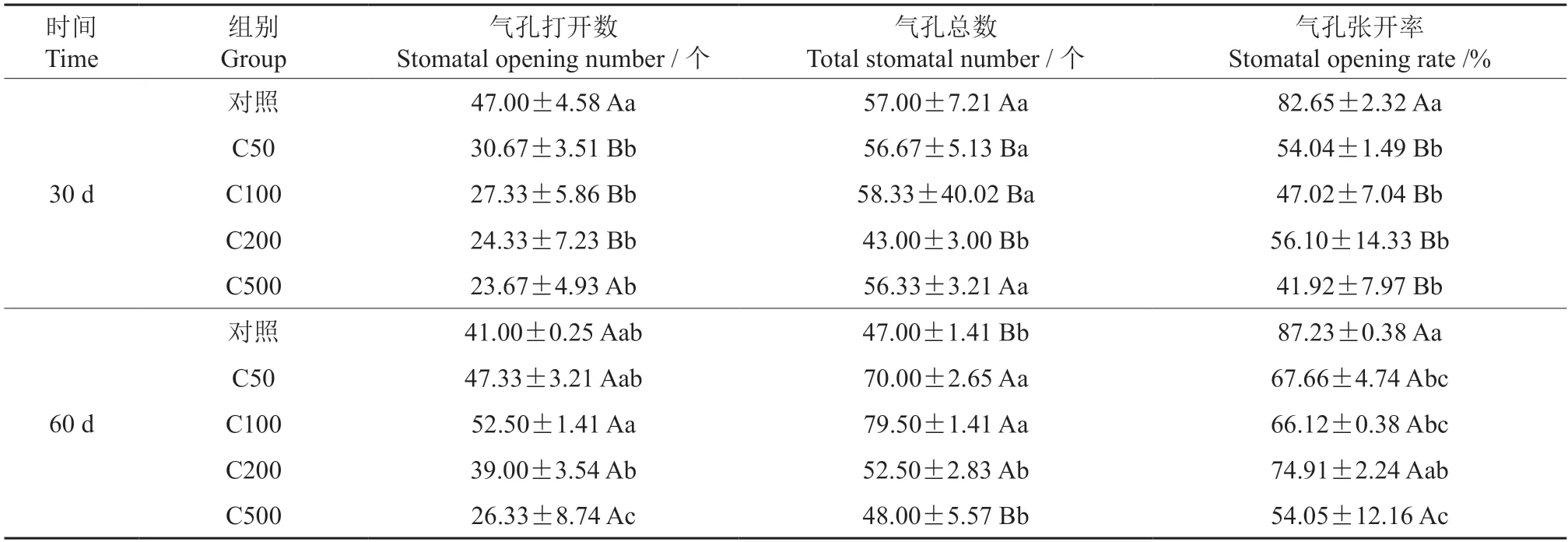
表2 不同浓度的铬处理下油桐幼苗叶表面气孔的统计Table 2 Statistics of stomata on the leaf surface of tung tree seedlings under different Cr3+ concentrations
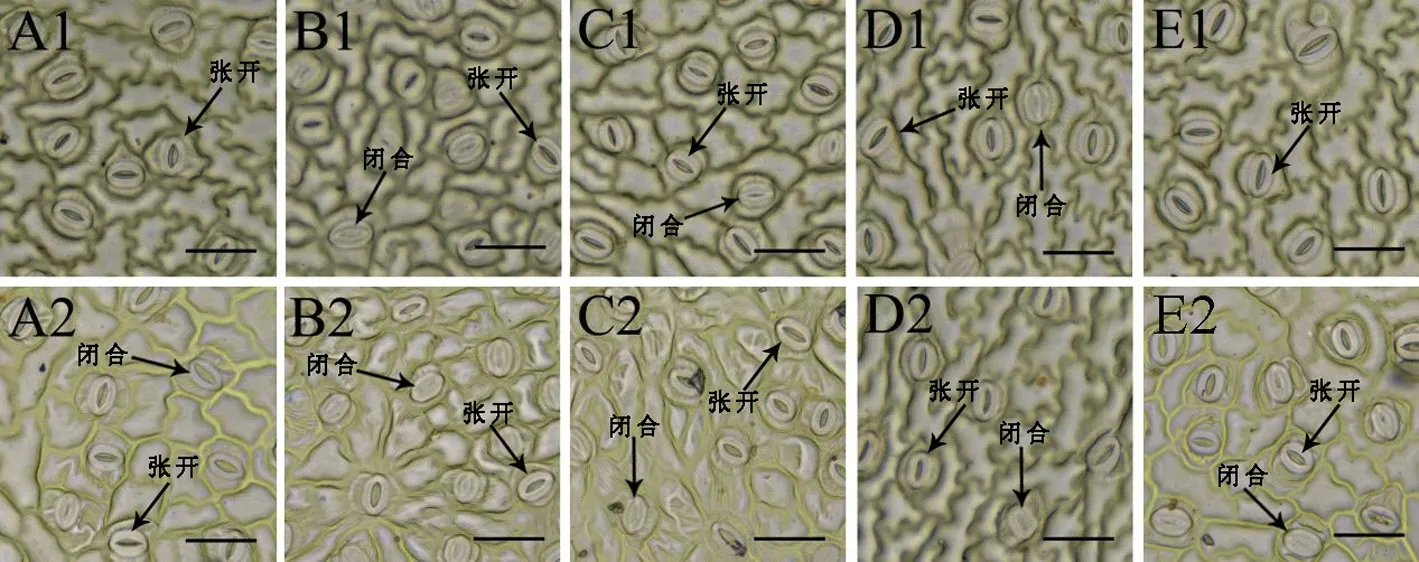
图4 铬胁迫对油桐幼苗叶表面气孔的影响Fig.4 Stomata on the leaf surface of tung tree seedlings under chromium stress
2.4 不同浓度的铬含量对油桐幼苗叶片解剖结构的影响
由表3 和图5 可以看出,随着铬胁迫的加重,油桐幼苗叶片的叶片厚度、上表皮厚度、下表皮厚度、海绵组织厚度和叶片组织细胞结构疏松度(SR)在30 d 时呈下降趋势,C50、C00、C200和C500 处理组的叶片厚度与对照相比分别下降了15.00%、15.85%、11.56% 和14.15%,差异显著(P<0.05);4 个组的SR 与对照相比分别下降了2.72%、3.70%、9.41%和3.87%,差异显著(P<0.05)。叶片组织细胞结构紧密度(CTR)呈先上升后下降的趋势,在C100 组达到最大值,相比对照增加了14.32%,差异显著(P<0.05)。
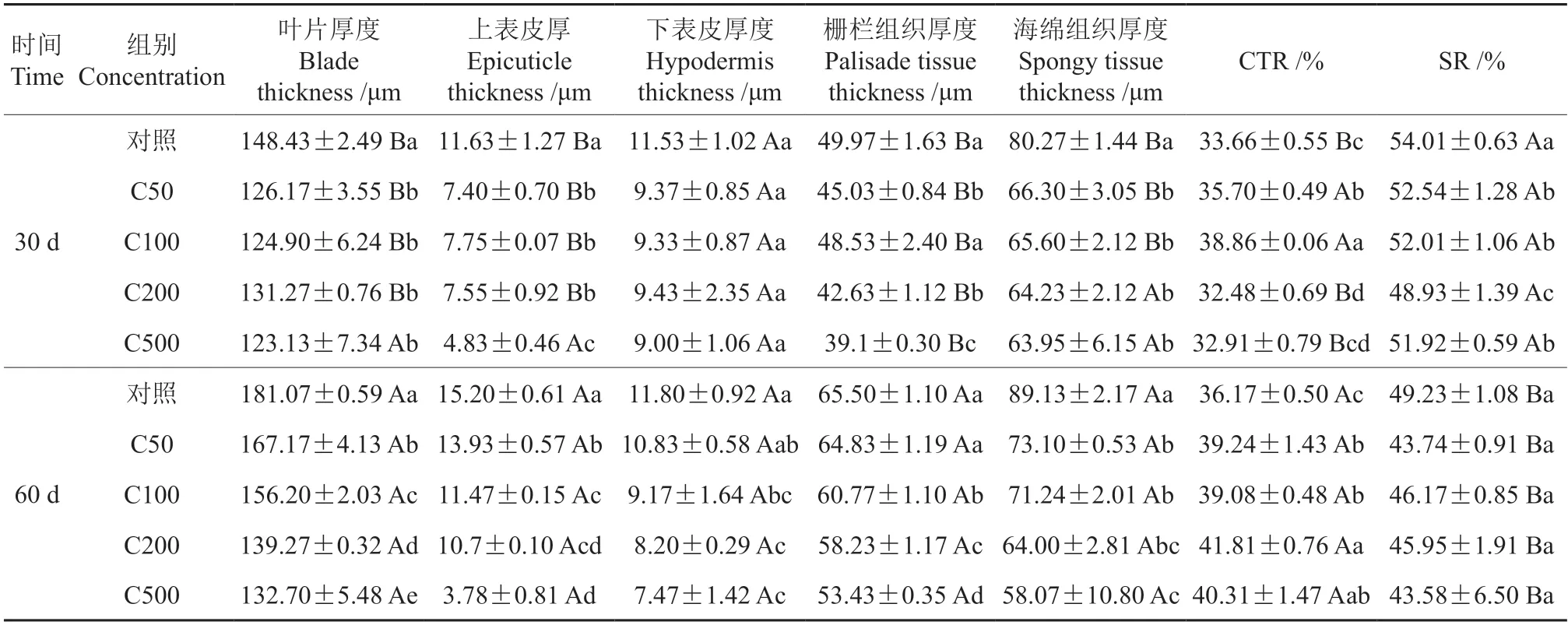
表3 不同浓度的铬处理对油桐叶片叶片解剖结构参数的影响Table 3 Effects of different Cr3+ concentrations on the leaf anatomical structure parameters of tung tree seedlings
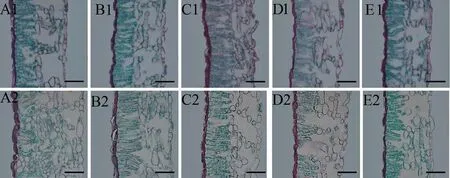
图5 不同浓度的铬处理下油桐幼苗的叶片解剖结构Fig.5 Leaf anatomical structure of tung tree seedlings under chromium stress
在60 d 时,随着土壤铬含量的升高与胁迫时间的延长,油桐幼苗叶片的叶片厚度的降幅更明显,C50、C00、C200 和C500 组相比对照依次降低了7.68%、13.74%、23.08%和26.71%,差异显著(P<0.05);但与对照相比,4 个组的SR 没有显著性差异(P>0.05)。
2.5 不同浓度的铬胁迫下油桐幼苗不同器官和土壤中铬的含量
由图6 可以看出,随着铬浓度的增加,油桐幼苗各部位及土壤金属铬的积累量在各处理组中均呈上升趋势。随着铬处理浓度的增加,在叶片中的铬含量在C50、C100、C200 和C500 处理下分别比对照增加了104.81%、170.29%、296.06%和1 260.72%,差异显著(P<0.05);在茎中的铬含量在C50、C100、C200 和C500 处理下分别比对照增加了260.19%、314.78%、410.28%和2 979.90%,差异显著(P<0.05)。在油桐幼苗根部,C500 处理下铬含量最高,比对照增加了1 942.99%。油桐幼苗不同部位中,各处理组均是在根部的铬含量最高,分别是叶中的61.51、22.30、61.77、64.18 和38.25 倍。
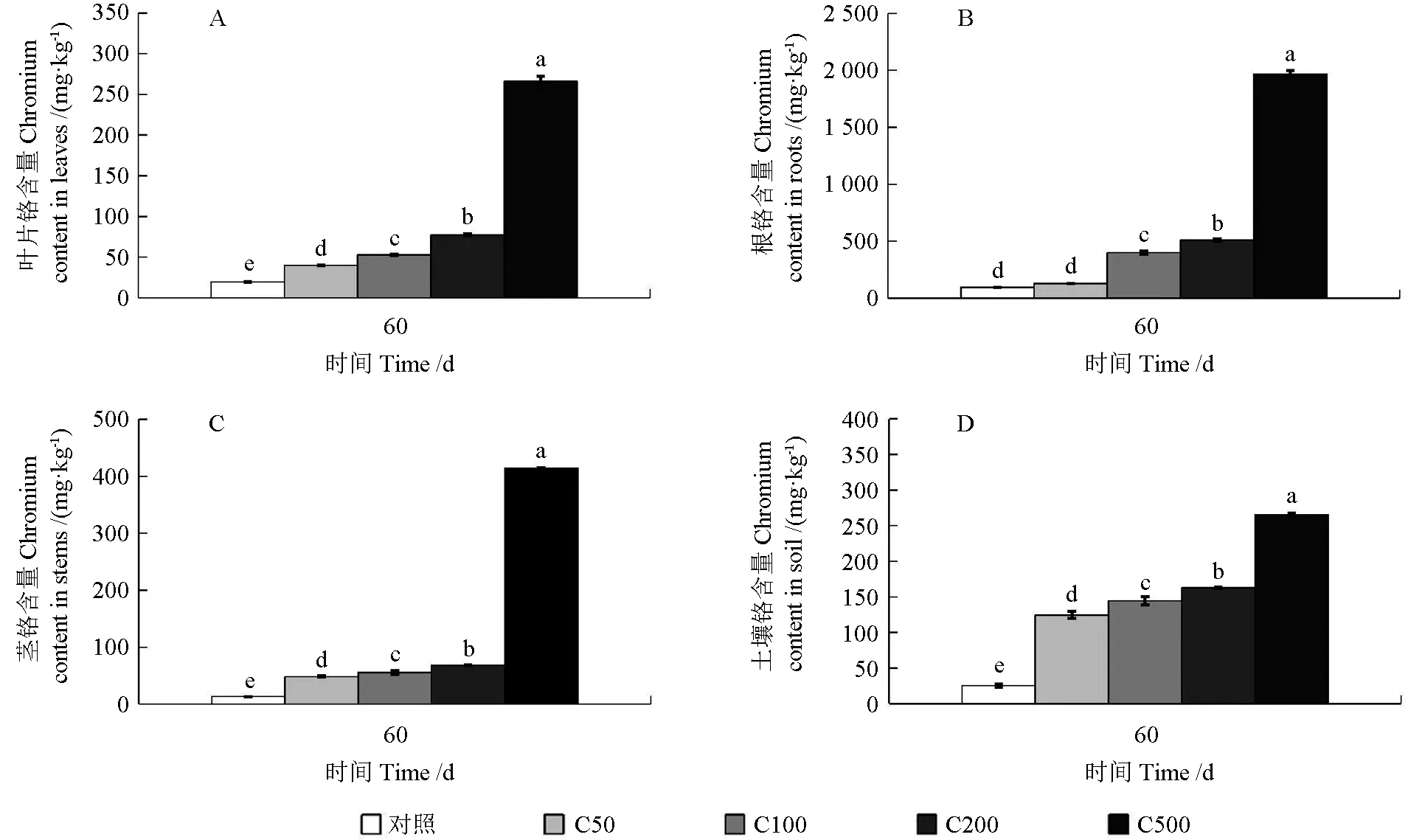
图6 油桐幼苗不同器官和土壤中铬的含量Fig.6 Chromium contents in different organs of tung tree seedlings and soil
3 讨 论
3.1 铬胁迫对油桐幼苗生理生化特性的影响
Wakeel 等[21]的研究表明铬胁迫对植物细胞有毒害作用,会导致脂质过氧化和膜通透性水平改变。MDA 是膜脂过氧化的产物,当植物细胞处于逆境时机体就会产生MDA。在30 d 时,C50、C100、C200 和C500 处理组与对照的MDA含量差异均不明显。随着胁迫时间增加,在60 d时,MDA 含量显著上升,造成油桐幼苗膜脂损伤,并且随着土壤铬浓度升高而加剧。这可能是因为短期内重金属铬的影响较小,未能明显地体现出来,而在长期胁迫下,油桐幼苗受到的影响越来越大,进而有所表现。相对电导率也是表示植物抗性的指标之一,可以代表细胞膜的调控作用。30 d 时,C50、C100、C200 和C500 处理组的相对电导率显著低于对照组,在60 d 时呈先降低后升高的趋势,C500 相对电导率明显高于对照。这可能是因为在短期内植物对外界胁迫有一定的抵抗能力,而长期高浓度铬胁迫下,植物的结构和功能受到影响,抗性降低。ROS 即活性氧,是衍生自分子氧的化学活性物质,可能会对需氧生物造成损害[22]。由于重金属与叶绿体和线粒体膜电子传递活性的相互作用,植物处于有毒的重金属环境中会导致ROS 含量增加。ROS 可以破坏细胞膜的氧化还原状态,从而破坏细胞膜,导致离子泄漏[23-24],从而导致电导率增大。可溶性糖、可溶性蛋白作为细胞渗透性的保护物质,其含量可表示植物细胞在逆境中的适应能力。在30 d 时,外施铬的处理组可溶性蛋白含量比对照低且存在显著性,在60 d 时略低于对照。可能是因为铬胁迫对于油桐幼苗可溶性糖、可溶性蛋白的积累略有影响,但影响不大。
POD 与SOD 是植物体内重要的抗氧化酶。POD 是过氧化物酶,可以将细胞氧化还原作用时产生的毒性物质分解。超氧化物歧化酶SOD 是对抗ROS 的主要手段之一[25],可以清除自由基,对抗氧化作用并及时修复受损细胞。研究表明,铬胁迫对油桐叶片的POD 含量无明显影响,但对SOD 含量产生影响,这可能是因为金属铬没有造成油桐机体内过氧化物的形成,但产生了超氧自由基。相比对照,C50 和C100 处理组内SOD 含量呈上升趋势,说明随着土壤铬含量的增加,油桐幼苗受到氧化胁迫影响,产生一种保护性应激反应,有助于清除由胁迫产生的过多自由基[26]。植物内产生更多的SOD 能够增强抗氧化的能力,但在高浓度C500 处理组中,植物受到的胁迫影响较大,植物受害更为严重,加剧了膜脂过氧化作用引起膜及酶系统的破坏使其代谢紊乱,合成SOD 的能力有所下降,这与张凤琴等[26]关于木榄幼苗的研究和万永吉等[27]关于秋茄种苗的研究结果相似。
3.2 铬胁迫对油桐幼苗光合生理特性的影响
光合作用是植物生长发育的基础,为植物的生长发育提供物质与能量。叶绿素是植物光合作用的基础,叶绿素含量越高,植物光合作用越强。本试验外施铬的处理组中,油桐幼苗叶片叶绿素含量及光合速率明显降低。Assche 等[28]的研究表明叶绿素合成系统和叶绿素酶活性受到高浓度铬的影响;Vajpayee 等[29]通过试验发现,Cr 能够降解参与叶绿素生物合成的重要酶(δ-氨基乙酰丙酸脱水酶),从而降低叶绿素的含量。栅栏组织的厚度也与油桐幼苗光合作用相关。油桐幼苗叶片栅栏组织厚度有明显的下降,并且在光合作用中表现出相同的趋势。油桐幼苗的净光合速率随土壤铬浓度的增加而降低,由于铬胁迫产生过量ROS,破坏了叶绿体结构,使光合色素减少,从而抑制了光合作用,阻碍了植物的生长发育。Nascimento 等[10]的研究表明在铬胁迫下植物类囊体薄膜被分解,叶绿体遭到破坏,导致植物光合作用减弱。在外界环境胁迫下,光合作用的限制因子可分为气孔限制和非气孔限制,当Ci与Gs同时下降时,Pn下降主要是由气孔限制引起的,如果光合速率的降低伴随着Ci升高,光合作用的主要限制因素就是非气孔因素[18]。30 d 时,Ci与气孔导度同时下降,表明为气孔因素;第60 天时,C50 的Pn低于对照组而Ci高于对照组,并且C50的气孔开度小于对照组,因此推断可能是非气孔限制,这与叶肉细胞的光合活性有关,过量的ROS 导致光合机构遭到了破坏。
Fv/Fm的变化是判断植物叶片是否受到光抑制的重要依据。一般地,植物在没有光呼吸的条件下,Fv/Fm为0.80~0.83。Fv/Fm呈下降趋势,但差异并不大(图2B),且始终处于0.80~0.83,说明金属铬对于油桐幼苗PS Ⅱ最大光能转化效率略有影响但影响不大。
WUE 与光合速率和蒸腾速率有关。本试验中,30 d 时,随着土壤铬浓度升高,WUE 显著上升。60 d 时,各处理组WUE 与对照相比无显著差异,可能是长时间的铬胁迫降低了油桐幼苗叶片的蒸腾作用,具体原因有待进一步研究。
气孔的开闭情况直接影响到油桐幼苗的光合作用。30 d 时,从打开的气孔数量来看,对照明显高于其他4 个外施铬的处理组。而且,随土壤铬浓度升高,打开的气孔数呈下降趋势,这与光合速率和气孔导度的趋势相同,说明铬胁迫阻碍了叶片气孔的开闭,油桐受胁迫越严重,气孔关闭越多。
3.3 不同浓度的铬胁迫下油桐幼苗不同器官和土壤中铬的含量
油桐的根部吸收了大部分的铬,并且铬在油桐幼苗中的分配表现为根>茎>叶。Singh 等[30]的研究表明植物根部积累的铬比其他组织多10~100 倍。Rascio 等[31]研究发现植物根细胞通过与氨基酸、有机酸或液泡形成复合物来解毒重金属,以此保护叶片组织。Nascimento 等[10]对可可豆铬胁迫的研究中发现,可可豆根的木质部细胞靠近细胞壁的部位积聚了电极质物质,表明铬被根部吸收之后通过木质部被运输到植物的地上部分,但地上部分铬含量远小于根部,这可能是可可豆对重金属铬的排斥作用所造成的。植物对重金属的排斥作用是产生耐受性的一种方式,即植物让金属留在根部,减少其向上部运输,以免对上部营养器官或生殖器官造成危害[32]。Gadd[33]对印度芥菜的镉胁迫试验中发现芥菜根部镉含量显著高于地上部分,说明印度芥菜对重金属Cd 具有排斥性。而本试验中,油桐幼苗中地下部分Cr浓度显著高于地上部分,说明Cr 离子在油桐幼苗植物体内难以迁移,表现出对Cr 的排斥性。在植物修复土壤重金属技术中,利用植物根系分解、沉淀、螯合和氧化还原等多种理化过程将重金属固定在根际中,使其在土壤中的迁移和扩散能力减弱,以缓解重金属对环境的污染程度的方法称为植物稳定修复[34]。油桐幼苗在低浓度(C100)铬土壤中表现出较好的耐受性,在高浓度(C500)铬土壤中表现出对Cr 较强的富集能力,油桐幼苗根部积累的铬含量达1 966.10 mg·kg-1。但是,本研究并未对其富集系数及转移系数做具体测定。后续研究中有必要进一步开展油桐幼苗根系及地上部分对重金属铬的富集能力及根部固定铬的方式及原理的研究,为降低土壤铬浓度和修复铬污染土壤提供理论依据。
4 结 论
综上所述,土壤铬浓度小于或等于100 mg·kg-1的处理组中油桐幼苗耐受性较好,受到铬的毒害现象不明显;土壤铬浓度大于等于200 mg·kg-1的处理组受到明显的毒害,细胞膜结构受到破坏、光合作用明显减弱、生长量与物质积累量减少,且毒害现象随着铬浓度的升高而加剧。油桐幼苗抵抗铬胁迫的方式是在根部积累大部分的铬,减少向上运输,降低对地上部分的伤害。油桐幼苗将金属铬富集在根部这一特性,对于油桐修复土壤铬污染提供了可行方案和技术支撑。
