腹腔镜肝细胞癌根治术后早期复发风险预测模型的建立与验证
2023-07-17史瑞籽曾新桃杨雄心
史瑞籽,杨 培,曾新桃,李 超,杨雄心
(1.川北医学院,四川 南充,637000;2.电子科技大学医学院附属绵阳医院 绵阳市中心医院肝胆外科)
肝细胞癌(hepatocellular carcinoma,HCC)是世界第6大常见恶性肿瘤,在我国居第四位,也是第2位肿瘤致死病因,严重威胁我国人民的生命与健康[1]。绝大多数HCC发生在慢性肝病伴(或不伴)肝硬化的情况下,最常见的是继发于乙肝病毒、丙肝病毒的感染[2-5]。目前HCC的治疗策略包括手术切除、介入治疗、局部消融、肝移植与系统性治疗等,其中外科根治性切除是HCC患者取得长期生存的重要手段。尽管如此,HCC术后的早期复发仍较常见[6],尤其术后两年内复发率较高[7-10]。研究表明,早期复发患者通常较晚期复发患者预后更差[11]。因此,对于早期复发患者的预测与识别非常重要。本文拟分析我院治疗的HCC患者的临床资料,建立术后早期复发的预测模型与列线图,帮助识别术后早期复发高危患者。
1 资料与方法
1.1 临床资料 采用回顾性研究方法,收集2017年3月至2020年3月我院行腹腔镜根治性切除术的HCC患者的临床资料。纳入标准:(1)根据治疗时最新临床指南诊断为HCC;(2)经专科医生评估可行根治手术的HCC,且经腹腔镜肝细胞癌根治术完整切除肿瘤;(3)术后随访2年以上。排除标准:(1)合并其他肿瘤或术后病理检查提示非HCC;(2)术前曾行射频消融或介入治疗;(3)临床重要资料缺失;(4)出院后拒绝或未完成随访。初筛纳入患者148例,其中资料不完整或术后失访9例,术后因非肿瘤复发因素死亡14例。术前常规行血常规、肝肾功、甲胎蛋白(alpha fetal protein,AFP)、腹部B超、CT和(或)MRI检查等。术前诊断标准参照《原发性肝癌诊疗指南(2022年版)》[1]。
1.2 手术方法 根据术前检查评估患者对手术的耐受程度。通过肿瘤生长部位及大小、数量等决定手术方式(解剖性或非解剖性)。手术由经验丰富的外科医生施行,术中超声再次确定肿瘤部位并标记切除线,保证肿瘤完整切除并保留大于1 cm的手术切缘。
1.3 术后随访 术后门诊定期复查随访。术后1个月复查肝功、AFP及腹部彩超。此后每3个月复查一次。如彩超发现异常或AFP升高,进一步复查上腹部增强CT或MRI等,随访出现复发即判定为终点,进行相应治疗,未复发者继续门诊随访。术后早期复发定义为复发时间<术后24个月。
1.4 临床病理特征 用于术后早期复发分析的临床病理特征共19项,其中微血管浸润(microvascular invasion,MVI)定义为术后病检提示微血管转移。大血管侵犯定义为影像学或术中发现包括门静脉、肝静脉主干及分支等的侵犯。解剖性肝切除遵照Makuuchi等[12]提出的标准,非解剖性肝切除定义为距肿瘤边缘1~2 cm的局部切除。卫星结节定义为影像学或术后病理检查发现主病灶周围结节。多个肿瘤定义为影像学或术后标本发现肿瘤结节>1枚。将AFP使用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析,最大化约登指数获得最佳截止值(44.85 ng/mL),并将患者分为AFP≥44.85 ng/mL及<44.85 ng/mL两组。
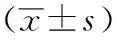
2 结 果
2.1 HCC术后早期复发情况 根据纳入与排除标准,共纳入125例行HCC根治性切除的患者,其中术后早期复发44例(35.2%),随访结束前未复发81例(64.8%)。
2.2 预测模型变量的筛选与预测模型的构建 将上述125例患者使用SPSS 26.0进行Logistic单因素回归分析,以P<0.1为差异有统计学意义为标准确定出10项临床特征(患者性别、年龄、总胆红素水平、是否患有肝炎、是否肝硬化、是否伴有门静脉高压、术中是否输血、中性粒细胞/淋巴细胞比值、碱性磷酸酶、丙氨酸氨基转移酶)与术后早期复发无明显统计学意义。筛选出9项与早期复发相关的危险因素(是否伴有卫星结节、AFP水平、是否伴有大血管侵犯、是否伴有MVI、最大肿瘤直径、肿瘤数量、是否行解剖性肝切除、谷酰转肽酶水平、谷草转氨酶水平),见表1。将上述9项变量进一步行Logistic多因素回归分析(逐步向前法),以P<0.05为具有显著统计学差异的标准筛选出5个变量,即是否伴有卫星结节、AFP水平、是否伴有MVI、最大肿瘤直径、肿瘤数量。将确定的5个变量进行多因素回归分析并拟合模型,见表2。模型公式为:P=-2.409+1.046×MVI(是1,否0)+1.0224×肿瘤直径≥5cm(是1,否0)+1.206×AFP≥44.85 ng/mL(是1,否0)+1.533×肿瘤数量≥2个(是1,否0)+1.644×卫星结节(是1,否0)
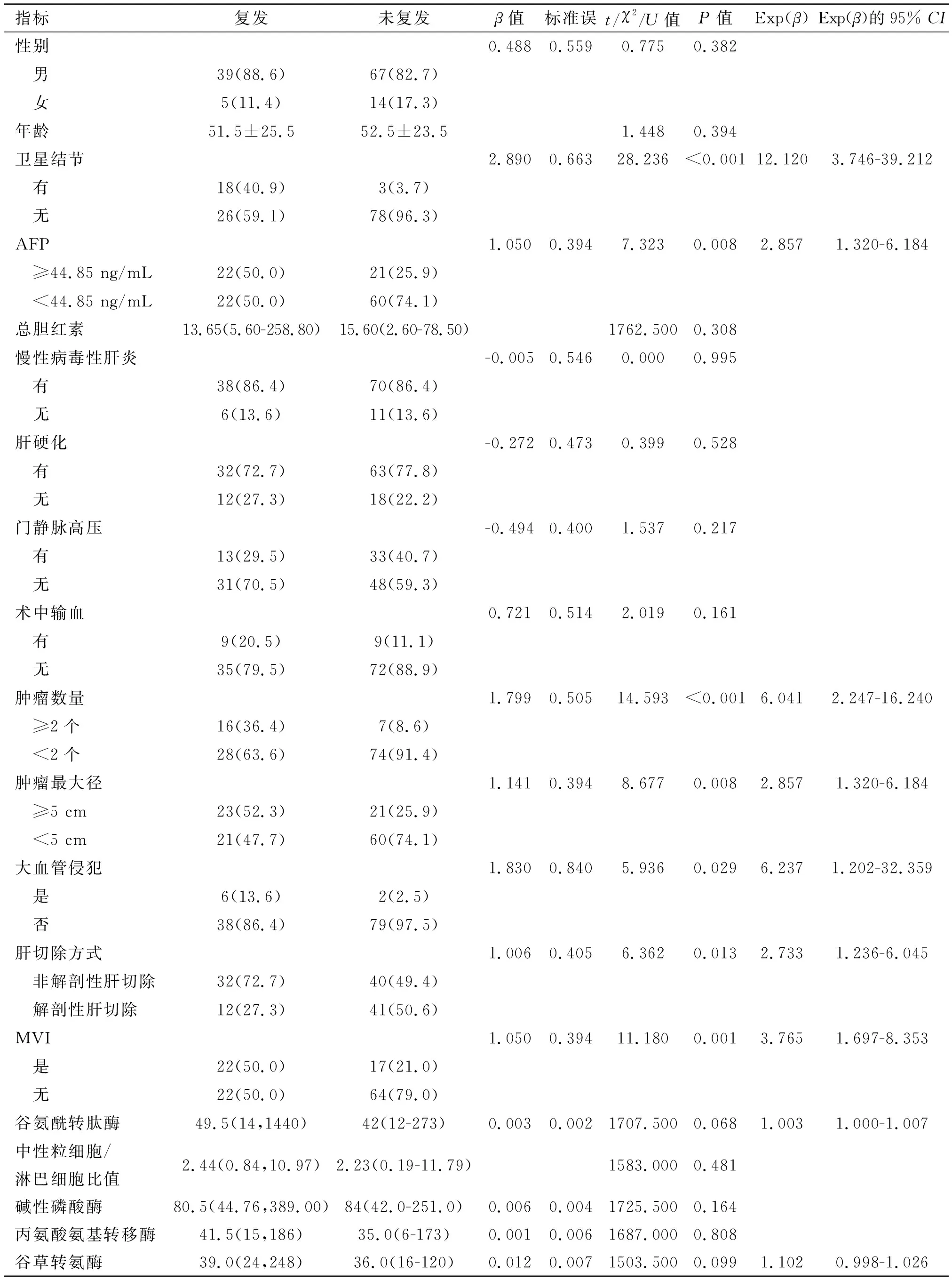
表1 125例患者的临床病理特征
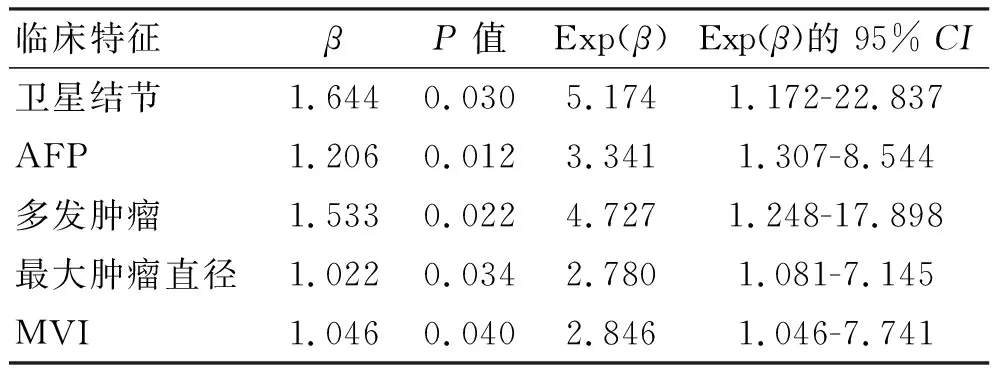
表2 相关变量的多因素回归分析(系数)
2.3 预测模型的可视化 经R语言分析,将卫星结节、AFP、MVI、多个肿瘤、肿瘤的最大直径所构建的预测模型采用列线图可视化,见图1。图中每一条横线分别对应其中一个变量,并与最上方的分数对应,将这五个变量的分数相加得到总分,再根据最下方的标尺计算患者HCC术后早期复发的概率。
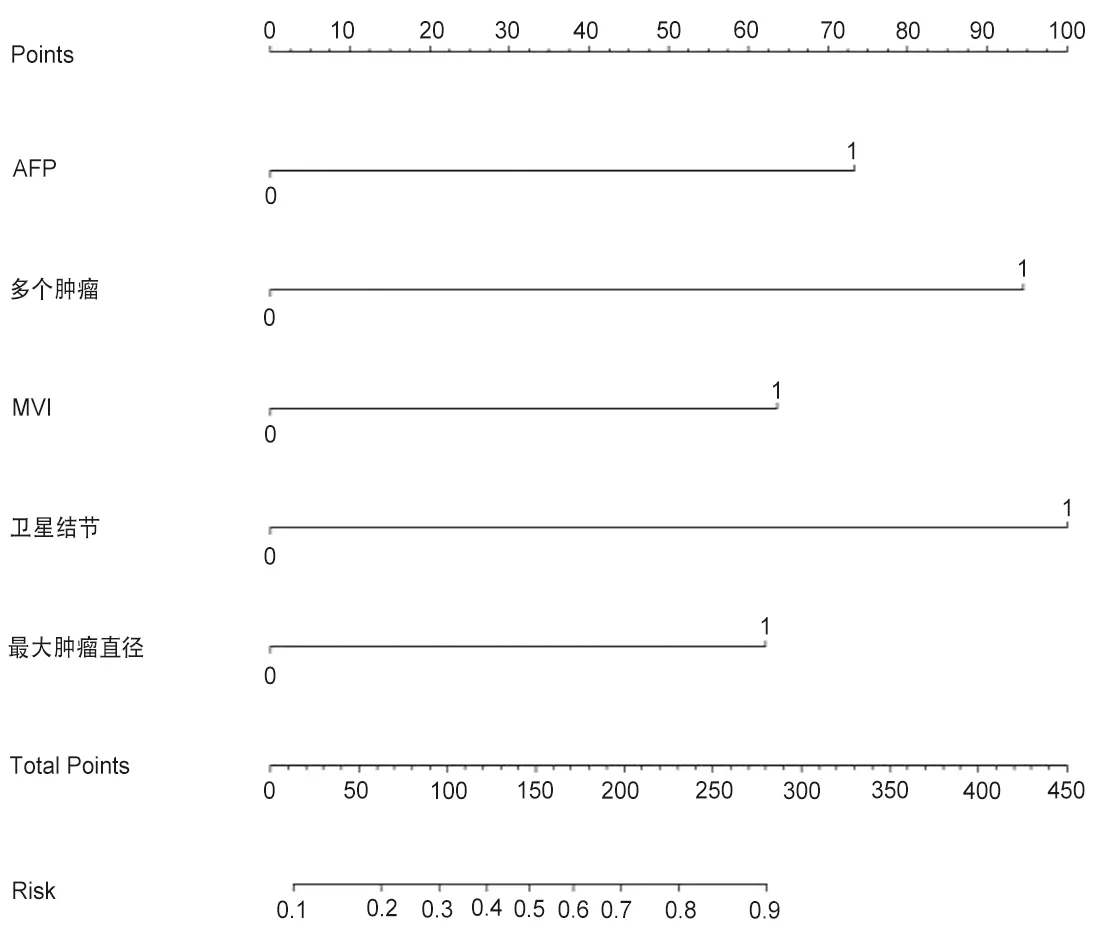
图1 腹腔镜HCC根治术后早期复发患者的列线图预测模型
2.4 模型的验证与评价 根据构建的模型,将基于建模队列及美国癌症联合委员会分期、巴塞罗那临床肝癌分期、中国肝癌分期分别构建的预测模型同时进行ROC分析比较。在建模队列中,ROC曲线下面积为0.822,95%CI为0.744-0.901,P<0.001,C-index=0.832,模型下面积皆大于上述三种分期,说明该模型区分度良好,模型诊断的敏感度为75.0%,特异度为76.5%,见图2。使用Hosmer-Lemeshow检验及校准曲线进行模型准确性评估与结果可视化,见图3。结果显示χ2=0.665,P=0.995,P>0.05,校准图同样提示该预测模型具有较好的准确性。同时,使用bootstrap自助抽样重复抽样1 000例样本对此模型进行内部验证,得到ROC曲线下面积为0.823。95%CI为0.744-0.901,P<0.05,说明该模型同样区分度良好,模型诊断敏感度为75.0%,特异度为76.5%,此模型可准确区分出可能早期复发的患者。
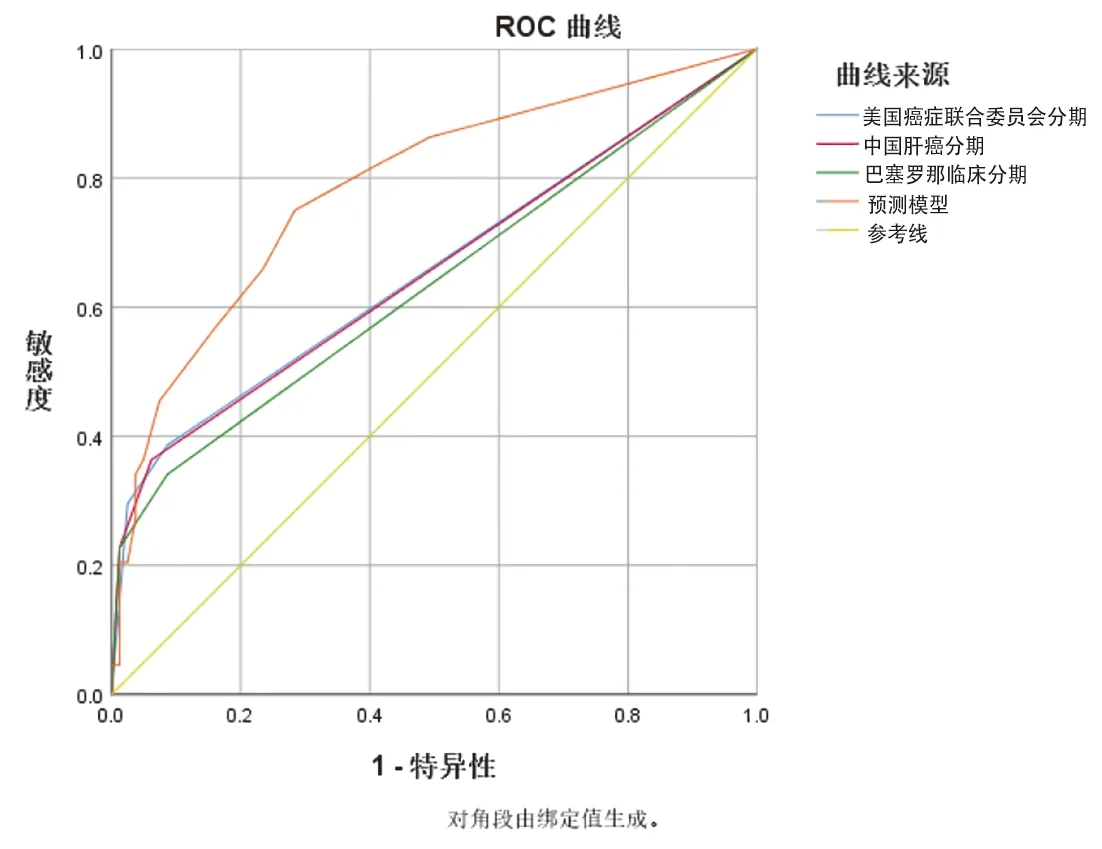
图2 预测模型的ROC曲线
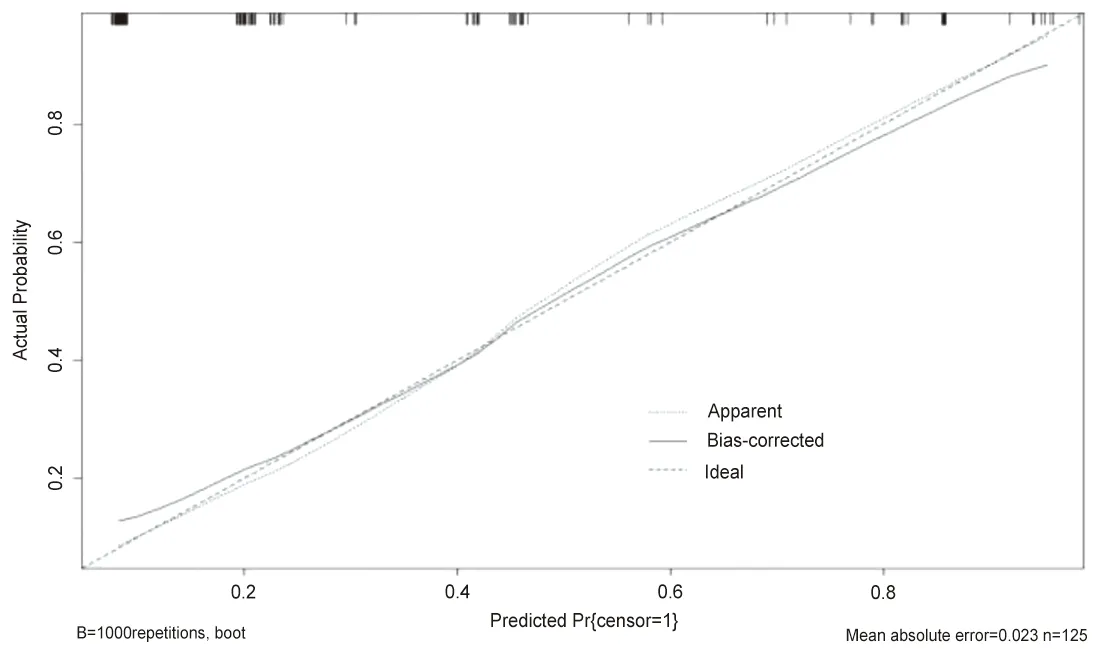
图3 预测模型的校准曲线
2.5 临床有效性 建模队列的DCA曲线见图4。在DCA曲线中,X轴代表不同的阈值概率,Y轴代表净收益;横线表示假定HCC患者均无早期复发,若患者均不予以干预,净收益为0;斜线表示假定HCC患者均复发,均予以干预,净收益为一条反斜线。当模型在这两种极端情况的上方时,代表患者能从中获益。从该预测模型的DCA曲线中可以看出,当阈值概率为0.10~0.89时,对患者使用该模型能从中获得净收益,该模型具有临床应用价值。
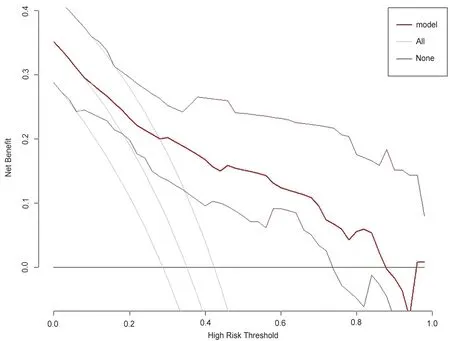
图4 腹腔镜HCC根治术后早期复发患者预测模型DCA曲线
3 讨 论
尽管以根治性手术为主的HCC综合治疗已取得明显进展,但术后复发仍是困扰临床医生的难题。HCC的复发包括局部肝内转移、由循环肿瘤细胞引起的肝内转移及新生肿瘤细胞引起的肝内复发等三种复发模式[13]。研究表明,HCC的早期复发多发生在术后2年内,占全部复发的70%以上,而在这之后的复发往往是由新的肿瘤引起[14]。因此,如何识别术后有早期复发高危因素的患者,进行严格的定期监测与复查,尽早采取治疗措施,对延长患者的无瘤生存期或提升生活质量至关重要。
HCC术后复发的预测模型研究已成为近年的研究热点。Mao等[15]通过基于白蛋白-胆红素评分模型、单核细胞/淋巴细胞比值制作预测模型,提出白蛋白-胆红素评分模型等级高、单核细胞/淋巴细胞比值升高是AFP阴性HCC患者根治性手术后无复发生存的独立危险因素。也有学者通过影像组学研究预测HCC患者术后复发[16]。但由于种群、基础疾病、手术方式等的不同,此类研究同质性较差,各研究的结论及危险因素的选择存在差异,目前仍缺少准确而统一的预测模型。
近年,随着腹腔镜手术经验的积累及设备设施的改进,腹腔镜下肝切除术已趋于成熟,并已成功应用于所有肝段HCC的治疗。在大型综合性医院,腹腔镜下根治性切除术已成为治疗HCC的主流[17]。笔者检索了近年国内外的相关文献,针对腹腔镜HCC根治术后复发危险因素及预测模型的研究较少。因此,我们希望建立一个简单、可重复性高的腹腔镜HCC术后早期复发预测模型,帮助临床医生快速识别术后早期复发的高风险人群,为术后的监测、系统治疗等辅助治疗提供参考依据。
本研究收集了在我院行腹腔镜HCC根治术患者的临床资料,对患者的临床病理特征与早期复发的关系进行分析。先后采用Logistic单因素回归分析、多因素回归分析进行统计,筛选出5个危险变量,即是否伴有卫星结节、AFP水平、是否伴有MVI、最大肿瘤直径、肿瘤数量。将这5个变量再进行多因素回归分析并拟合成最终的预测模型,然后对模型的区分度、敏感度、特异度、有效性等进行验证,结果提示该模型具有较好的临床应用价值。这与既往文献报道一致[18-20]。MVI与卫星结节代表了肿瘤的侵袭特性,是肿瘤进展过程中的两个阶段。MVI的发生与肿瘤的直径、形态、分化程度及乙肝病毒的活跃、复制有一定关系[21-22]。在一项以1 073例患者为研究对象的多中心临床研究中,发现肿瘤直径与MVI的发生率密切相关,肿瘤直径越大,发生MVI的风险越高[23]。伴有MVI的患者出现卫星结节则提示有肿瘤进展[24]。肿瘤大小、数量代表了肿瘤的负荷。在现有的多种HCC分期中,肿瘤大小与数量已成为公认的重要分期指标,可显著影响患者预后,肿瘤负荷越大,出现转移复发的可能性越大[25]。AFP是一种特异性α球蛋白,常见于妊娠期的孕妇与胎儿血中,胎儿出生后即降至正常。HCC患者由于AFP基因启动子去甲基化的调控表达,使AFP被重新开放与大量表达。AFP可通过阻断凋亡信号、抑制肿瘤细胞自噬等方式促进肿瘤的生长发展、提高耐药性[26]。因此,AFP被作为HCC患者筛查、诊断及术后监测的重要标志物,也被多个欧洲、亚洲的分期系统纳入为评判标准之一[27]。研究表明,AFP阴性的HCC患者,癌组织分化程度、脉管累及情况、肿瘤大小及预后均优于AFP阳性患者[28]。但目前仍无一个标准的临界值可准确将患者分为复发的高危人群与低危人群[29]。本文从样本中选择最佳截止值来衡量AFP对患者的预后影响,发现AFP是腹腔镜HCC根治术后早期复发的危险因素。既往研究提示,伴有门静脉癌栓或其他大血管侵犯会影响HCC患者的分期与预后[30-31],手术方式(解剖性或非解剖性)也可能影响患者预后[32];但本研究中这两个因素在多因素回归分析时无统计学意义,其对于早期复发的意义与价值值得进一步探讨。
本研究是一项回顾性研究,样本量偏少,可能具有一定的局限性。模型选择的危险因素多为肿瘤的物理因素,未考虑肿瘤微环境对复发的影响等。下一步计划进行多中心、大样本的建模,并通过内部与外部验证来证明模型的有效性,可能更具有说服力。
综上,本模型能准确区分术后早期复发的患者,可用于腹腔镜HCC根治术后早期复发患者的预测。
