腹腔镜根治性顺行性模块化胰脾切除术的应用
2023-07-17卢启冉薛嘉君魏志刚
卢启冉,薛嘉君,余 杰,魏志刚
(1.山西医科大学第一临床医学院,山西 太原,030001;2.山西医科大学第一医院肝胆胰外科)
近年有学者预测2020~2030年中国胰腺癌发病率与死亡率将持续上升[1]。这也预示着我国胰腺癌的诊疗将面临严峻的挑战,因此如何进一步提高胰腺癌的诊疗效果已成为临床工作者需迫切解决的问题。胰腺癌好发部位主要为胰头、胰体尾两个部位,其中胰体尾癌约占1/4。近百年来随着胰十二指肠联合切除术的改进与发展,多数患者的预后得到改善[2-3],但胰体尾癌的外科治疗相对滞后。传统胰体尾联合脾切除术为胰体尾癌外科治疗的标准手术方式之一沿用至今,但存在淋巴结清扫不彻底、切缘阳性率高等问题[4],后腹膜切缘阳性率高达36%~90%[5]。胰腺癌组织松散、体积小[6]、常伴有慢性胰腺炎,且胰腺缺乏致密的被膜,高度浸润性胰腺癌容易突破胰腺被膜向后侵犯,累及左肾上腺,或突破肾前筋膜进入肾脂肪囊[4],而胰体尾联合脾切除术的解剖层面为胰腺后包膜与肾前筋膜之间的区域;胰体尾联合脾切除术的淋巴结清扫未包括所有N1淋巴结;自左至右的游离顺序挤压肿瘤、未离断血管淋巴管,导致肿瘤术中播散远处转移[7]等。于是Strasberg等提出了根治性顺行模块化胰脾切除术(radical antegrade modular pancreatosplenectomy,RAMPS),目的是保证切缘阴性、第1站淋巴结+肠系膜上动脉、腹腔干前方及左侧淋巴结的彻底清扫[4],其解剖层面见图1、图2。随着微创化技术、多学科综合治疗、新辅助治疗等相关领域的不断发展,使得胰体尾癌的诊疗模式逐步向微创化、综合性的方向发展。
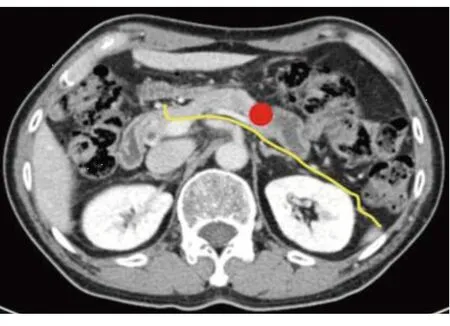
图1 前RAMPS 保留肾上腺
1 资料与方法
1.1 临床资料 2020年8月至2022年10月共为7例患者行腹腔镜根治性顺行性模块化胰脾切除术(laparoscopic radical antegrade modular pancreatosplenectomy,Lap-RAMPS),其中男4例,女3例,59~74岁,中位年龄64岁,高血压2级伴2型糖尿病新发1例,左肺恶性肿瘤术后1例,心血管病史1例,2型糖尿病1例。术前CA19-9升高5例,为204.25(6.20~461.20)U/mL。7例均于术前进行相关化验检查,如B超、超声活检、CT、磁共振、PET-CT等,确诊为可切除或交界可切除胰腺癌。术前发现1例侵犯脾动脉、脾静脉,1例侵犯脾动脉,2例侵犯脾静脉,余3例未发现血管侵犯。
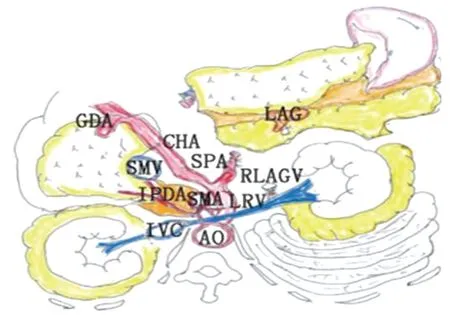
图2 后RAMPS联合切除肾上腺[8](AO:腹主动脉;IVC:下腔静脉;IPDA:胰十二指肠下动脉;SMA:肠系膜上动脉;LRV:左肾静脉;SMV:肠系膜上静脉;SPA:脾动脉;RLAGV:左肾上腺静脉;CHA:肝总动脉;GDA:胃十二指肠动脉;LAG:左肾上腺)
1.2 手术方法 全身麻醉,气管插管,患者取仰卧分腿位,头部略高,主刀、第一助手、扶镜手分别立于患者右侧、左侧及两腿之间。五孔法施术:脐下1~2 cm处穿刺10 mm Trocar为观察孔,分别于左右锁骨中线平脐处穿刺12 mm Trocar,左右腋前线肋弓下穿刺5 mm Trocar,为主刀操作孔与助手操作孔。建立气腹,压力维持在12 mmHg,常规探查有无穿刺损伤、腹腔内转移情况。依次探查肝脏、大网膜、十二指肠球部、小肠、盲肠、升结肠、横结肠、降结肠、乙状结肠、小肠系膜根部、腹膜、腹盆腔腹壁有无远处转移。用超声刀于中结肠静脉左侧中央薄弱区离断胃结肠韧带、脾结肠韧带,打开小网膜囊,游离胃后粘连,将胃牵向右上,暴露胰腺,探查胰腺病灶大小、位置、质地、活动度、与周围脏器的关系,并判断周围重要血管侵犯情况。助手上抬胰腺,主刀切开胰腺颈部下缘腹膜,清扫18组淋巴结,循结肠中静脉寻找并游离肠系膜上静脉,于肠系膜上静脉前无血管间隙建立胰腺颈后隧道,清扫14v组淋巴结,沿肠系膜上静脉向左侧游离暴露脾静脉根部。助手下压胰腺,主刀切开胰腺颈部上缘腹膜,游离肝十二指肠韧带,暴露肝总动脉、胃十二指肠动脉、门静脉,并清扫8a组、12组淋巴结,血管吊带悬吊肝总动脉,随后向左侧及背侧仔细解剖脾动脉根部、胃左动脉及腹腔干,清扫8、9组淋巴结,判断腹腔干与肿瘤的位置关系。超声刀于胰腺颈部后隧道完全通过,拓宽胰后隧道,直线切割闭合器离断胰腺颈部,胰腺断端切取组织送快速切片检查。胰头侧断端用4-0 Prolene线间断U字缝合包埋。助手将胰尾侧胰腺断端牵向左侧,暴露脾静脉,游离脾静脉近端后用Hem-o-lok夹闭后离断。暴露腹腔干、脾动脉,于脾动脉汇入腹腔干处以丝线双重结扎,结扎远端用2枚Hem-o-lok夹闭脾动脉后离断(图3、图4)。于肠系膜上动脉左侧向背侧游离,解剖游离左肾静脉入下腔静脉汇合处,确定解剖平面,同时解剖游离肠系膜上动脉,并清扫14p、14d组淋巴结,清扫“海德堡”三角内结缔组织,彻底裸化动脉血管。紧贴左肾静脉平面自右向左侧清扫周围组织,上起腹腔干根部水平,下达左肾静脉。沿腹腔干及肠系膜上动脉分离至腹主动脉,切除腹腔动脉前方及其左侧的淋巴组织,上至腹腔干平面,下至肠系膜上动脉平面,即部分16a2组淋巴结;若肿瘤未突破胰腺后背膜,可行前RAMPS:继续延左肾静脉水平自右向左游离肾周组织,骨骼化左肾动静脉,沿途保护左肾上腺动静脉、左侧卵巢动脉或左侧睾丸动脉,切除左肾前方、上方肾周筋膜。需行后RAMPS手术的情况为肿瘤向后浸润超出胰腺后被膜,严重者累及左侧肾上腺,此时到达腹主动脉后继续向深面分离,再转向左侧,骨骼化左肾动静脉,沿途游离左肾上腺动静脉,用Hem-o-lok夹闭后离断,保护左侧卵巢动脉或左侧睾丸动脉,将左肾上腺连同肾脏前方脂肪囊组织一并切除。超声刀离断脾胃韧带,其内胃短血管用Hem-o-lok结扎后离断,向上游离至脾膈韧带。将脾脏托起,切断脾肾韧带,最终将整块胰体尾部、脾脏、腹膜后组织一并移除,并放入标本袋。温蒸馏水冲洗腹盆腔。取脐下正中切口,长约4 cm,逐层切开入腹,取出标本(图5)。分别于胰头侧断端、脾窝处放置腹腔引流管,经腹壁两侧切口引出、固定。
1.3 统计学处理 采用SPSS 25.0软件进行数据分析,计量资料以中位数M(P25,P75)表示。
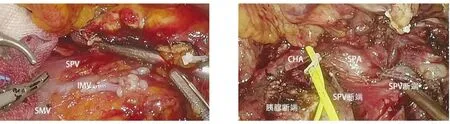
图3 离断胰腺颈部(SPV:脾静脉;IMV:肠系膜下静脉;SMV:肠系膜上静脉) 图4 胰颈后切缘(CHA:肝总动脉;SPA:脾动脉;SPV:脾静脉)
2 结 果
2.1 手术情况 患者均顺利完成手术,3例为前Lap-RAMPS,4例为后Lap-RAMPS,无一例中转开腹,手术时间365(260~450)min,出血量100(50~800)mL,术中2例输血1 200 mL,输血病例为交界可切除胰腺癌,术中行门静脉切除重建,手术全过程出血较多,淋巴结清扫彻底(图5~图9)。
2.2 术后情况 术后发生生化漏3例,乳糜瘘1例,不全性肠梗阻伴腹胀2例,胸腔积液5例,经保守治疗痊愈。拔除胃管时间1(1~2)d,排气时间3(2~5)d,首次进食时间4(3~5)d。拔除腹腔引流管时间8(6~8)d,均于术后第3天开始逐步退出腹腔引流管,出院前拔除腹腔引流管。术后住院10(7~12)d,无再次手术病例。
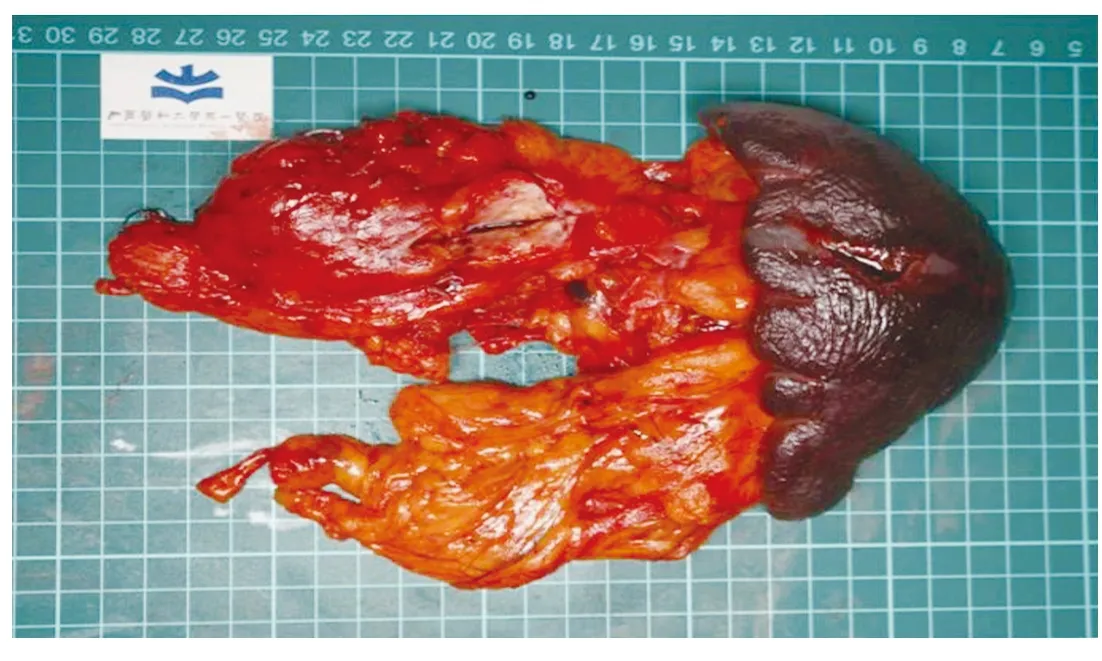
图5 Lap-RAMPS手术标本
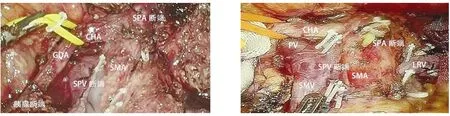
图6 胰腺后切缘(胰颈后,CHA:肝总动脉;SPA:脾动脉;SPV:脾静脉;GDA:胃十二指肠动脉;SMA:肠系膜上动脉) 图7 清扫结束后术野(胰颈后,CHA:肝总动脉;SPA:脾动脉;SPV:脾静脉;SMA:肠系膜上动脉;SMV:肠系膜上静脉;PV:门静脉;LRV:左肾静脉)
2.3 术后病理 肿瘤最大径3.8(3.0~5.5)cm。导管腺癌4例,其中2例为中分化,T2期、T3期各1例,1例为中-低分化,T2期,1例为高-中分化,T2期;黏液癌1例,为中-低分化,T1期;神经内分泌肿瘤1例,为G3级,T3期;间叶组织恶性肿瘤1例,T3期。根据美国癌症联合会第8版TNM分期法,ⅠB期3例、ⅡA期2例、ⅠA期、Ⅲ期各1例。标本切缘均为阴性,2例伴脉管侵犯、神经侵犯,2例伴脉管侵犯、未见神经侵犯,1例伴出血坏死。淋巴结清扫8(8~12)枚,淋巴结阳性2例(28.6%),1例伴肾上腺周围淋巴结转移。
2.4 随访情况 随访截至2023年2月1日,7例患者均获随访,随访3~30个月,术后4例分别接受FOLFIRINOX方案与吉西他滨+白蛋白结合型紫杉醇方案,1例于术后4个月发现术区复发,并死于肿瘤复发。
3 讨 论
3.1 Lap-RAMPS的可行性 国外相关研究表明[9-13],Lap-RAMPS在术中出血、术后康复等方面更具优势,但在并发症发生率、淋巴结清扫数量、R0切除率等方面与RAMPS相似。国内伊力旦·热合曼等[14]发现,与开腹RAMPS组相比,Lap-RAMPS组淋巴结清扫数量更少,但术后患者疼痛评分、住院时间更短,两组术后并发症发生率、R0切除率及预后效果差异无统计学意义。本组患者淋巴结清扫结果与以上结果类似。本组病例淋巴结清扫数量较少可能与患者个体因素、肿瘤分期较早、较小体积淋巴结漏检等因素有关。
Lap-RAMPS使不离断胰腺的胰腺后操作更容易,可在手术可逆阶段即探查清楚肿瘤对肠系膜上动脉、腹腔干的侵犯情况[15]。Lap-RAMPS按照由右到左的顺序操作,先离断胰颈部、脾动脉,阻断胰体尾部淋巴回流(胰体尾部淋巴回流见图10),为手术提供充足的空间,有效控制出血,符合肿瘤治疗的“非接触”原则[16]。优先暴露肠系膜上血管、腹腔干,沿其走行暴露腹主动脉,游离并保护左肾血管,方便确定解剖层面。
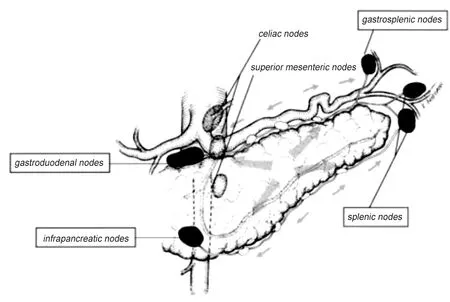
图10 胰体尾淋巴回流示意图[17]
3.2 Lap-RAMPS与多学科综合治疗 目前单一学科的局限性无法进一步提高胰腺癌患者整体诊治的效果[18],为了突破胰体尾癌的治疗瓶颈,多学科综合治疗逐步受到临床工作者的重视。在多学科综合治疗模式下,可集合多学科优势,为患者提供精准、全面、个体化、动态化的诊疗措施,提高整体治疗的性价比。本组患者手术前后均进行多学科综合治疗,并贯穿治疗全过程,通过多学科合作,为患者提供了个体化的治疗方案,并动态评估疗效与不良反应,适时调整治疗方案,治疗效果满意,使诊疗效果最大化。
3.3 Lap-RAMPS与术前新辅助化疗 近年,胰腺外科大夫逐步认识到新辅助治疗在胰腺癌治疗中的重要性,尤其在提高手术切除率、改善预后方面得到广泛认可[19]。最新指南建议,对于体能状态良好的交界可切除的胰腺癌、病理诊断明确且合并高危因素的可切除的胰腺癌行新辅助治疗[19]。相关研究表明,Lap-RAMPS可于新辅助治疗后进行,对于提高胰体尾癌的R0切除率、改善远期疗效具有积极意义[20]。但对于Lap-RAMPS术前联合新辅助治疗对术后并发症的影响尚缺乏大样本、多中心、高质量的研究。术前我们已对符合以上要求的患者进行新辅助化疗。本研究中,术后1例患者死于肿瘤复发,术中行后Lap-RAMPS,常规清扫周围淋巴结,术后病检提示4枚淋巴结转移,肾上腺周围1枚转移,病理分期为Ⅲ期,患者术后进行辅助化疗,其死亡可能与病程较晚、由于目前技术及认知限制尚有远处转移淋巴结未彻底清扫有关,同时建议对类似患者术前进行新辅助化疗。
3.4 Lap-RAMPS的适应证 关于Lap-RAMPS的适应证,韩国延世大学依据自身临床经验提出了延世标准[21]:(1)肿瘤未超出胰腺;(2)左肾上腺、左肾与胰腺之间的筋膜层保持完整;(3)肿瘤距腹腔干>1~2 cm,但目前该标准并未形成广泛共识。不论开腹标准术式或Lap-RAMPS,满足延世标准患者的预后优于不满足延世标准的患者,且延世标准较TNM分期更能提示胰腺癌分期与预后[22]。本研究以延世标准为参考,对于符合延世标准的患者行前Lap-RAMPS,同时通过手术流程的改良,尝试在某些方面寻求突破,如对于肿瘤浸润范围已超出胰腺后包膜的患者行后Lap-RAMPS。本组患者中4例已超出胰腺后包膜,2例存在脉管侵犯、神经侵犯,均采用后Lap-RAMPS,术后取得较好疗效。笔者体会,对于肿瘤已突破胰腺后包膜且存在脾动静脉侵犯的患者,侵犯部位距起始部>1 cm时可行后Lap-RAMPS,将其完整切除且保证切缘阴性;若肿瘤侵犯部位距脾静脉起始部<1 cm甚至侵犯脾静脉门静脉汇合部或触及门静脉左侧时,则需行后Lap-RAMPS,并联合门静脉-肠系膜上静脉切除重建;若肿瘤侵犯腹腔干应行联合腹腔干切除的胰体尾癌根治术,以保证切缘阴性。
3.5 Lap-RAMPS中海德堡三角的清扫 海德堡三角的清扫范围为肠系膜上动脉、肝总动脉与肠系膜上静脉、肝门静脉组成的三角形区域内的血管、淋巴组织及神经组织[23]。关于清扫海德堡三角对胰十二指肠切除术治疗胰头癌临床疗效的相关研究显示,与标准胰十二指肠切除术相比,海德堡三角清扫+胰十二指肠切除术治疗胰头癌,可延长患者中位生存时间,且不增加手术相关并发症[24],可提高手术R0切除率、清扫更多淋巴结、降低胰腺癌局部复发率、改善患者预后[23]。为进一步改善预后,本研究中1例患者因肿瘤靠近脾动静脉根部,行后Lap-RAMPS的同时清扫海德堡三角,术中离断胰颈后助手将胰尾侧胰腺断端牵向左侧,暴露脾静脉后离断,进一步暴露门静脉、肠系膜上静脉。暴露腹腔干,离断脾动脉后沿肝总动脉清扫周围组织,同时沿腹腔干、腹主动脉向尾侧解剖游离肠系膜上动脉,彻底清扫海德堡三角内结缔组织。与另外6例患者相比,术中出血量、术后并发症、切缘情况未见明显差异,清扫淋巴结数量、淋巴结阳性数量明显增多,但清扫海德堡三角对于Lap-RAMPS治疗胰体尾癌的适应证、临床疗效仍需进一步研究。
目前国内外关于Lap-RAMPS的学术研究及报道仍然较少,医学界对手术标准仍未形成统一意见,需进一步积累手术经验以制定相关标准[15];并进行更多大样本、多中心、高质量的研究,在循证医学方面提供高质量的理论依据。
