腹腔镜胰腺中段切除术21例临床体会
2023-07-17乐乾尊王海彪陈佰文
乐乾尊,王海彪,陈佰文,李 宏
(宁波市医疗中心李惠利医院肝胆外科,浙江 宁波,315000)
目前对于胰腺颈体部肿瘤的主流手术方式为腹腔镜胰十二指肠切除术或腹腔镜胰体尾切除术。胰腺中段切除术最早由Guillemin报道用于治疗慢性胰腺炎。2003年完成首例腹腔镜胰腺中段切除术,此后腹腔镜胰腺中段切除术仅见少量报道[1-2]。2017年9月至2022年11月宁波市医疗中心李惠利医院(兴宁院区+东部院区)肝胆胰微创团队共开展21例腹腔镜胰腺中段切除术,现将体会报道如下。
1 资料与方法
1.1 临床资料 术前检查包括血常规、尿常规、粪常规、生化常规、凝血功能、肿瘤标志物、乙肝三系+前S1抗原、输血前检测、胸片、心电图、增强CT、增强MRI+MRCP等(图1)。排除标准:(1)严重心血管疾病无法耐受腹腔镜手术;(2)正在使用抗凝药物;(3)ASA评分≥4分;(4)术前怀疑恶性肿瘤或恶性肿瘤已发生远处转移;(5)术中快速冰冻病理提示恶性肿瘤导致改行其他手术;(6)术中因胰腺尾部萎缩无法行胰肠吻合。回顾分析患者手术时间、术中出血量、术后胆漏、胰瘘等围手术期资料。本研究通过李惠利医院伦理委员会批准(审批号:KY2022SL213-01)。

图1 术前磁共振检查(A:动脉期;B:静脉期;C:延 图2 Trocar位置迟期;D:T2相;白色箭头为胰腺颈体部肿瘤)
1.2 手术方法 采用5孔法施术,见图2。脐下1 cm处穿刺10 mm Trocar为观察孔;有下腹部手术史的患者采用开放式入腹,无手术史的患者直接穿刺气腹针建立气腹。穿刺10 mm Trocar作为观察孔,气腹压力维持在14 mmHg;置入腹腔镜后首先探查腹腔,根据患者腹腔内空间选择其余4枚Trocar的位置,一般选择左、右腋中线肋缘下3 cm穿刺5 mm Trocar、右侧脐旁5 cm穿刺12 mm Trocar、左侧脐旁5 cm处穿刺5 mm Trocar。离断胃结肠韧带后,助手将胃向上牵拉,暴露胰腺前缘。术中B超探查胰腺(图3),明确肿瘤的大致位置及切除线。打通胰腺后缘与肠系膜上静脉之间的间隙(图4)。助手将胰腺提起后,主刀用超声刀开始离断胰腺,切缘一般距肿瘤1 cm。胰腺断端用3-0可吸收线或3-0 PDS-Ⅱ线单纯连续缝合。移除手术标本后送术中快速冰冻病理检查,若证实为恶性肿瘤,则改行腹腔镜胰十二指肠切除术或腹腔镜胰体尾切除术。胰头侧断端用3-0线连续缝合,缝合过程中尽量保持在胰十二指肠上动脉的左侧(图5)。胰尾侧断端行胰肠Roux-en-Y导管对黏膜吻合。
1.3 术后随访 采用门诊、电话或微信方式随访,了解患者出院后的基本情况。出院后拔除引流管的患者每2周门诊定期复查血常规、生化、肝胆胰脾B超,每3个月复查全腹部增强CT或MRI;对于带管出院的患者,每周门诊定期复查血常规、生化、引流液淀粉酶,每个月复查腹部平扫CT,直至拔除引流管后改为每3个月复查全腹部增强CT或MRI。
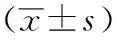
2 结 果
本组21例患者中男7例,女14例,28~79岁,中位55.4(38.5,67.5)岁。体检意外发现8例,腹痛伴腹胀6例,其他原因来院7例。肿瘤均位于胰腺体颈部,术前影像学资料提示为良性肿瘤。21例患者均顺利完成手术,无一例中转开腹。术中1例因出血过多予以输2 U红细胞悬液及500 mL新鲜冰冻血浆。手术时间140~560 min,平均(314.8±126.6)min;估计术中出血量50~800 mL,中位数180.9(75,200)mL。术中2例行胆道造影,4例采用荧光腹腔镜辅助手术。术中快速冰冻病理均证实为良性肿瘤,切缘阴性。
术后病理证实导管内黏液性乳头状瘤5例,浆液性囊腺瘤6例,黏液性囊腺瘤3例,实性假乳头状瘤3例,神经内分泌瘤3例,导管腺癌1例。1例导管腺癌术后与家属沟通,决定不再继续行根治性清扫。术后无一例发生胆道狭窄与胆漏,无围手术期及出院后30 d死亡病例。发生生化漏4例,B级胰瘘15例,C级胰瘘2例。2例C级胰瘘患者中,1例因胰肠吻合口周围脓肿住院期间行吻合口拆除+胰体尾切除术,1例因胰瘘导致胃十二指肠动脉出血行数字减影血管造影覆膜支架效果不佳,住院期间行剖腹探查止血术,2例非计划再手术患者术后均恢复良好出院。
21例患者中9例带管出院,12例住院期间拔除引流管,住院25.8(18,31)d。带管出院的9例患者中,7例出院后4周内拔除引流管,其余2例患者出院后8周内拔除引流管(最长带管时间62 d:术后住院带管时间30 d,出院带管时间32 d);1例患者拔除引流管后因腹腔内包裹性积液,出院后第41天再次入院行腹腔穿刺引流术。1例术后证实为导管腺癌,目前化疗已结束,长期门诊随访中。
3 讨 论
胰腺颈体部的具体范围并无明确规定,通常指肠系膜上静脉前方的胰腺组织。对于胰腺颈体部的良性或交界性肿瘤,目前可供选择的手术方式主要有保留/不保留幽门的胰十二指肠切除术、胰腺节段切除术、单纯胰腺肿瘤剜除术等[3-5]。随着保全胰腺功能概念的提出,胰十二指肠切除因过程复杂,术后并发症较多,并非胰腺颈体部肿瘤的最佳手术方式[6];胰腺肿瘤单纯剜除虽可保留更多的胰腺正常组织,但其一般仅适于直径<3 cm且未靠近主胰管的肿瘤[7-9]。本研究中,患者胰腺肿瘤大小约为2.9 cm,且肿瘤大部分位于肠系膜上静脉区前方的胰腺颈部组织,因此首先选择胰腺节段切除术。术中快速冰冻病理是决定最终手术方式的有效手段,若术中病理提示恶性肿瘤,则根据术中具体情况在取得家属同意后改行腹腔镜胰十二指肠切除术或腹腔镜胰体尾切除术,本研究中1例患者因术中诊断为良性肿瘤,而术后被诊断为恶性肿瘤,家属不要求继续行根治性清扫,但对手术的规范性带来了挑战,因此对于术前影像学无法明确诊断时选择胰腺中段切除术需慎重。
胃十二指肠动脉及胰十二肠上动脉在胰腺颈部右缘的前面下降,其在胆总管胰腺段的左侧(图6A),理论上确定胰腺颈部右侧切缘时,只要将胰腺切缘定在胃十二指肠动脉垂直线的左侧即可保证在离断胰腺右侧切缘时不损伤胆总管胰腺段(图6B[10])。有研究显示,约3%的胃十二指肠动脉走行于胆总管右侧[11]。因此在实际操作过程中,并不能完全确定是否造成了胆总管损伤及狭窄。我们的经验是:(1)术前根据患者的CT、MRI仔细辨别胆总管在胰腺内的走行;初步测量胃十二指肠动脉与胆总管的距离;观摩肿瘤的大致位置,以判断肿瘤右侧切缘距胆总管的距离及是否超过胃十二指肠动脉的垂直线;判断胃十二指肠动脉是否存在变异。(2)若肿瘤右侧切缘可能超过胃十二指肠动脉的垂直线,一般采用荧光腹腔镜(吲哚箐绿2.5 mg静脉推注)辅助胆总管显影(图7),待胆总管完全显影后再离断胰腺。根据荧光能透过8~10 mm组织的原理[12-13],若离断胰腺过程中出现荧光则提示切缘可能距胆总管较近,离断过程中需注意避免损伤胆总管。若出现造影剂外渗,则提示胆总管可能存在破口甚至离断。(3)离断胰腺右侧切缘的过程中,虽然未造成胆总管损伤,但由于超声刀的热传导可能造成胆总管下段狭窄,在不确定的情况下我们采用术中胆道造影以判断胆总管完整情况(图8)。当然此方法并不适于每一例手术,只有高度怀疑胆总管狭窄时才会慎重选择,毕竟造影附带的胆总管穿刺、缝合亦可能对胆总管造成一定程度的损伤。
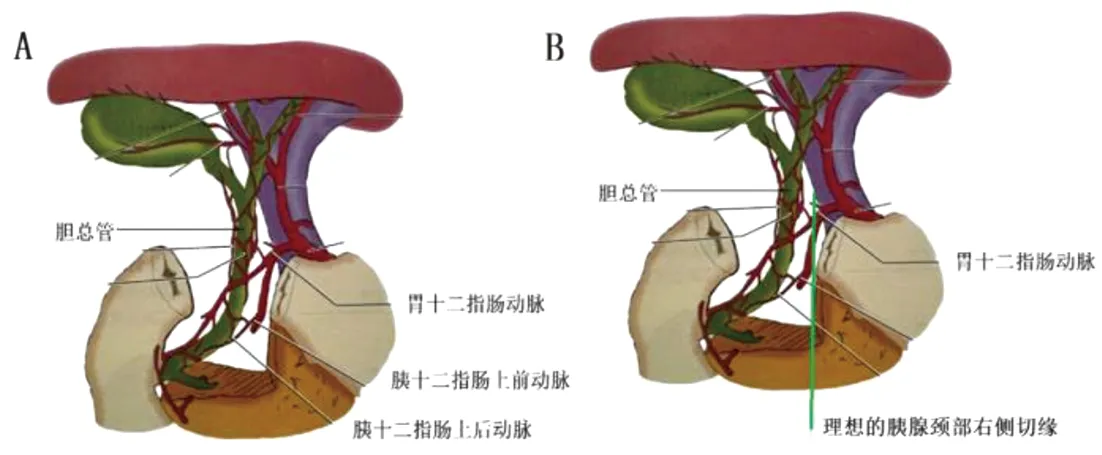
图6 A:胃十二指肠动脉与胆总管的解剖位置;B:理想的胰腺颈部右侧切缘(绿色线条)

图7 荧光腹腔镜用于辅助胆总管的显影(白色箭头:胆总管;红色箭头:胰头侧断端;绿色箭头:脾静脉;黄色箭头:胰尾侧断端及胰管;蓝色箭头:肠系膜上静脉)
图8 术中胆道造影用于胆总管的显影(红色箭头:胆总管;蓝色箭头:十二指肠。对于同时行胆囊切除的患者,自胆囊管注射造影剂;对于不行胆囊切除的患者,自胆囊注射造影剂,并用5-0可吸收线缝合切口)
由于体颈部局部切除导致胰腺有两个断端,因此术后胰瘘发生率较其他手术高[14-17]。我们一般将胰头部断端用3-0胃肠线连续双层缝合,胰体部断端采用传统的胰-肠Roux-en-Y导管对黏膜吻合,吻合前根据患者胰管大小放置硅胶支撑管。分别于胰头部断端、胰肠吻合下方放置引流管,大网膜尽量覆盖创面[18-20],以期术后发生胰瘘使其局限不至于范围过大,但采用大网膜覆盖的方法能否真正起到临床作用有待进一步研究。术后当天使用生长抑素3 mg q12 h微泵抑制胰腺分泌(5~7 d),此后根据患者引流液的量及淀粉酶值改用生长抑素2 mg q12 h微泵过渡(2~3 d),防止患者出现一过性腹泻。拔除引流管前常规复查全腹部CT,评估患者有无包裹性积液,若术区无明显包裹性积液满足以下条件之一即可拔除引流管:(1)腹腔引流管内引流量连续3 d<10 mL/d,且引流液淀粉酶<500 U/L;(2)腹腔引流管内引流量连续3 d<10 mL/d,但引流液淀粉酶>500 U/L时(没有上限),予以隔日退引流管1~2 cm,直至侧孔暴露在患者皮肤表面;(3)若腹腔引流管内引流量>10 mL/d且引流液淀粉酶>500 U/L时,予以带管出院,并每日自行记录引流量且每周门诊复查,当满足前2条中的一条时,即可拔除引流管。
综上所述,经过仔细的术前规划并结合术中荧光腹腔镜、胆道造影的辅助,腹腔镜胰腺体颈部切除术是安全、可行的,但术后胰瘘率较高,需要由经验丰富的外科医生施术。
