古菌群落视角评估某退役铀尾矿库的治理效果
2023-07-13伊英达陈恒雷冯光文
伊英达,陈恒雷,冯光文
(新疆大学物理科学与技术学院,放射生态与离子束生物技术研究中心,乌鲁木齐 830017)
化石能源的使用给各国生态环境保护工作带来了巨大压力[1]。为了降低化石能源的负面影响,寻求更加清洁高效的能源替代品,包括我国在内的许多国家将替代目标锁定在核能上[2]。铀元素作为核能利用的重要原料[3],在降低化石能源消耗、改善生态环境质量、维持经济可持续发展方面发挥着重要作用[4],然而铀元素在开采和冶炼过程中,难以避免会产生大量的固体废弃物,这些废弃物既含有天然放射性核素(如238U、232Th、226Ra、40K 和222Rn 等),也含有一定量具有化学毒性的重金属[5]。为了消除固体废弃物中有害物质迁移、扩散对周围环境的影响,按照《铀矿冶辐射防护和辐射环境保护规定》(GB 23727—2020)的要求建设铀尾矿库,构建人工防渗、护坡等措施,对其进行填埋、覆土处理[6]。为了了解铀尾矿库中有害物质是否向周围环境发生迁移、扩散,需对尾矿库进行长期监控,以评估其对周围环境的影响。Yong等[7]和Mao等[8]以位于中国西北某退役10多年的铀尾矿库为研究对象,开展了尾矿库中天然放射性核素和重金属的迁移规律研究,发现尾矿库及其周围土壤环境中的天然放射性核素和重金属均处于当地的背景水平,从宏观放射生态视角评估,尾矿库退役治理效果良好。
近年来,随着高通量测序技术和“组学”技术的应用,国内外学者对铀尾矿中微生物的群落结构和功能进行了广泛的研究[9-14]。Yan 等[9]通过对我国南方某铀尾矿及其毗邻农田土壤中的微生物进行宏基因组测序分析发现,微生物的群落结构和功能在铀污染的土壤中呈现显著变化。曾涛涛等[11]对我国南方某铀尾矿库坝土壤中的细菌和古菌群落结构进行考察,筛选出了5种耐铀菌属。Yan 等[12]使用变性梯度凝胶电泳法(DGGE)分析了我国东南某铀厂尾矿的土壤微生物多样性,发现铀尾矿中土壤的放射性核素分布规律对微生物多样性有深远的影响。Sánchez-Castro等[13]从位于法国的Bessines-sur-Gartempe 铀尾矿库分离出2 种耐铀菌株,并评估了它们在铀生物修复中的潜能。此外,Radeva 等[14]调查了位于保加利亚的“Sliven”铀矿废料堆和“Buhovo”铀矿区土壤中古菌群落的多样性。然而,国内外对铀尾矿库古菌多样性以及群落结构的研究较少,对古菌与尾矿库土壤环境因子的响应知之甚少。位于我国新疆北部的某退役治理尾矿库,库区内尾矿渣上方已进行了1 m 的覆土,覆土来源于尾矿库区周边土壤,该尾矿库退役10 多年后库区土壤古菌群落的结构状况有待研究。基于此,本研究以该尾矿库为研究对象,在前期研究基础上[2,7-8],通过16S rRNA扩增子高通量测序技术和生物信息学分析,研究铀矿冶尾矿库内外古菌多样性与群落分布特征,以及开展古菌群落结构对环境因子的响应研究,尝试从微生态-古菌群落视角,评估尾矿库退役治理效果,为构建铀尾矿库的微生态评价体系提供研究基础。
1 材料与方法
1.1 研究区域概况
铀矿冶尾矿库位于新疆境内,为一座固体尾矿渣贮存库,2007 年完成了防渗层、表层覆土(约1 m)以及混凝土护坡等退役治理工程,退役尾矿库剖面图如图1所示。尾矿库所处位置平均海拔为926 m,库区内呈现北高南低、西高东低的走势,混凝土护坡修建于尾矿库地势较低的东北方向,尾矿库东南方向为丘陵地带且紧邻山体,研究区域面积约20 000 m2。尾矿库及其周边地表土壤植被稀少,气候干燥少雨,日照充足,气温变化幅度较大,库区所在位置远离地表水源、耕地和畜牧地带[7]。尾矿库的具体点位图见文献[7]。
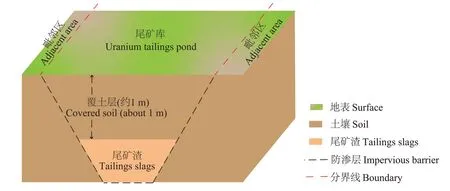
图1 退役尾矿库剖面图Figure 1 Profile view of the decommissioned tailings pond
1.2 样品采集与处理
土壤样品的采集工作于2019年8月完成,尾矿库内及毗邻区域共设置了7 个采样点,在垂直方向0~5 cm 与5~15 cm 两个不同深度采集土壤样品。鉴于退役治理过程中矿渣上方覆土来自库区周边土壤,选取尾矿库毗邻区域土壤的采样点位作为对照样本,具体的采样点位和方法见参考文献[7-8]。尾矿库内和毗邻区域分别设置4 个和3 个采样点位。其中,尾矿库内:0~5 cm 深度的采样点命名为TS1、TS2、TS3、TS4,5~15 cm 深度的采样点命名为TX1、TX2、TX3、TX4;尾矿库毗邻区域:0~5 cm 深度的采样点命名为CS1、CS2、CS3,5~15 cm 深度的采样点命名为CX1、CX2、CX3,毗邻区布点与尾矿库边缘的距离为15~35 m。基于上述样点分布,每个采样点附近随机采集等量的3 份土壤,经现场无菌操作混匀后装入无菌的采样袋中,共采集42(7×2×3)个土壤样品,样品被分为4个样品组(TS 组、TX 组、CX 组、CS 组)。每个采样点样品被分成3 份,一份用于分析土壤中放射性核素含量,一份用于测定土壤理化性质和重金属/类金属含量,一份用于分子生物学分析。其中,用于分子生物学分析的样品,使用车载冰箱恒温保存运回实验室,存入超低温冰箱(-80 ℃)用于后续DNA提取。
1.3 测定与分析方法
1.3.1 土壤中放射性核素比活度的测定
土壤样品中天然放射性核素(238U、232Th 与40K)的比活度测定使用γ 射线光谱法,能量刻度和效率刻度参考《高纯锗γ 能谱分析通用方法》(GB/T 11713—2015),放射性核素特征峰的能量选择和估算参考《土壤中放射性核素的γ 能谱分析方法》(GB/T 11743—2013)和相关文献[7,15]。样品中详细的天然放射性核素的测定结果见参考文献[7]。
1.3.2 土壤理化参数与重金属/类金属的测定
土壤样品理化参数测定项目主要包括:土壤pH值、EC(电导率)、TN(总氮)、TOC(总有机碳)、TP(总磷)。其中,土壤pH 值的测量方法为土壤水浸法,测定流程参考《土壤检测 第2 部分:土壤pH 的测定》(NY/T 1121.2—2006)和相关文献[16];土壤EC 的测定采用电极法,测定步骤参考《土壤电导率的测定电极法》(HJ 802—2016)和相关文献[17];土壤中的TOC、TN和TP 分别使用重铬酸盐氧化法、半微量凯氏定氮法和钼锑抗分光光度法,测定过程参考《土壤有机碳的测定重铬酸钾氧化-分光光度法》(HJ 615—2011)和相关文献[18-19]。
土壤样品中重金属/类金属的检测主要包括Cr、Zn、Pb、Cd及类金属As。土壤样品中Cr、Zn、Pb、Cd及类金属As的测定采用电感耦合等离子体原子发射光谱法(ICP-AES)[20]。
详细的土壤理化参数、重金属/类金属的测定与分析结果见参考文献[8]。
1.4 DNA提取和高通量测序
使用CTAB 方法提取土壤样品的总DNA[21],DNA的浓度和纯度使用1%的琼脂糖凝胶进行电泳分析,使用无菌水将DNA 稀释至1 ng·μL-1。将稀释后的基因组DNA 作为模板,应用引物519F(5'-CAGCCGCC-GCGGTAA-3')和引物915R(5'-GTGCTCCCCCGC-CAATTCCT-3')进行聚合酶链反应(PCR),扩增新古菌的V4 区[22]。使用琼脂糖凝胶对PCR 的产物进行电泳检测,同时依据检测结果将产物混样,之后使用Qiagen 凝胶提取试剂盒(Qiagen,德国)对混合的产物进行纯化处理。
按照TruSeq®DNA PCR-Free 建库试剂盒(Illumi-na,美国)产品说明进行测序文库构建,经过Qubit®2.0 荧光计(Thermo Scientific)和Agilent 2100 生物分析系统进行质量评估,评估达标后,在Illumina Nova-Seq 平台上对文库测序。高通量测序工作由北京诺禾致源生物信息科技有限公司完成。
1.5 数据处理与分析
以PCR 扩增引物序列和标签(Barcode)序列为参考,从下机的数据中分出每个样本的序列(reads),用FLASH(V1.2.7)截断每个样本的标签和引物序列,合并双端序列,最终得到拼接序列(Raw Tags)[23],随后使用QIIME(V1.9.1)对Raw Tags 进行筛选得到高质量的Tags数据(Clean Tags)[24-25],紧接着使用UCHIME算法将Tags数据与参考数据库(Silva)进行比较,检测并去除嵌合体序列后得到有效数据(Effective Tags)[26-27]。使用ASV 非聚类去噪法Denoise[28](基于Usearch 10.0 软件的Unoise 3 功能)对所有样本的全部Effective Tags 进行去噪并生成ASV。使用Vsearch软件生成特征表,基于SILVA138.1[29]的SSUrRNA 数据库[30]进行物种注释分析。
α 多样性和β 多样性分析通过QIIME(V1.9.1)软件[25]和R 软件(V4.2.1)完成。数据整理工作借助Ex-cel 2016 软件完成,单因素方差分析通过Minitab 20完成。利用R 语言中的“vegan”包进行主坐标分析(PCoA)、基于距离的冗余分析(db-RDA)和方差分解分析(VPA)[31-32]。db-RDA 前,先使用方差膨胀因子对环境因子进行共线性分析并剔除共线性较强的环境因子[31-34];其次对RDA 模型进行校正和检验,使用R 语言“vegan”包中的“orddiR2step”函数对模型进行前向选择,同时使用R 语言“ggplot2”程序包完成相应数据的可视化[32,35-38]。
2 结果与分析
2.1 古菌16S rRNA扩增子文库构建与分析
基于采集的42个铀矿冶尾矿库及其毗邻区域0~5 cm 与5~15 cm 两个不同深度土壤样品,利用高通量测序,过滤低质量和短长度的序列,去嵌合之后共得到421 002条古菌16S rRNA 有效基因序列,片段长度范围为278~410 bp,平均片段长度为373 bp,物种注释到的序列数为311 079,最终得到248 个古菌ASV代表序列。
2.2 土壤样品古菌的相对丰度
基于SILVA数据库物种注释结果可知,样品中的古菌共聚类到10 个门、17 个纲、19 个目、22 个科、32个属、10 个种。在门和属水平上,分别选取平均相对丰度大于1%的土壤古菌种群作为优势门和优势属,并对其进行相对丰度和差异分析。铀尾矿库内外7个采样点位分布于2个不同垂向深度的4个样品组土壤古菌在门和属水平占优势种群的相对丰度如图2所示。在门水平上,Crenarchaeota(泉古菌门)、Euryar-chaeota(广古菌门)、Halobacterota 菌门和一个未分类菌门(unidentified_Archaea)为相对丰度较高的优势菌门。在属水平上,相对丰度较高的菌属分别为Candi-datus_Nitrocosmicus(亚硝化侏儒菌属)、Methanobacte-rium(甲烷杆菌属)、Candidatus_Nitrososphaera菌属。

图2 土壤样品中优势古菌类群相对丰度柱状图Figure 2 Histogram of relative abundance of dominant archaeal groups in soil samples
在门水平上,Crenarchaeota 菌门的相对丰度最高,是研究区域内分布最丰富的菌门,其他3 个优势菌门丰度相对较低,且在研究区域内分布不均匀。尽管研究区域内4 个优势菌门在不同土壤样品组中的相对差别较大,分布不均匀,但通过单因素方差分析发现,4 个优势菌门的相对丰度在样品组间未呈现显著性差异(P>0.05)。
在属水平上,3 个主要优势属在研究区域内也呈现不均匀分布,但仅Candidatus_Nitrocosmicus菌属在CX 和TX 组间呈现显著性差异(P<0.05),其他优势菌门样品组间相对丰度未呈现显著性差异(P>0.05)。
通过对研究区域内优势古菌门和属在不同样品组中相对丰度的分析可知,该铀尾矿库经退役治理后,尾矿库内与其毗邻区域土壤中的古菌群落结构基本一致。
2.3 土壤古菌群落多样性分析
2.3.1 土壤古菌α多样性分析
为了了解尾矿库库区及毗邻区域土壤古菌群落物种的丰富度和均匀度,选取研究区域内土壤古菌群落α 多样性进行分析,分析结果见表1。由表1 可知,尾矿库内(TS、TX)土壤古菌群落的Chao1 指数、ACE指数、Shannon 指数分布范围为1 618.32~2 537.74、1 662.80~2 520.83、6.98~9.09。毗邻区域(CS、CX)土壤古菌群落的Chao1 指数、ACE 指数、Shannon 指数分布范围为1 086.81~2 443.87、1 160.55~2 460.18、6.51~8.80。

表1 铀尾矿库及其毗邻区域土壤古菌群落α多样性指数Table 1 Alpha-diversity indexes of soil archaeal community in uranium tailings pond and its adjacent area
为更直观地了解尾矿库区与毗邻区域古菌群落的α 多样性指数分布,研究区域4 个样品组α 多样性指数的箱线图如图3 所示。由图3 可知,TS、TX、CS、CX 点位土壤中古菌群落的Chao1 指数、ACE 指数、Shannon 指数均未呈现显著性差异(P>0.05),表明该尾矿库经退役治理后,尾矿库内与毗邻区域表层土壤(0~15 cm)古菌群落多样性不存在显著差异。

图3 尾矿库区及其毗邻区域土壤古菌群落α多样性指数箱线图Figure 3 Boxplots of alpha-diversity metrics of soil archaeal community in tailings pond and its adjacent area
2.3.2 土壤古菌β多样性分析
采用基于Unweighted Unifrac 距离的PCoA 分析尾矿库库区及毗邻区域土壤古菌群落的分布。如图4 所示,尾矿库内土壤点位与毗邻区域土壤点位的古菌群落分布未呈现明显分离。PCoA 第一坐标轴对总变异的贡献率为20.48%,而PCoA 的第二坐标轴仅解释了总方差的15.77%。第一轴与第二轴并未将尾矿库及毗邻区域不同土壤点位古菌群落进行明显区分,这进一步说明该尾矿库经退役治理后,尾矿库库区内外的土壤古菌群落组成具有相似性。

图4 尾矿库区及其毗邻区域土壤样品组间古菌群落的主坐标分析(PCoA)Figure 4 PCoA of the main coordinates of archaeal community among soil samples in tailings pond and its adjacent area
2.4 土壤环境因子与古菌群落的相关性分析
为了掌握尾矿库及其毗邻区域土壤环境因子对古菌群落的影响,选取相对丰度前4 的优势古菌门和属,分析土壤放射性核素、理化参数和重金属/类金属与门、属水平前4 丰度古菌间的Pearson 相关系数,基于该系数绘制相关性热图(图5)。由图5 可知,研究区域土壤环境因子中TN、TP、pH、Cd、232Th 是影响该区域土壤中主要古菌群落的重要环境因子。在门水平上,Crenarchaeota 菌门与土壤中TN 的含量呈显著正相关(P<0.05)。Euryarchaeota 菌门与土壤中TP 的含量、pH、Cd 的含量呈显著正相关(P<0.05),而与土壤232Th 的比活度呈显著负相关(P<0.05)。在属水平上,Candidatus_Nitrososphaera菌属与土壤TN 含量呈显著正相关(P<0.01),Candidatus_Nitrocosmicus菌属与土壤232Th 比活度呈显著正相关(P<0.05)。属于Euryarchaeota 菌门的Methanobacterium菌属与土壤TP含量、pH、Cd 含量呈显著正相关(P<0.05),与土壤中232Th比活度呈显著负相关关系(P<0.05)。
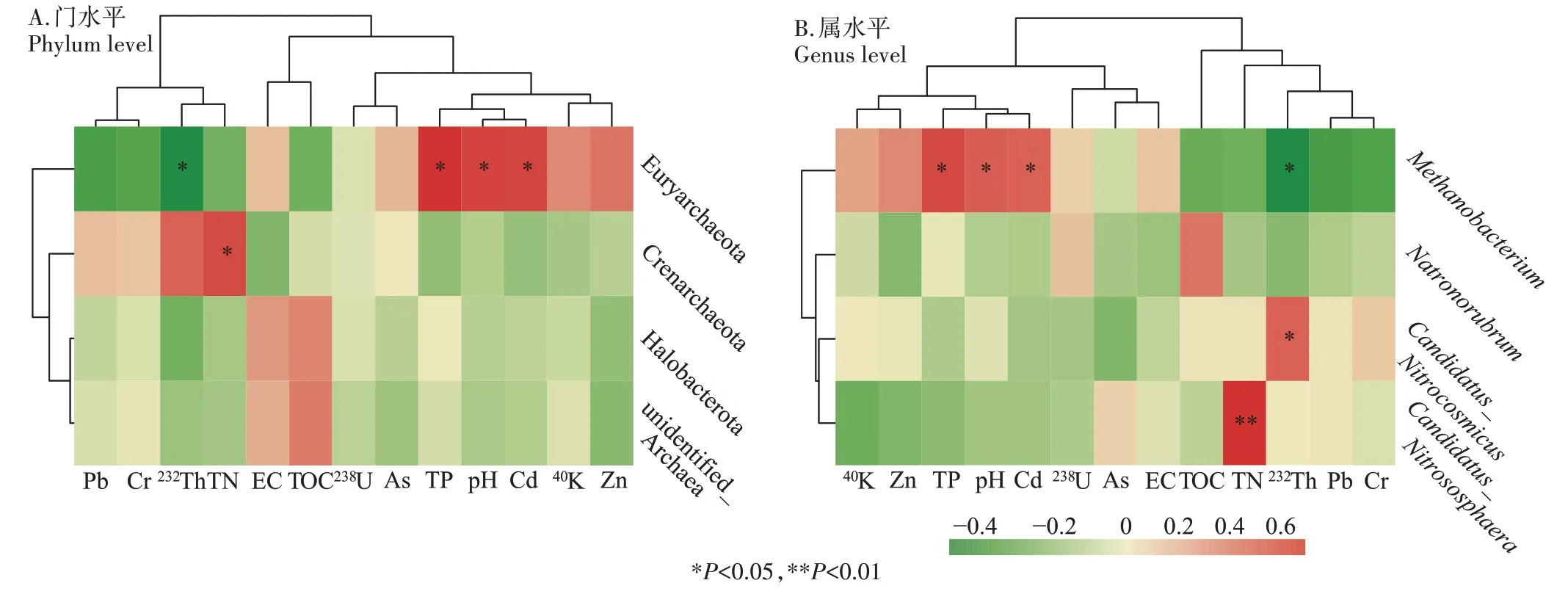
图5 尾矿库及其毗邻区域土壤环境因子与主要古菌群落相关性热图Figure 5 Heat map of correlation between soil environmental factors and major archaeal communities in tailings pond and adjacent area
为了更深入地揭示影响尾矿库土壤古菌群落的主要环境因子,对环境因子与尾矿库内外所有古菌ASV 进行基于距离的db-RDA,使用方差膨胀因子对所有13 个环境因子进行共线性分析,依次删除As、K、Pb 3 个共线性较强的环境因子,对剩余10 个环境因子依次进行R2校正、约束轴置换检验和P值校正,然后对模型进行前向选择,以选择与尾矿库及毗邻区域土壤古菌群落相似矩阵(Bray-Curtis)显著相关的环境因子。最终保留了232Th、pH、TN、TOC、EC 共5个显著影响尾矿库古菌物种群落的环境因子(P<0.05)。前向选择后的db-RDA 结果显示(图6A),67.37%的总变差可以由232Th、pH、TN、TOC、EC因子解释。232Th与大多数古菌物种(ASV)呈显著负相关,图中尾矿库内外采样点位并未出现明显分离,这也再一次验证了库区内外土壤古菌群落组成具有相似性的结论。为了揭示主要环境因子对群落结构变化的相对贡献,基于db-RDA 模型进行VPA(图6B)。由图6(B)可知,土壤理化因子(pH、TN、TOC、EC)比放射性核素232Th解释了更多的物种差异方差,两者解释了古菌52.35%的总变差,它们之间的相互作用解释了6.00%的总变差。
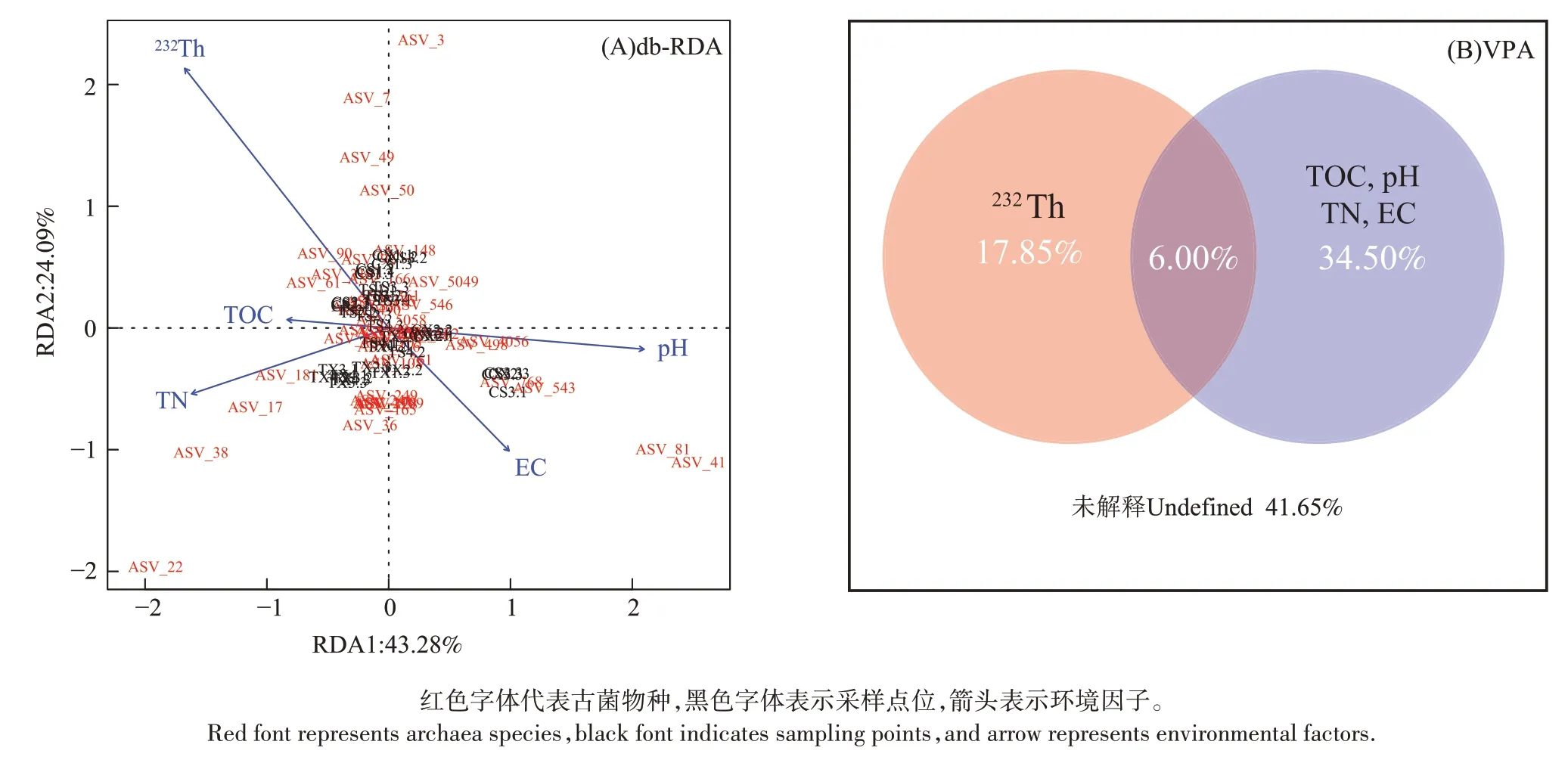
图6 尾矿库及毗邻区域土壤古菌物种(ASV)与环境因子关系的冗余分析和方差分解分析Figure 6 Distance-based redundancy analysis(db-RDA)and variance partitioning analysis(VPA)of the relationship between soil archaeal species(ASV)and environmental factors in tailings reservoirs and adjacent areas
3 讨论
经治理后的铀尾矿库作为一个潜在的风险源,可能会受到自然或人为因素的干扰,导致放射性核素和重金属/类金属的迁移和扩散,从而影响尾矿库及其周围环境的质量和公众健康[7-8]。鉴于可以快速反映土壤环境质量变化,古菌可被选为反映土壤环境质量的指标[39]。通过对该铀尾矿库及毗邻区域土壤古菌群落的研究,探索土壤环境因子与古菌群落的相互关系,及时发现放射性核素、重金属/类金属的迁移和扩散,从微生态-古菌视角评估尾矿库退役治理效果,对维护尾矿库及其周围生态环境安全和公众健康具有十分重要的意义。
研究发现,该尾矿库及其毗邻区域土壤属于碱性土壤[8],Navarro-Noya 等[40]对异质高盐碱性土壤中古菌多样性的研究发现,在高碱性土壤中Candida-tus_Nitrososphaera及其相近菌属为优势菌群,这与本研究的发现相一致。Tripathi 等[41]发现土壤pH 值能影响氨氧化古菌的丰富度和多样性。氨氧化古菌分类群都适应中性或微碱性的条件[42]。本研究中属于氨氧化古菌的Candidatus_Nitrocosmicus菌属、Candi-datus_Nitrososphaera菌属为研究区域土壤中的优势菌属,表明这两种菌属能较好地适应碱性土壤。Crenar-chaeota 菌门广泛分布在海洋和陆地生境中,在pH 和温度适中的各种水生和陆地环境中,该菌门均为优势菌群[43]。对该尾矿库及毗邻区域进行古菌多样性分析发现,Crenarchaeota菌门是第一优势菌群,表明尾矿库与其周边区域土壤环境具有普遍性。魏天娇等[44]发现氮元素对氨氧化古菌具有促进作用,本研究也发现属于氨氧化古菌的Candidatus_Nitrososphaera菌属与TN呈极显著正相关,这也为氮元素对氨氧化古菌的促进作用[42]提供了合理的论据。Kotelnikova等[45]发现碱性湖泊沉积物中分离出来的甲烷杆菌的最佳pH是在8.1~9.1之间,尾矿库所在区域pH范围为7.79~9.23,这解释了在尾矿库土壤古菌样品中出现了丰度较高的Methanobacterium属的原因。
通过对尾矿库及毗邻区域土壤古菌群落结构多样性分析可知,库区内、外土壤古菌多样性和丰富度具有相似性,说明尾矿库与周边区域的土壤环境从微生态-古菌视角看已无明显差异。尽管土壤pH、TN、TOC、232Th、EC 是影响研究区域土壤中古菌群落的主要环境因子,但这些环境因子的测定值均处于当地土壤的背景值范围内,并未显著影响库区内外土壤古菌群落结构。反之,土壤古菌群落结构的变化未反映出该尾矿库中放射性核素、重金属/类金属的迁移和扩散,微生态-古菌视角与前期该尾矿库宏观生态评价相一致[7-8]。
4 结论
(1)在门和属水平上,Crenarchaeota(泉古菌门)、Euryarchaeota(广古菌门)、Halobacterota 菌门和一个未分类菌门(unidentified_Archaea)为相对丰度较高的优势菌门。Candidatus_Nitrocosmicus(亚硝化侏儒菌属)、Methanobacterium(甲烷杆菌属)、Candida-tus_Nitrososphaera菌属为相对丰度较高的优势菌属。尽管尾矿库内与其毗邻区域土壤中优势菌群呈现不均匀分布,但尾矿库内外土壤优势古菌群落结构基本已无显著差异。
(2)土壤古菌群落多样性分析发现,尾矿库内与毗邻区域表层土壤(0~15 cm)古菌菌落多样性已不存在差异,土壤古菌群落组成具有相似性。
(3)土壤pH、TN、TOC、232Th、EC 是影响库区内外优势古菌群落的主要环境因子,但这些因子并未造成库区内外土壤古菌群落结构的显著改变。
(4)尾矿库与毗邻区域的土壤古菌群落已无明显差异,说明尾矿库内外土壤古菌群落并未受到放射性核素、重金属/类金属的显著影响,意味着放射性核素、重金属/类金属未发生迁移和扩散,这与前期宏观生态视角的评价结果一致。