持续污染下洛克沙胂在土柱中的迁移转化及其风险评估
2023-07-13杨学磊赵心怡刘雅慈
杨学磊,赵心怡,刘雅慈
(1.河北正润环境科技有限公司,石家庄 050061;2.河北水文工程地质勘察院有限责任公司,石家庄 050061;3.中国地质科学院水文地质环境地质研究所,石家庄 050061;4.福建省水循环与生态地质过程重点实验室,福建 厦门 361000)
洛克沙胂(Roxarsone,ROX)是一种低毒化合物,在世界范围内被广泛用作禽畜饲料添加剂,用于促进家畜生长、增强肉类色素沉着和对抗肠道寄生虫。然而,大于95%的ROX 通过家禽尿液和粪便排泄到环境中[1],家禽粪便通常露天堆积或施于农田,ROX 进入环境后能够在生物作用和非生物作用下迅速降解转化为无机砷。虽然ROX 毒性较低,但其降解产物As(Ⅲ)、As(Ⅴ)、二甲基胂酸(DMA)、甲基胂酸(MMA)、3-氨基-4-羟基苯胂酸(HAPA)和其他砷化合物的危害更大[2]。无机砷[I-As,包括As(Ⅲ)和As(Ⅴ)]化合物不仅毒性更大,而且比ROX 更具流动性[3]。家禽粪便的土地利用将砷化合物引入环境,并增加砷污染土壤和水的风险[4-5],同时,施用含ROX 的肥料可显著提高植物对不同砷的吸收,这些植物包括水稻、蔬菜等[6-7]。例如:利用含有ROX 及其代谢物的鸡粪改良土壤,土壤生物质量降低,在此土壤中生长的萝卜组织中发现了As(Ⅲ)、As(Ⅴ)和DMA,且其中砷含量随着鸡粪施用量的增加而增加[8-9]。考虑到人类和环境健康问题,欧盟(1999 年)、美国(2013 年)和我国(2018 年)禁止使用ROX。然而,许多国家,包括墨西哥、印度和阿根廷仍然允许使用[10],而且,ROX使用了几十年,已经导致环境中大量砷的积累。因此,有必要研究ROX进入土壤后的环境归宿。
ROX 可以在生物和非生物作用下转化。微生物在ROX 降解中起着关键作用[11],在厌氧或好氧环境条件下可以将ROX 转化为不同的砷化合物。ROX 和微生物之间有着密切的关系,ROX 可以促进微生物生长,反过来,微生物可以更快地降解ROX[12]。在厌氧条件下,ROX 可在鸡粪富集物中被Clostridium快速转化,主要产物为HAPA 和I-As[13],分离出的第一个能够转化ROX的厌氧细菌是嗜碱菌Alkaliphilus orem-landiiOhILAs[14]。另外两种菌株Shewanella oneidensisMR-1 和Shewanella putrefaciensCN32 也 可 以 在厌 氧条件下转化ROX[15-16]。在好氧条件下,从砷污染的水稻土中分离出一株纯培养的细菌Enterobactersp.CZ-1,并确定了一种ROX 生物转化的新途径,其中ROX首先被还原为HAPA,然后乙酰化为N-AHPAA[17]。除微生物作用外,光照可使ROX发生光降解或光催化氧化转化,随着光强的增大,ROX 降解效率逐渐提高。紫外线(UV)与其他氧化剂可形成高级氧化工艺,更加高效降解去除ROX,例如UV/Cl[18]、UV/ZnO[19]、UV/TiO2[20]、UV/H2O2[21]、UV/赤铁矿/草酸系统[22]。
因为砷酸官能团的存在,ROX 在土壤中的吸附表现出和As(Ⅴ)相似的性质,土壤中的金属氧化物和黏土矿物等对ROX 均有很强的吸引力,而且土壤的理化性质对吸附过程都有影响[23]。影响ROX 吸附的环境因素包括:矿物类型、金属离子、离子强度、pH值、溶解性有机质(DOM)等。吸附法被认为是处理ROX 污染的一种经济且有效的方法,然而,对ROX 的吸附若要达到吸附平衡通常耗费时间比较长,此外,与有机砷相比,通过吸附去除无机砷更彻底,且技术更成熟,因此,ROX 的去除往往将吸附与降解或氧化相结合进行,首先由降解或光照氧化产生无机砷,进而通过吸附材料对生成的无机砷进行吸附,以达到彻底去除砷的目的[24]。
向土壤中施用含ROX 的禽畜粪便,会对土壤、水和植物造成砷污染的风险,因此有必要调查ROX 进入环境后造成的砷污染。以往的研究多集中于ROX的转化或吸附,而对迁移的研究较少,尤其是在ROX持续污染的情景下,对ROX 诱发砷污染和迁移的全过程缺乏研究。本研究通过一维土柱实验探究ROX持续污染的前提下,垂向包气带上砷化合物形态和含量的时空变化,揭示ROX 使用导致的生态风险,提高人们规范使用饲料添加剂的意识,并重视对禽畜废弃物的科学处理。
1 材料和方法
1.1 化学试剂
ROX(纯度>98%,CAS No.:121-19-7,分子式:C6H6AsNO6,分子质量:263.04)购自迈瑞达科技有限公司(北京)。As(Ⅲ)、As(Ⅴ)、MMA、DMA 标准溶液购自中国计量科学研究院(北京)。色谱级甲醇购自Thermo Fisher Scientific(美国)。其他化学试剂都是优级纯。
1.2 土壤样品的收集和土柱填充
试验土壤采自位于山东聊城市阳谷县的一片没有经过人类活动的树林,进行后续柱模拟试验。清除带有杂草和树叶的表层土壤,采集0~50 cm 深度的土壤,清除树根、树叶和砾石,充分混匀。将混匀后的土壤放入密封袋中带回实验室,自然风干后进行土柱装填。土壤经鉴定为粉土,溶液渗透缓慢。
模拟柱为长100 cm,内径8 cm 的有机玻璃柱(图1),土柱内壁均匀涂抹凡士林以防止侧壁优势流,底部放尼龙网。从下向上先装填10 cm 高的石英砂,再装填70 cm 高的过20 目筛的背景土,按野外实际测得容重分层填充,每装填5 cm 后打毛表层,再继续填充;装填完70 cm 高度后再填充5 cm 的石英砂,使最上端溢流口距石英砂表面5 cm,以保证进水均匀淋滤。从上到下每隔10 cm开1个孔(编号①~⑨),在②~⑨号孔中插入土壤溶液取样器,用来在不同时间进行取样。土柱外面包裹铝箔纸,排除光照作用。

图1 模拟土柱示意图Figure 1 Schematic diagram of soil column
1.3 实验流程
土柱装填完成后,从土柱底部缓慢向上通沸腾后冷却的去离子水,以驱除土柱中的气体,当溢水口出现溢流时停止。待土柱稳定后,使用蠕动泵从上向下通入配制好的ROX 溶液(200 mg·L-1),通入溶液中的ROX 浓度高于一般自然环境中的ROX 浓度,以保证进入到土壤后的ROX 达到一定浓度水平,使得结果更加显著。模拟过程中定期于侧壁的取样孔通过土壤溶液取样器进行土壤溶液取样,检测ROX、DMA、MMA、As(Ⅲ)和As(Ⅴ)。模拟过程持续了157 d,待实验结束后在每个侧壁取样孔进行不同深度的土壤取样,检测砷化合物形态和微生物多样性。
1.4 样品中砷形态的提取方法
为保证土壤中砷形态不改变,冷冻干燥土壤样品,研磨后过200 目筛,取4 g 土壤加入由0.1 mol·L-1H3PO4和0.1 mol·L-1NaH2PO4·2H2O 按体积比1∶9 混合配制成的提取液20 mL,55 ℃水浴10 h,超声10 min,10 000 r·min-1离心5 min,取上清液过滤后待测。此方法在国内外相关研究中经常用于提取土壤中ROX 以及其他砷形态,经测试具有较高的提取率[25]。水样直接用0.22µm滤膜过滤后上机检测。
1.5 砷化合物的检测
利用高效液相色谱仪(HPLC-2030C 3D,岛津,日本)对ROX进行检测,ROX标准样品购自Dr.Ehrenstor-fer(奥格斯堡,德国),纯度>99%,检测所用色谱柱为C18(5 µm,4.6 mm×250 mm),流动相为0.05 mol·L-1KH2PO4∶甲醇∶甲酸=9∶0.9∶0.1 的混合液,检测波长为254 nm,柱温30 ℃,流速1.0 mL·min-1,进样量20µL。
样品中As(Ⅲ)、As(Ⅴ)、DMA、MMA 的含量使用高效液相-氢化物发生-原子荧光色谱仪(HPLC-HGAFS,北京吉天仪器有限公司)进行检测。标准溶液均购自中国国家标准物质中心。色谱柱为C18 柱(ODS3,250 mm×4.6 mm,5 µm),流动相为10 mmol·L-1NaH2PO4,pH 调至6.2,流速1.0 mL·min-1,载流7%HCl,还原剂20 g·L-1KBH4+5 g·L-1KOH,灯电流100 mA,负高压285 V,载气400 mL·min-1,屏蔽气600 mL·min-1。
1.6 微生物多样性检测分析
模拟实验结束后的土壤送往美吉生物医药科技有限公司(上海)进行微生物多样性检测,16S rRNA基因引物选择515F(5'-GTGCCAGCMGCCGCGG-3'),907R(5'-CCGTCAATTCMTTTRAGTTT-3'),测序数据经拼接、质控去接头获得优化序列,然后进行OTU聚类,获得OTU丰度表用于后续生信分析。
1.7 人类健康风险评估
无机砷是I 类致癌物质,利用健康风险评价模型对持续ROX 污染诱发砷的致癌风险进行分析,健康风险评价模型来自《污染场地风险评估技术导则》(HJ 25.3—2014),计算公式和具体参数选择参考本团队已发表成果[4]。
2 结果与讨论
2.1 不同深度土壤溶液中ROX浓度变化
在157 d的ROX 持续污染模拟过程中,ROX 仅聚集在土壤表面0 cm(侧壁②号取样孔)和10 cm(侧壁③号取样孔)深度处(图2),距离土壤表面20 cm 深度以下只有5 次有微量检出,可知ROX 迁移速度较慢。土壤表面0 cm 的ROX 浓度在60 d 之前稳定在180~190 mg·L-1,60~130 d 的ROX 浓度稳 定在140~150 mg·L-1,130 d以后ROX浓度迅速上升。10 cm深度的ROX 浓度缓慢上升,最高浓度为130 d 的73.44 mg·L-1。尽管ROX 持续以200 mg·L-1的浓度输入,但土壤溶液中均没有出现超过200 mg·L-1的浓度累积,而且10 cm 深度ROX 浓度显著低于0 cm,证明ROX 降解速率较高,显著高于迁移速率,ROX 的降解与吸附均发生在土壤浅层。
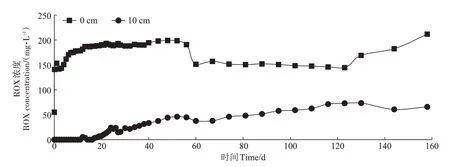
图2 土壤表面0 cm和10 cm深度处的ROX浓度变化Figure 2 Concentration variation of ROX at 0 cm and 10 cm depth
土壤中ROX降解较快,且ROX添加浓度越高,降解速率就越快[26]。在ROX 单次污染的土柱模拟过程中,土壤表面的ROX 在7 d 内即可降解完全[27]。在室温、厌氧条件下,从畜禽粪便中用水萃取出的ROX 在48 h 内被转化成不同的砷化合物[28]。本实验中,在持续ROX 污染的前提下,土壤表面ROX 没有发生持续增加的现象,也进一步证明ROX 降解较快。有研究显示树木园土对ROX 的饱和吸附量为1 250 mg·kg-1[29],本实验所用土壤同样为树木园土,有机质含量较高,对ROX 吸附量较大,157 d 的模拟实验过程,ROX 不断被土壤表面所吸附,随后在微生物作用下持续发生降解,吸附与降解同时动态发生,在二者的综合作用下,ROX仅迁移至10 cm深度。
2.2 不同深度土壤溶液中无机砷浓度变化
模拟过程中DMA、MMA仅有微量检出,可忽略不计,ROX降解产物主要为As(Ⅴ)和As(Ⅲ),As(Ⅴ)浓度明显高于As(Ⅲ)。生成的无机砷主要聚集在10~20 cm 深度(图3),40 cm 及以下深度仅检测到微量无机砷,说明无机砷均没有迁移到40 cm以下。

图3 持续添加ROX的模拟柱中不同深度土壤中As(Ⅴ)和As(Ⅲ)浓度随时间变化Figure 3 As(Ⅴ)and As(Ⅲ)concentrations of soil at different depths in the simulated column with continuous ROX addition over time
土壤表层0 cm 处的As(Ⅴ)浓度先上升,于50 d达到浓度最大(784 µg·L-1),50 d 以后浓度又迅速下降,直到157 d 模拟结束都是缓慢下降状态(图3)。10 cm 和20 cm 深度的As(Ⅴ)浓度显著高于其他深度,尤其在60 d以后,浓度处于上升状态。30 cm深度处的As(Ⅴ)浓度由稳定状态到显著增加,然后再迅速降低至接近于0。60 d 为一临界点,60 d 后0 cm 的As(Ⅴ)浓度显著降低,10~20 cm 深度的As(Ⅴ)浓度显著增加,证明此时0 cm 更多的As(Ⅴ)迁移至10~20 cm,与前面ROX 浓度变化相结合,60 d 后ROX 浓度有明显降低,也说明更多的ROX 降解产生As(Ⅴ)并迁移聚集在10~20 cm。
土壤表层0 cm 处的As(Ⅲ)浓度在实验开始到20 d过程中,由102.6µg·L-1一直处于迅速下降趋势,30~60 d 浓度增加,60 d 后浓度又呈下降趋势(图3)。10~20 cm 深度的As(Ⅲ)浓度显著高于其他深度,以60 d为转折点,60 d之前,As(Ⅲ)浓度处于较高状态;60 d之后,As(Ⅲ)浓度显著降低,一直处于较低状态。30 cm 深度处的As(Ⅲ)浓度在94 d 之前浓度很低,在94~143 d 期间As(Ⅲ)浓度显著增加,143 d 后浓度显著下降至接近于0。
在模拟实验过程中,0~30 cm 的深度聚集了主要的无机砷,土壤对砷的吸附固定能力较强,对砷起到吸附固定作用的主要成分为土壤有机质,不同种类的有机质对砷的吸附性能不同,腐殖酸(HA)由于分子量较大,吸附固定砷的能力较强,黄腐酸(FA)和可溶性有机质(DOM)与砷存在竞争吸附,促进砷的迁移[30]。ROX 经过 转化C—As 键可直接断裂优先生成As(Ⅴ),氧化条件下,砷主要以As(Ⅴ)存在;还原条件下,生成的As(Ⅴ)会转化为毒性更大的As(Ⅲ)[17]。As(Ⅲ)只有在强还原条件中占主导地位,而且在Eh>100 mV时会很快地转化为As(Ⅴ)[31],本实验中土壤表层0 cm为氧化条件,因此表层土壤中无机砷以As(Ⅴ)为主;持续新鲜水流供给氧气导致土柱深部也偏向于氧化条件,因此0~30 cm深度的无机砷也以As(Ⅴ)为主。
2.3 不同深度土壤中砷化合物浓度
实验结束后对不同深度土壤中ROX 和无机砷进行检测(图4),结果显示ROX 主要存在于土壤表层0 cm(91.04 mg·kg-1),表层以下仅存在微量ROX,土壤中ROX 含量显著低于土壤溶液中,土壤溶液中ROX浓度更接近于外源输入的浓度。与土壤溶液中检测结果一致,土壤中无机砷以As(Ⅴ)为主,最高含量为20 cm 深度的126.06 mg·kg-1;As(Ⅲ)含量较少,最高为20 cm 深度的6.96 mg·kg-1。砷化合物均主要聚集在0~40 cm 深度,40 cm 以下仅存在微量的As(Ⅴ)和As(Ⅲ),不同深度土壤中砷化合物含量显著高于土壤溶液。
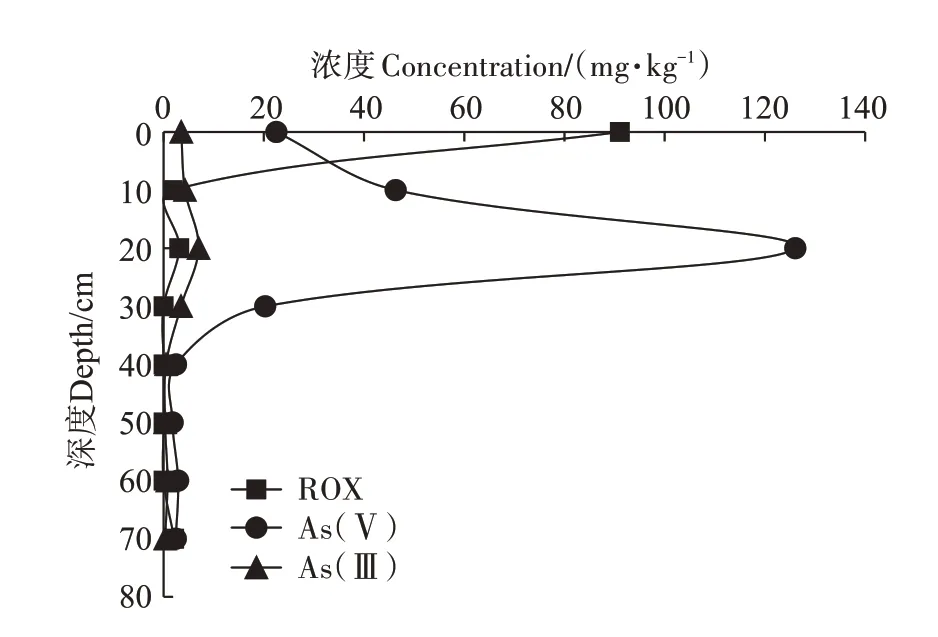
图4 模拟实验结束后不同深度土壤中的砷化合物浓度Figure 4 Arsenic concentration in soil at different depths after simulation experiment
砷化合物进入土壤后,小部分溶解于土壤溶液中,称为水溶性砷;部分吸附于土壤颗粒,称为吸附性砷;大部分转化为难溶性砷化合物,称为难溶性砷,包括铝型砷、铁型砷、钙型砷和闭蓄型砷。这也能够进一步解释本研究土壤中砷化合物浓度显著高于土壤溶液中砷化合物浓度的结果。砷化合物在土壤中的迁移能力受土壤物化性质影响较大,在土壤中,由于砷化合物与天然有机质结合或者发生配体交换等作用,会降低砷的移动性和生物有效性[32-33];同时,砷化合物也可与土壤中溶解性有机质(DOM)及氧化物形成复合体或胶体络合物,或发生竞争吸附作用,从而促进砷的迁移[34-35]。铁氧化物对ROX 与As(Ⅴ)有相似的吸附强度,表明ROX 的吸附是通过AsO43-官能团来进行的[28]。本实验中,砷化合物迁移能力在土壤物化性质抑制和促进的综合作用下,157 d 的最大迁移深度为40 cm。可见砷化合物在土壤中迁移速度十分缓慢,导致土壤一旦被砷污染,其长期危害难以消除。
2.4 不同深度土壤中微生物群落响应
2.4.1 不同深度土壤的微生物群落组成
模拟实验结束后,对不同深度土壤中的微生物群落组成进行了检测分析(图5)。不同土壤样品在门水平上拥有相同的优势物种,但优势物种的丰度各不同,土壤表面0 cm 门水平上组成与其他深度显著不同,土壤表面的Firmicutes丰度占比较高,Actinobacte-ria 占比较低,而10~70 cm 深度土壤中不同门的微生物占比相似。根据以往的研究报道,这些优势门的微生物均被发现与砷化合物有着密切关系。已有研究表明属于Proteobacteria 门的细菌种群具有抗砷系统和降解ROX 的作用,例如Acidithiobacillus caldus[36],Shewanella oneidensisMR-1[15]。Actinobacteria属 为 抗砷菌[37],Guzman-Fierro 等[38]发现在好氧条件下降解ROX的混合菌群最优势的门为Firmicutes。
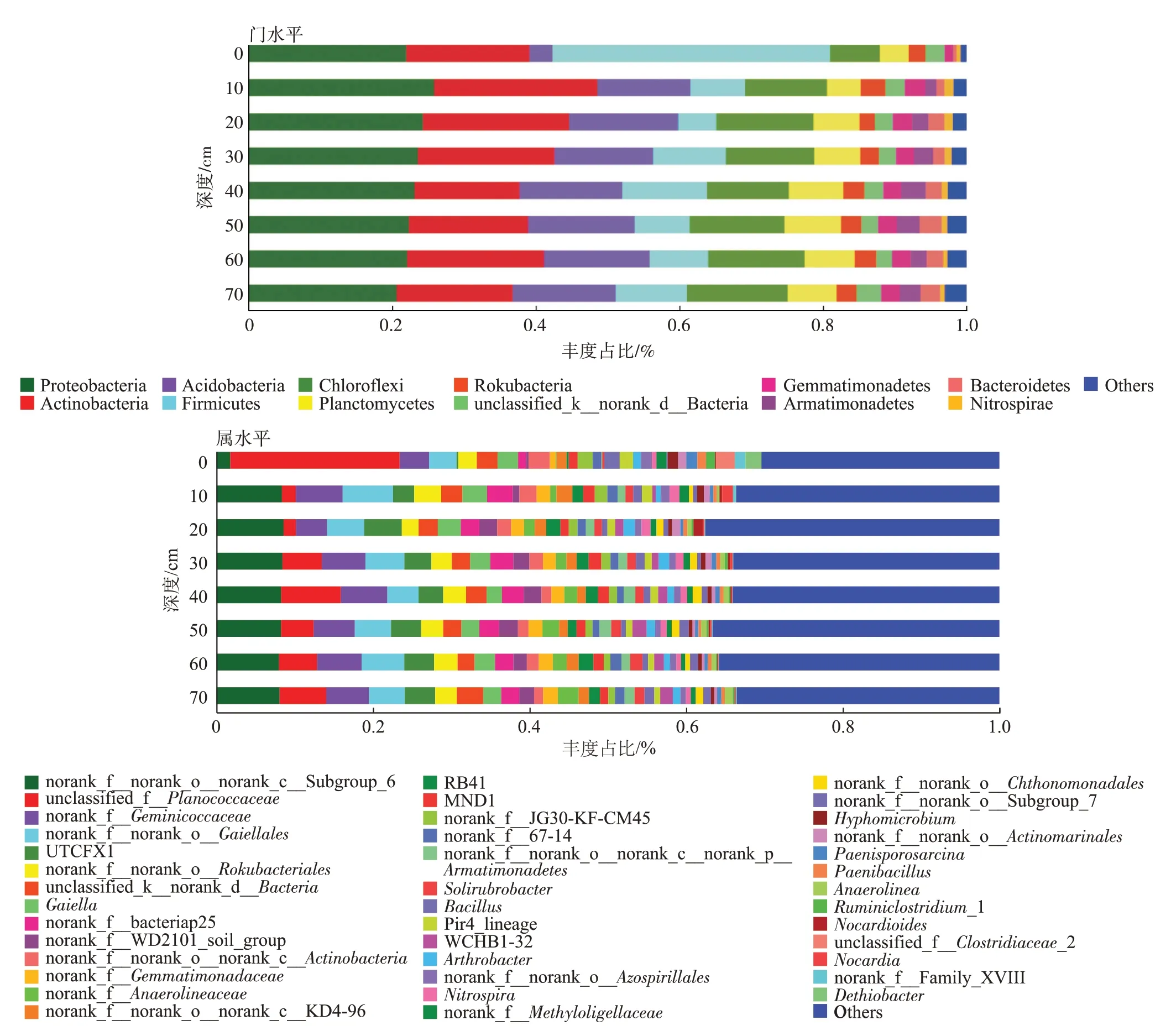
图5 不同深度土壤中的微生物群落组成Figure 5 Microbial community composition in soils of different depths
属水平上,不同深度土壤中的优势物种主要为c__Subgroup_6(14.64%~22.72%)、g__unclassified_f__Planococcaceae(1.58%~21.63%)、g__norank_f__Gemi-nicoccaceae(3.97%~5.94%)(图5),这些优势属的菌种均属于已检测到的优势门Acidobacteria、Firmicutes或Proteobacteria。与门水平规律相似,土壤表面0 cm 的微生物属水平上组成与其他深度显著不同,与其他深度相比,土壤表面的c__Subgroup_6 丰度占比较低,g__unclassified_f__Planococcaceae占比较高,而10~70 cm深度土壤中不同属的微生物占比相似(图6)。
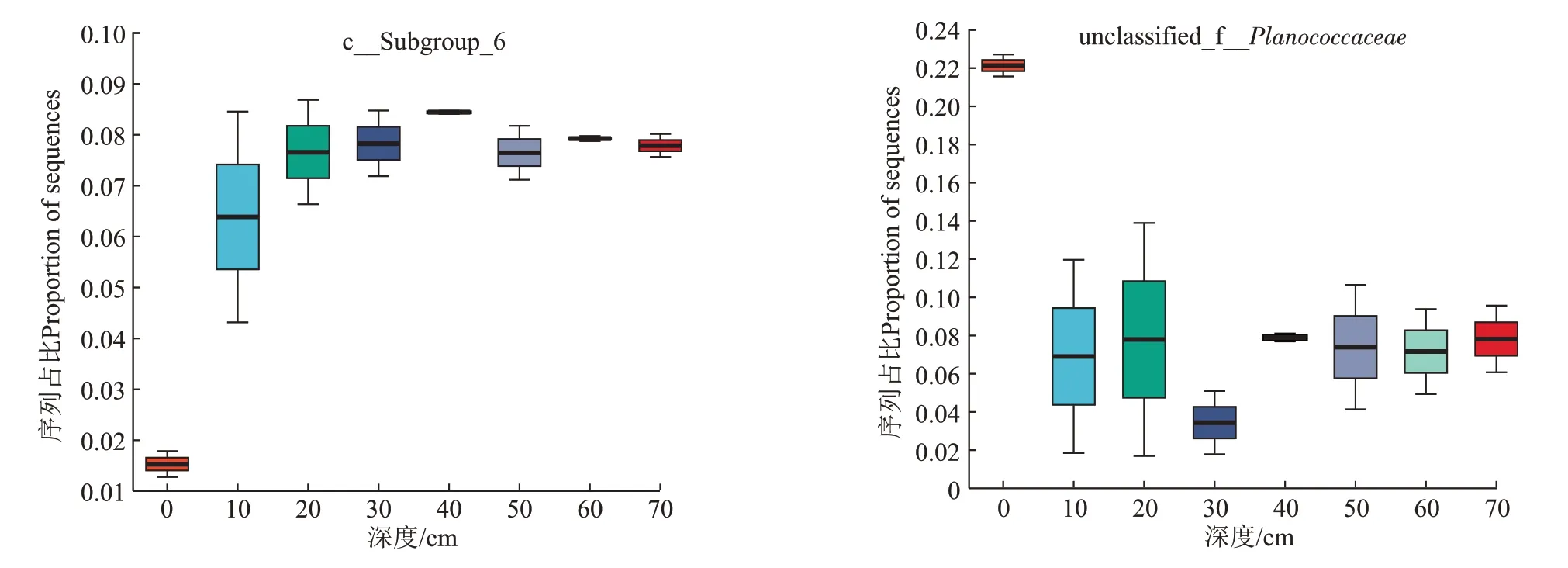
图6 优势属c__Subgroup_6和g__unclassified_f__Planococcaceae丰度随深度的变化Figure 6 Abundance variation of the dominant genera c__Subgroup_6 and g__unclassified_f__Planococcaceae with depth
2.4.2 土壤微生物群落组成与砷化合物的相关性研究
将不同深度土壤样品微生物群落结构与环境因子[深度、ROX 含量、As(Ⅲ)含量、As(Ⅴ)含量]进行相关性分析(图7),通过RDA(Redundancy Analysis)分析可知深度与ROX 含量、As(Ⅲ)含量显著负相关,ROX 含量和As(Ⅴ)含量显著负相关,As(Ⅲ)含量和As(Ⅴ)含量显著正相关。土壤表面0 cm 样品中微生物群落结构主要受到ROX 含量影响,10~20 cm 的微生物群落结构主要受到As(Ⅲ)含量和As(Ⅴ)含量的影响,40 cm 及以下深度的土壤微生物群落结构主要受到深度的影响。将前5 种优势物种与环境因子进行关系分析,土壤表层0 cm 中丰度最多的unclassi-fied_f__Planococcaceae与ROX 含量显著正相关,其他4 种 优 势 物 种(c__Subgroup_6、norank_f__ norank_o__Gaiellales、norank_f__Geminicoccaceae、UTCFX1)均与ROX 含量呈负相关关系,其中不同深度的优势物种c__Subgroup_6与深度、As(Ⅴ)含量呈正相关关系,c__Subgroup_6 在土壤表面丰度最低,证明其受到ROX抑制。

图7 环境因子与样本微生物群落结构之间的关系Figure 7 Relationship between environmental factors and microbial community structure in samples
通过置换多元方差分析(PERMANOVA),分析环境因子对样品差异的解释度,并进行显著性分析(表1)。对样品差异解释度最高的环境因子为ROX 含量(P<0.05),其次为深度(P<0.05)。结合RDA 分析,进一步证明不同深度土壤中微生物群落主要受到ROX含量和深度影响,这也是导致土壤表面(0 cm)微生物群落结构与其他深度显著不同的主要环境因素,其中以ROX含量较高为最主要因素。

表1 环境因子对样品差异的解释度Table 1 Explanation degree of sample differences by environmental factors
2.5 ROX持续污染诱发砷的健康风险评估
评估土柱表层土壤中无机砷浓度[As(Ⅲ)与As(Ⅴ)浓度之和]所引起的健康风险,主要的接触途径被确定为皮肤接触,因为人们经常在没有皮肤保护的情况下接触到受砷污染的表层土壤,评估对象包括儿童和成人。经计算,儿童和成人的平均每日暴露剂量(DED)为1.08×10-7kg·kg-1·d-1,表层土壤无机砷的浓度为26.03 mg·kg-1,致癌风险值计算为4.22×10-6,大于可接受的致癌风险水平值1×10-6,因此,该模拟情景下,由于ROX 持续高浓度污染导致表层土壤无机砷浓度较高,诱发砷的致癌风险较大。实际养鸡场粪便中无机砷浓度较低,例如:实际调查华北平原138个养鸡场粪便中无机砷浓度较低,计算的无机砷致癌风险值均小于可接受的致癌风险水平值1×10-6,致癌风险可忽略。本次模拟实验提供了一种极端污染情景下的无机砷健康风险评估,可与正常使用ROX 情景下的健康风险进行对比[4]。
3 结论
(1)洛克沙胂(ROX)持续污染的模拟过程中,其降解速率显著高于迁移速率,ROX 的降解与吸附均发生在土壤浅层(0~10 cm)。ROX 降解产物主要为As(Ⅴ)和As(Ⅲ),以As(Ⅴ)为主,砷化合物主要聚集在0~40 cm,土壤中的含量显著高于土壤溶液,砷化合物的迁移速度十分缓慢,导致土壤一旦被砷污染,其长期危害难以消除。
(2)通过微生物群落响应分析,可知土壤表面的ROX 含量较高,导致表层土壤中微生物群落结构与其他深度显著不同,ROX 含量和深度是土壤中微生物群落多样性的主要环境影响因素。
(3)通过健康风险评估得知,表层土壤中ROX 持续污染会诱发较大的砷致癌风险。建议全面执行我国禁止使用ROX 的规定,在仍然允许使用ROX 的国家和地区,要加强对禽畜废弃物的规范处理,避免长期在未防渗的地面上露天堆积。