CT和MRI对高级别胶质瘤和脑转移瘤的鉴别诊断价值
2023-07-12孙国臣曹红岩尚亚春
何 丽 孙国臣 曹红岩 尚亚春
胶质瘤是大脑、脊髓胶质细胞发生癌变而出现的原发性颅内肿瘤,而高级别胶质瘤(HGG)是指世界卫生组织(WHO)分级3~4级的胶质瘤,预后较差[1]。脑转移瘤(BM)是指发生于其他部位的恶性肿瘤转移至颅内,为继发性肿瘤,预后相对于HGG更好,二者均为人体常见的脑部恶性肿瘤[2]。HGG需要在尽量不损伤神经功能的情况下进行最大限度手术切除,再辅助放化疗,而BM则需根据患者情况选择外科手术局部控制治疗、全脑放疗、立体定向放疗、全身化疗、靶向治疗等,二者手术切除范围、放化疗剂量均存在差异,精确的临床诊断可以帮助确定合适的治疗方案,改善预后[3-4]。脑组织活检是脑肿瘤诊断金标准,但其有创性致使患者接受度不高,临床难以推广,因此寻找安全可靠的鉴别诊断方式非常重要。临床诊断HGG和BM极易混淆,颅脑X线计算机断层扫描(CT)和磁共振成像(MRI)都是HGG、BM最常做的影像学检查,各具优势[5]。颅脑CT简单跨界、安全无创,MRI则可以实现多方位断层检查、成像质量更高,且随着MRI技术不断发展,更先进的MRI技术随之出现。磁共振扩散张量成像(DTI)是MRI的特殊形式,可以通过水分子弥散运动来观察脑白质纤维束的病理变化,对脑疾病及预后的评估效果显著优于常规MRI[6]。基于此,本研究将探讨颅脑CT、DTI对HGG和BM的鉴别诊断价值。具体报告如下。
1 资料与方法
1.1 一般资料
选择医院2020年1月1日至2022年1月1日期间确诊为HGG和BM的96例患者,其中HGG 40例,BM 56例。纳入标准:①经脑组织活检或手术病理证实为HGG或BM;②接受手术、放化疗等治疗前已完成颅脑CT与MRI扫描,扫描时间至治疗时间≤2周;③颅脑CT与MRI图像无缺失,且质量良好;④BM原发肿瘤非脑部肿瘤。排除标准:①颅脑CT、MRI检测禁忌证,如对含碘对比剂过敏或严重心肝肾功能衰竭;②术前或放化疗前长期服用止痛、镇静药物者;③合并代谢性疾病、凝血功能不全、精神类疾病或其它颅内恶性肿瘤;④合并其他影响CT或MRI扫描结果的颅内疾病;⑤幽闭恐惧症;⑥患者及家属拒绝参与本研究,未签署知情同意书。按照疾病类型分别纳入HGG组和BM组。HGG组患者40例,男性22例,女性18例;年龄35~78岁,平均年龄(58.14±8.39)岁;合并神经症状36例;WHO分级:Ⅲ级24例,Ⅳ级16例。BM组患者56例,男性32例,女性24例;年龄31~75岁,平均年龄(56.37±9.84)岁;合并神经症状56例;转移来源:肺癌28例,胃肠道肿瘤15例,肾癌8例,乳腺癌2例,其他3例。2组患者性别、年龄、神经症状差异无统计学意义(P>0.05)。
1.2 检测方法
1.2.1 颅脑CT 40例HGG患者和56例BM患者行颅脑CT平扫+增强扫描,CT扫描仪器选择德国西门子公司的第二代FlashCT (Somatom Definition Flash)。患者仰卧平躺于扫描床正中,技术人员负责摆正头部,下巴稍低,行CT平扫,扫描基线为眦耳线,自眦耳线向上连续扫描至颅顶。扫描参数:视野220 mm×220 mm,层厚:5~10 mm,螺距3.2 mm,层间距:5~10mm,层数12~14层,管电压120 kV,管电流195 mA,矩阵512×512。参数设定完毕,启动扫描。平扫结束后再行增强扫描,于静脉注射碘海醇60~100 ml,采用团注法,注射速率为1~2 ml/s,注射后延迟扫描动脉期(16~20 s)、实质期(60~70 s)、延迟期(5~10 min)。扫描结束后留观15 min。
1.2.2 颅脑MRI 40例HGG患者和56例BM患者行颅脑MRI平扫+增强扫描,MRI扫描仪器选择GE1.5T磁共振、西门子3.0T磁共振,配合8通道头颅线圈。患者仰卧,头先进,用海绵垫固定头部,并适当垫高枕部,平躺于扫描床正中,佩戴耳机保护听力。从双眉中心连线扫描至颅顶,扫描图像包含T1加权像(T1WI)横断面[重复时间(TR)=450 ms,回波时间(TE)=15 ms]、T2加权像(T2WI)横断面/矢状面(TR=4500 ms,TE=100 ms)和反转恢复序列(FLAIR)横断面(TR=7500 ms,TE=80 ms)。再行增强扫描,按0.1 mmol/kg剂量于静脉注射钆喷酸葡胺(Bayer Inc.,国药准字J20171008),注射速率为3 ml/s。DTI采用单次激发自旋回波平面回波成像(SEEPI)序列,扫描野224×224×120 mm,层厚5 mm,层间距1 mm,平均次数2次,TR=7300 ms,TE=90 ms,矩阵112×112,b值=0、1000 s/mm2。
1.3 图像分析
将CT平扫、CT增强扫描、DTI原始图像上传至工作站,由至少两位高年资(年资≥5)放射科医师单独阅片,意见不一致则协商一致。观察肿瘤大小、形态、位置,勾画感兴趣区(ROI),包括肿瘤实质区域(肿瘤明显强化)、囊变区域(肿瘤实质中心未强化)、边缘区域(肿瘤强化边缘未强化)、瘤周水肿区域(肿瘤边缘至水肿边缘的中点)及瘤周正常脑实质区域(水肿边缘外约2 cm),ROI区域面积10~20 mm2,测量各区的各向异性分数(FA)值和表观扩散系数(ADC)值,均重复测量3次,取平均值。
1.4 统计学方法

2 结果
2.1 HGG与BM颅脑CT影像特征比较
HGG与BM在病灶数目、密度、肿瘤形状、肿瘤边界、肿瘤占位、钙化等颅脑CT影像特征方面的差异有统计学意义(P<0.05)。见表1。

表1 HGG、BM颅脑CT影像特征比较(例,%)
2.2 HGG与BM的FA值比较
HGG组肿瘤实质区域FA值显著大于BM组(P<0.05),边缘区域FA值显著小于BM组(P<0.05)。见表2。
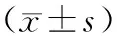
表2 HGG与BM的FA值比较
2.3 HGG与BM的ADC值比较
HGG组瘤周水肿区域ADC值显著小于BM组(P<0.05)。见表3。

表3 HGG与BM的ADC值比较
2.4 HGG与BM颅脑CT、MRI的Logistic回归分析
以HGG(是=1,否=0)、BM(是=1,否=0)为因变量,以病灶数目(单发=1,多发=2)、密度(低密度=1,等密度=2,高密度=3)、肿瘤形状(规则=1,不规则=2)、肿瘤边界(清晰=1,模糊=2)、肿瘤占位(是=1,否=2)、钙化(是=1,否=2)等分类变量为协变量,经Logistic回归分析显示颅脑CT中密度、肿瘤形状、肿瘤边界、钙化是鉴别诊断HGG、BM的影响因素(P<0.05);以HGG、BM为因变量,以肿瘤实质区域FA值(连续变量)、边缘区域FA值(连续变量)、瘤周水肿区域ADC值(连续变量)等连续变量为协变量,Logistic回归分析显示颅脑MRI中肿瘤实质区域FA值、边缘区域FA值是鉴别诊断HGG、BM的独立影响因素(P<0.05)。见表4。

表4 HGG与BM颅脑CT、MRI的Logistic回归分析
2.5 颅脑CT、MRI对HGG与BM的诊断价值分析
ROC结果显示颅脑CT鉴别诊断HGG、BM的AUC为0.898,以0.393为截断值,敏感度、特异度为77.50%、89.29%;ROC曲线结果显示颅脑MRI鉴别诊断HGG、BM的AUC为0.923,以0.295为截断值,敏感度、特异度为92.50%、80.36%。见表5。

表5 颅脑CT、MRI对HGG与BM的诊断价值分析
2.6 患者影像资料
患者,男性,80岁,言语障碍,不明原因抽搐,确诊HGG。颅脑CT:左侧顶叶见结节状等密度影,周围见低密度水肿带,边界不清(图1A);颅脑MRI:左侧顶叶见结节状长T2稍长T1信号,DWI呈高信号,ADC呈低信号,周边见片状长T2稍长T1信号环绕,增强扫描示左侧顶叶病灶呈环状明显强化,中央部及周边水肿带无强化(图1B)。
A为CT影像资料;B为MRI影像资料。图1 HGG颅脑CT、MRI影像资料
患者,女性,49岁,乳腺癌病史,头晕、恶心,确诊BM。颅脑CT:左侧小脑半球见结节状混杂密度影周围见低密度影环绕(图2A);颅脑MRI:左侧小脑半球见结节样状不均匀长T2稍长T1信号,周边见环片状稍长T2稍长T1信号环绕,增强扫描可见较明显不均匀团块状、结节样强化(图2B)。
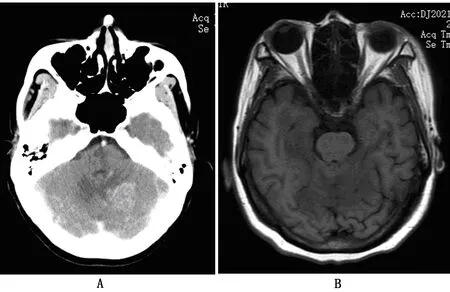
A为CT影像资料;B为MRI影像资料。图2 BM颅脑CT、MRI影像资料
3 讨论
胶质瘤在原发性颅内肿瘤中占60%,以HGG恶性程度最高。BM为颅内继发肿瘤,原发瘤多为肺癌、乳腺癌、恶性黑色素瘤等,但也有部分患者查不到原发瘤[7-9]。颅脑CT、MRI增强扫描可以对脑肿瘤进行定位、定性、定量诊断,从而指导治疗方案的制定[10]。颅脑CT可以对病灶数目、病灶密度、出血、强化类型、瘤周水肿、肿瘤形状、肿瘤边界、肿瘤占位、钙化等肿瘤特征进行明确判断。HGG与BM颅脑CT影像特征比较结果显示,2组病灶数目、密度、肿瘤形状、肿瘤边界、肿瘤占位、钙化等颅脑CT影像特征差异有统计学意义。HGG多为低密度或混杂密度病灶,而BM多为高密度病灶,也存在部分低密度、等密度病灶,这是由于BM原发癌不同导致的密度差异。HGG肿瘤形状多为以囊状、团块状、片状或条索状为主,呈不规则表现,而BM多为圆形、类圆形,形状规则,这是因为HGG与正常脑组织相连,呈浸润性弥漫生长,因此形状多不规则,与周围脑组织也没有明显边界,但BM是随着血液循环和淋巴组织在颅脑内生长,因此形状更规则、边界更清晰。HGG、BM均有不同程度的肿瘤占位现象,但HGG恶性程度更高,因此钙化较明显,而BM肉瘤湿滑,腔内一般为囊肿或脓液,因此BM钙化较少见。进一步进行Logistic回归分析,结果显示密度、肿瘤形状、肿瘤边界、钙化是鉴别诊断HGG、BM的独立影响因素,但颅脑CT可能受主观性影响,结果需谨慎确认。
报道指出,HGG与BM的颅脑MRI具有非常相似的影像学特点,因此单纯的MRI影像学特征比较难以实现二者之间的鉴别诊断[11]。DTI可以通过评价脑实质纤维束走行来进行定量分析,以FA值、ADC值为主要参数,HGG、BM的结构排列、瘤周侵犯、占位效应均会导致FA值、ADC值发生变化。HGG与BM的不同区域FA值比较结果显示,HGG组肿瘤实质区域FA值显著大于BM组,边缘区域FA值显著小于BM组。推测原因,FA值是肿瘤组织的物理特性,数值根据弥散性在0~1之间,大脑白质纤维FA值接近1,而HGG、BM会破坏神经纤维束,导致FA值降低,但HGG可以产生纤维粘连蛋白,促使细胞外基质生成,肿瘤细胞受到胞外基质的吸附、迁移作用,从而使FA值有所升高,因此HGG肿瘤实质区域FA值大于BM;同时BM存在明显肿瘤占位效应,致使肿瘤边缘的神经纤维束受到挤压,继而发生移位,因此BM肿瘤边缘区域FA值显著大于HGG。HGG与BM的不同区域ADC值比较结果显示,HGG组瘤周水肿区域ADC值显著小于BM组。ADC值反映了水分子弥散特点,与水分子扩散能力成正比,一般颅脑肿瘤组织的ADC值会高于正常脑组织,这是因为肿瘤组织缺血、缺氧、坏死会导致肿瘤细胞密度降低,水分子弥散度增加,从而表现为高ADC值。但HGG会在脑实质内浸润生长,肿瘤实质对周围脑实质的压迫导致血脑屏障被破坏,出现瘤周水肿,而瘤周水肿区域内还存在大量肿瘤细胞,内部细胞结构更紧密,水分子扩散受限,因此HGG瘤周水肿区域的ADC值会降低,导致低于BM。进一步Logistic回归分析结果显示肿瘤实质区域FA值、边缘区域FA值是鉴别诊断HGG、BM的独立影响因素。
对HGG、BM独立影响因素进行诊断价值分析,ROC结果显示颅脑CT鉴别诊断HGG、BM的AUC为0.898,敏感度、特异度为77.50%、89.29%,颅脑MRI鉴别诊断HGG、BM的AUC为0.923,敏感度、特异度为92.50%、80.36%,其诊断价值高于颅脑CT。尧麒等[12]使用常规MRI、增强扫描、DWI及DTI诊断HGG、BM,发现DTI可以作为HGG、BM的鉴别诊断方式,与本研究结果相似,但并未进一步进行诊断价值分析。冯梦薇等[13]使用动态增强MRI诊断HGG、BM,并进行了诊断价值分析,发现多个MRI定量参数结合可以增加HGG、BM诊断价值。本研究使用颅脑CT、MRI增强扫描诊断HGG、BM,收集颅脑CT的定性特征和颅脑MRI的定量特征,发现二者均具有较高诊断价值,对后续治疗和预后具有重要指导作用。但研究样本有限,可能存在结果偏差,拟在后续重新制定研究方案,扩大样本量验证结果,并探究更具应用价值的鉴别诊断方法。
综上所述,颅脑CT可以通过密度、肿瘤形状、肿瘤边界、钙化等特征来鉴别HGG、BM,但存在主观性,颅脑MRI可以通过肿瘤实质区域FA值、边缘区域FA值来鉴别HGG、BM,结果相对客观可靠,二者均对HGG、BM的鉴别诊断具有较高价值。
