谷草转氨酶与谷丙转氨酶比值与食管癌放化疗预后的相关性
2023-07-12崔娟娟王玲燕俞岑明
崔娟娟 王玲燕 俞岑明
食管癌是常见的消化道恶性肿瘤,具有发病隐匿、侵袭性、预后差的特点。最新数据表明,我国是食管癌的高发国家,2020年初发病率与死亡率分别为22.4/10万和20.8/10万[1-2]。放射治疗是食管癌的主要治疗手段之一,研究表明即使联合同步化疗后5年的生存率仅30%左右,局部区域复发和远处转移仍是食管癌治疗失败的主要原因。尽管目前已知多种与肿瘤预后相关的生物学标志物[3],但迄今为止仍缺乏灵敏高效的指标来预测食管癌治疗的预后。近年的研究表明血清学指标在恶性肿瘤的诊断及预后评估中具有检测便捷、经济、可重复检测等优势。已有相关研究表明谷草转氨酶(AST)与谷丙转氨酶(ALT)的比值(DRR)可作为鼻咽癌、肾癌、胰腺癌等恶性肿瘤的独立预后因素[4-6],但有关DRR与食管癌预后的相关研究未见报道。本文通过回顾性分析280例接受放化疗的食管癌患者的临床资料,探讨治疗前患者的DRR水平与食管癌放化疗后5年生存率的相关性。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月至2016年12月于南通大学附属肿瘤医院放疗科接受放化疗综合治疗的食管鳞癌患者280例。根据2009年全国非手术治疗食管癌临床分期标准草案对入组患者进行分期。入组标准:①患者初诊,组织学类型为食管鳞状细胞癌;②ECOG评分0~2分;③接受放化疗相结合的综合治疗;④具备完整的治疗及随访资料。排除标准:①既往曾接受手术、化疗等抗肿瘤治疗;②具有放化疗禁忌证;③单纯放疗的患者;④同时合并其他恶性肿瘤;⑤Ⅳ期食管癌;⑥有严重的肝脏疾病患者。
1.2 方法
抽取患者的空腹外周静脉血,收集患者的临床基线资料和检验指标。综合患者的一般状况、肿瘤分期以及患者意愿选择同步放化疗或序贯放化疗。化疗方案选择以顺铂为基础的联合方案或以替吉奥单药口服的化疗方案。放疗靶区及邻近正常组织器官的勾画参照定位CT,结合胃镜检查、食管钡餐造影以及增强CT或PET/CT等影像学资料综合考虑,所有患者均采用调强放疗(intensity modulated radiation therapy,IMRT),同步放化疗患者放疗剂量54~60 GY,不能耐受或拒绝同步放化疗的患者接受序贯放化疗,放疗剂量60~66 GY,分次剂量2 GY,每周5次。
1.3 随访
对患者的随访以门诊复查及电话随访为主。完成治疗后前2年每3个月门诊复查1次,2年后每半年复查1次。总生存期(overall survival,OS)是指从治疗开始至任何原因死亡的时间,或至截止随访时间。
1.4 统计学分析

2 结果
2.1 DRR的最佳截断值分析
建立以预测患者OS为目标的ROC曲线(图1),DRR的曲线下面积(AUC)为0.715(P=0.036),最佳截断值(cutoff)为1.29,其敏感性和特异性分别为65.3%和71.2%。根据DRR的cutoff值将入组患者分为高DRR组(DRR>1.29)和低DRR组(DRR≤1.29)。

图1 食管癌患者DRR的ROC曲线
2.2 DRR与食管鳞癌临床病理参数的关系
治疗前DRR水平与患者性别、年龄、病灶部位以及放化疗方案无关(P>0.05),与肿瘤的T分期(P=0.001)、N分期(P=0.004)、TNM分期(P=0.044)、肿瘤分化程度(P=0.009)相关。见表1。

表1 DRR水平与食管癌患者临床病理特征的关系/例
2.3 预后影响因素的分析
Kaplan-Meier生存曲线分析显示,高DRR水平与患者较差的OS相关(图2)。单因素分析显示 T 分期、N 分期、TNM 分期、肿瘤分化程度、放化疗方案、血清DRR水平均与OS相关(P<0.05)。COX多因素分析结果显示,T分期、N分期、TNM分期、肿瘤分化程度和DRR水平是影响OS的独立因素(P<0.05)。见表2。
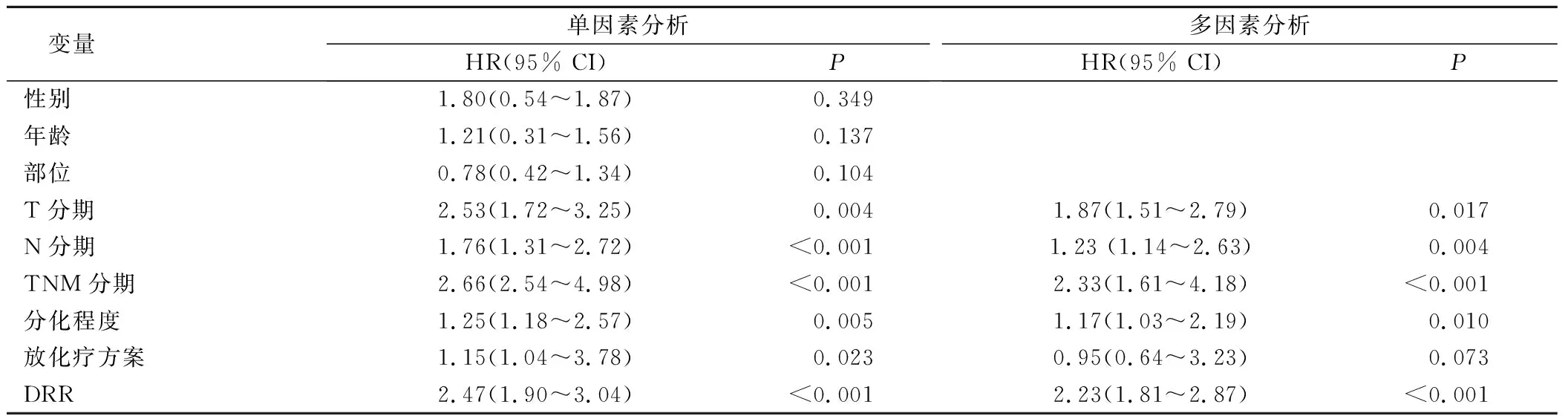
表2 影响食管鳞癌患者OS的单因素及多因素分析

图2 高DRR组与低DRR组的生存曲线比较
3 讨论
食管癌患者大多数在疾病早期没有明显的临床症状,不易被察觉,导致病变发现较晚,预后较差,在临床实践中对食管癌进行准确的预后预测是提高其生存率的关键之一。预测预后的生物标志物有助于临床医师根据患者的预后风险分层提供个性化的精准的治疗方案。
ALT和AST是反映肝脏功能的常用指标,ALT具有肝脏特异性,而AST在不同的组织类型中广泛表达[7]。Warburg 效应提出肿瘤细胞在氧充足的条件下主要通过糖酵解途径来满足细胞增殖的需求[8]。ALT 催化丙酮酸和谷氨酸转化为丙氨酸和 α-酮戊二酸,在糖酵解和谷氨酰胺代谢中起作用。另有研究表明,AST对苹果酸-天冬氨酸穿梭的功能至关重要,而苹果酸-天冬氨酸穿梭在糖酵解中发挥着重要作用。此外,还有研究表明氧化应激和炎症可导致肝损伤[9],升高的 AST/ALT 比值则代表体内高氧化应激和炎症环境,而氧化应激和炎症与癌症的发展密切相关[10-12]。因此,AST/ALT比值(DRR)是潜在生物标志物。
血清AST与ALT的比值由De Ritis教授提出,最初用于区分急性肝炎的病因[13],后此比值被命名为DRR,并用于反映肝细胞坏死的严重程度[14]。近年来相关研究发现,DRR与多种恶性肿瘤的预后密切相关。赵鹏跃通过对242 例行腹腔镜直肠癌根治术的患者进行回顾性分析,结果表明术前DRR是患者术后1年并发症发生的独立危险因素之一。患者术前DRR是越高,则术后1年出现并发症的风险越高[15]。Yun-Sok Ha等研究表明,对于接受根治性膀胱切除术的膀胱癌患者而言,升高的DRR值与较差的预后显著相关。此外DRR被发现是转移、癌症相关性死亡和总死亡的独立预后因素[16]。Olivia回顾性分析了515名口腔癌和口咽癌患者治疗前的DRR,在此研究中高DRR组的预后更差,DRR是生存预后的预测指标[17]。本研究也得出类似结果,食管癌患者放化疗前的DRR值与其预后相关,高DRR组的OS较低DRR组显著缩短,DRR是接受放化疗治疗的食管癌患者的独立影响因素。
综上所述,食管癌患者放化疗前的DRR值与其生存预后有一定相关性,是食管癌患者不良预后的独立预测指标。不过本研究也有一定局限性,首先,化疗药物等对肝功能会有一定的影响;其次,本研究为单中心的回顾性分析,样本量不大,且对DRR的研究仅局限于治疗前,未观察放化疗期间以及放化疗后的DRR动态变化,未来需要进一步进行大规模前瞻性多中心的随机临床研究来验证DRR在预测食管鳞癌预后中的价值。
