BEAM和TEAM两种方案预处理对自体造血干细胞移植患者血小板输注的影响分析
2023-07-12段鹏月张俊霞付艳杰
段鹏月 张俊霞 付艳杰
作为一种淋巴血液系统恶性肿瘤,霍奇金淋巴瘤(hodgkin lymphoma,HL)的发病率在所有淋巴瘤中占比较大,高达25%,其多发于青年与儿童。HL发病率较高,但致死率较低[1-2]。据统计,超过80%的HL在接受一线治疗后能够痊愈,而针对复发的HL,通过自体造血干细胞移植(autologous hematopoietic stem cell transplantation,AHSCT)联合大剂量化疗,也有超过50%的治愈率[3]。高剂量的预处理对于移植的成功率有关键性作用[4]。有研究表明,不同预处理方案对AHSCT的疗效和安全性存在一定程度的影响[5]。然而,目前临床上针对HL的治疗方案仍旧不统一,且关于不同预处理方案对AHSCT的意义的研究也存在不足。因此,本研究以我院2018年12月至2020年12月收治的92例拟行AHSCT的HL患者作为研究对象,将其分为两个组别后分别行BEAM(卡莫司汀、足叶乙甙、阿糖胞苷、美法仑)和TEAM(塞替派、足叶乙甙、阿糖胞苷、美法仑)预处理方案,比较两种方案对于自体移植患者的疗效。
1 资料与方法
1.1 临床资料
选取我院2018年12月至2020年12月收治的92例拟行AHSCT的HL患者作为研究对象。纳入标准:①经病理学检查确诊为HL;②符合世界卫生组织2008年淋巴组织肿瘤和标准造血分类标准;③此前未接受放疗或化疗;④自愿参与研究并同意书。排除标准:①对预处理方案用药不耐受;②非霍奇金淋巴瘤;③合并其他脏器严重功能障碍。采用随机数字表法将患者分为BEAM组(n=48)和TEAM组(n=44)。BEAM组男性26例,女性22例,年龄14~42岁,平均年龄(25.32±6.29)岁,病理类型:结节硬化型21例,混合细胞型17例,淋巴细胞丰富型10例,Ann Arbor分期[6]Ⅱ期9例,Ⅲ期16例,Ⅳ期23例;TEAM组男性23例,女性21例,年龄14~37岁,平均年龄(26.08±7.25)岁,病理类型:结节硬化型19例,混合细胞型16例,淋巴细胞丰富型9例,Ann Arbor分期Ⅱ期8例,Ⅲ期14例,Ⅳ期22例。两组性别、年龄、病理分型与分期等资料无统计学差异,具有可比性(P>0.05)。本研究经医院医学伦理委员会批准。
1.2 方法
1.2.1 治疗方案 BEAM预处理方案:于自体移植前第6日给予患者美法仑片(aspen Pharmacare Australia Pty Ltd公司)150 mg/m2口服,于自体移植前第5日给予患者卡莫司汀(天津金耀药业有限公司,国药准字H12020992,规格:2g∶125 mg)300 mg/m2静脉滴注,于自体移植前第4日至第2日每12h进行一次足叶乙甙(云南植物药业有限公司,国药准字H20060014,规格:40 mg)800 mg/m2、阿糖胞苷(辰欣药业股份有限公司,国药准字H20084073,规格:50 mg)1600 mg/m2静脉滴注。
1.2.2 TEAM预处理方案 于自体移植前第5日给予患者塞替派(上海旭东海普药业有限公司,国药准字H31020600,规格:1 ml∶10 mg)10 mg/kg静脉滴注,足叶乙甙、阿糖胞苷、美法仑用法用量同BEAM预处理方案。
在进行移植后给予患者相应的对症治疗与巩固治疗:移植第5日开始给予患者重组人粒细胞集落刺激因子(rhG-CSF)5~10 μg·kg-1·d-1,在患者外周WBC超过1.0×109/L后停止用药,并对患者给予其他支持治疗,包括维持酸碱平衡、电解质平衡、抗感染治疗等。存在纵隔大肿块的患者在移植后需要进行相应部位的放疗。
1.3 观察指标
术后对患者进行随访,观察比较两组患者临床疗效、血液指标、不良反应发生情况以及术后12个月的生存情况。
临床疗效:参考国际淋巴瘤工作组关于淋巴瘤的疗效标准[7]来评估两种方案的临床疗效分为完全缓解(CR)、部分缓解(PR)和未缓解(NR)。
血液指标:粒细胞植入时间,绝对中性粒细胞计数(ANC)超过0.5×109/L持续时间达到3 d;血小板恢复时间,血小板计数(PLT)大于20×109/L、50×109/L、100×109/L;血小板输注量。
不良反应发生情况:不良反应一般包括呕吐、发热、腹泻、皮疹、黏膜炎、谷丙转氨酶(alanine aminotransferase,ALT)以及谷草转氨酶(aspartate aminotransferase,AST)升高。
生存情况:观察12个月内患者的无进展生存率与总生存率。
1.4 统计学方法
2 结果
2.1 两组临床疗效比较
对患者采用不同预处理方案并进行自体移植后,BEAM组CR 39例(81.25%),PR 8例(16.67%),NR1例(2.08%),总有效率为97.92%;TEAM组CR 37例(84.09%),PR 7例(15.92%),无NR 病例,总有效率为100.00%,两组总有效率比较无统计学差异(P>0.05)。见表1。

表1 两组临床疗效对比(例,%)
2.2 两组血液指标比较
两组患者血液指标比较均无统计学差异(P>0.05),见表2。
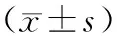
表2 两组血液指标比较
2.3 两组不良反应发生情况比较
两组患者不良反应发生情况比较均无明显差异(P>0.05),见表3。

表3 两组不良反应发生情况(例,%)
2.4 两组生存情况比较
术后12个月内对患者进行随访发现,12个月内BEAM组生存45例(93.75%),无进展生存26例(54.17%);TEAM组生存42例(95.45%),无进展生存25例(56.82%),两组患者总生存率与无进展生存率比较均无明显差异(P>0.05)。
3 讨论
自体移植成功的关键在于预处理方案。预处理过程中使用的药物种类、剂量与患者在接受AHSCT的临床疗效、移植期间发生毒副反应、远期生存情况和造血功能的重建之间均有密切联系[8-9]。但是目前尚未对AHSCT的预处理方案进行统一,同时相关的大样本量试验也存在不足,因此还需进一步对预处理方案进行优化,以改善AHSCT患者的造血功能、免疫功能以及远期生存情况,推动HL的治疗。
卡莫司汀是一种能够通过血脑屏障的抗肿瘤药,其对于恶性淋巴瘤、脑瘤以及多发性骨髓瘤均有较好的临床疗效[10]。该药物半衰期极短,通过静脉注射进入人体后会被迅速分解,其脂溶性促使其能通过血脑屏障[11]。卡莫司汀由肝脏代谢,但其代谢产物能够长时间停留在血浆中,引发延迟性骨髓抑制,造成白细胞数量与血小板数量减少[12]。同时,该药物的代谢物进入肝肠循环会造成肝脏损伤和肾损伤,一般情况下肝脏损伤是可逆的,在停药后能够自行恢复[13]。卡莫司汀长期使用还可能引起肺纤维化等肺并发症,也会引起消化道反应如恶心、呕吐等[14-15]。在本研究中,BEAM组患者治愈 39例,缓解8例,未缓解仅1例,显示出卡莫司汀联合足叶乙甙、阿糖胞苷、美法仑治疗HL有较好的疗效。BEAM组发生呕吐12例,发热26例,腹泻21例,皮疹15例,ALT/AST升高47例,提示使用卡莫司汀会带来较多的不良反应,这与过往研究结果一致。
塞替派是2019年在我国重新上市的烷化剂,国内关于该药物的研究较少。塞替派抗肿瘤的作用机制为:通过鸟嘌呤碱基与肿瘤细胞的DNA双链进行交联,对DNA产生不可逆损伤,进而使DNA、蛋白质的合成均被阻断,从而达到抑制肿瘤的目的[16]。有研究证明,塞替派对于多种淋巴造血系统疾病有较好的疗效,如β地中海贫血、急性白血病等,其在复发难治淋巴瘤的治疗上的效果也已经被证明[17-19]。但是,该药物也具有较强的生物毒性,其会引发消化系统、血液系统、神经系统以及肝肾等严重不良反应[20]。因此在使用该药时必须对患者进行肝肾等脏器功能进行定期检查。在本研究结果中,TEAM对HL的治疗有效率为100.00%,显示出采用塞替派、足叶乙甙、阿糖胞苷、美法仑进行预处理对于行AHSCT患者的临床疗效有重要意义。
对两组患者临床疗效和不良反应进行比较,结果显示采用不同预处理方案的两组患者之间各指标均无显著差异。BEAM组血小板恢复至20×109/L、50×109/L、100×109/L的时间与TEAM组血小板恢复至相应标准的时间相当接近。BEAM组粒细胞植入时间为(11.29±1.72)d,血小板输注量为(20.42±2.67)U,而TEAM组粒细胞植入时间为(11.51±1.69)d,血小板输注量为(20.51±2.85)U,两组患者粒细胞植入时间与血小板输注量也无明显差异。对患者进行为期12个月的随访后发现,12个月内BEAM组生存45例,无进展生存26例;TEAM组生存42例,无进展生存25例,两组患者总生存率与无进展生存率之间均无明显差异,提示使用BEAM预处理方案和TEAM预处理方案对于行AHSCT的HL患者的疗效非常接近,这与一项关于BEAM和含塞替派的预处理方案在淋巴瘤自体移植中的疗效的研究结果保持一致[21]。
综上所述,BEAM与TEAM预处理方案对于AHSCT患者均有较好的疗效,采用不同方案的AHSCT患者的血小板恢复时间、粒细胞植入时间、血小板输注量之间无明显差异,且两种方案均会引发较多的不良反应,带来相似的总生存率与无进展生存率。
