血清LMR预测多发性骨髓瘤化疗联合免疫调节剂治疗效果的价值
2023-07-12张俊霞段鹏月杨丽鸽
张俊霞 段鹏月 杨丽鸽
多发性骨髓瘤是一种浆细胞疾病[1]。临床上通常采用化疗,具有一定疗效,但治疗后复发率较高,严重影响预后[2]。因此,临床需要一种有效的治疗手段来提高预后效果,降低复发率。有研究发现,树突状细胞与细胞因子诱导的杀伤细胞在共同培养后具有很强的抗肿瘤效果[3]。本研究将树突状细胞-细胞因子诱导的杀伤细胞免疫治疗与化疗联合使用,但临床缺少一个有效的评价指标来判断治疗效果。目前,国外已有大量学者发现肿瘤患者预后不良时血清外周血淋巴细胞(absolute lymphocyte count,ALC)水平较低,单核细胞(absolute monocyte count,AMC)水平可预测结直肠癌等恶性肿瘤患者预后情况[4]。国内对血清ALC与AMC的研究相对较少,但许多学者认为血清外周血淋巴/单核细胞比值(lymphocyte/monocyte ratio,LMR)在一定程度上可以辅助判断患者预后情况。本研究对化疗联合免疫调节剂治疗多发性骨髓瘤患者的血清LMR进行了分析,评估了血清LMR对多发性骨髓瘤患者化疗联合免疫调节剂治疗效果的预测价值,为临床判断治疗效果提供参考依据,现报告如下。
1 材料与方法
1.1 一般资料
选取2020年1月至2021年1月在我院行化疗联合免疫调节剂治疗的93例多发性骨髓瘤患者为观察组,并选取91例同期健康体检者为对照组。纳入标准:①均符合临床多发性骨髓瘤诊断标准[5];②均无多发性骨髓瘤以外的其他恶性肿瘤。排除标准:①具有化疗药物过敏者;②临床或影像资料不全者;③患有血液系统疾病者。93例多发性骨髓瘤中男性51例,女性42例,年龄50~71岁,平均年龄(60.88±9.83)岁,健康体检者中男性50例,女性41例,年龄49~72岁,平均年龄(61.12±9.58)岁。发性骨髓瘤所有患者根据《WHO多发性骨髓瘤的诊断与分期》标准[6]进行临床分期,Ⅰ期患者25例,Ⅱ期患者32例,Ⅲ期患者36例。2组患者一般资料比较,差异不存在统计学意义,具有可比性(P>0.05)。
1.2 治疗方法
观察组患者给予化疗联合免疫调节剂治疗,具体化疗方法(VD方案:硼替佐米联合地塞米松):硼替佐米(齐鲁制药有限公司,国药准字H20183102,规格:1.0 mg)1.2 mg/m2,给药时间为第1、4、8、11天,地塞米松(沈阳广大制药有限公司,国药准字H20052186,规格:2 mg)20 mg/d静滴,给药时间为d1~2、d4~5、d8~9、d11~12。免疫调节剂治疗方法(树突状细胞-细胞因子诱导的杀伤细胞免疫治疗):在第1天化疗前2 h采集患者外周血液,并提取单个核细胞分离,然后进行体外细胞诱导,治疗第7天后将树突状细胞与细胞因子诱导的杀伤细胞按1∶10的比例混合,在化疗第15天开始回输进患者体内,1次/天,回输分为6次,每次输入细胞(30~40)×109。输入时用生理盐水重悬(100 ml)对细胞进行离心洗涤,输入控制在2 h内,1月为1个治疗周期,均治疗1个周期后评估疗效。
1.3 疗效评价标准
参照《血液病诊断及疗效标准》[7]评估观察组治疗后疗效。完全缓解:患者持续6周以上尿中或血液中单克隆M蛋白消失,骨髓活检浆细胞持续阴性或者低于5%;部分缓解:尿中或血液中单克隆M蛋白、浆细胞减少超过50%;轻微缓解:尿中或血液中单克隆M蛋白、浆细胞减少为25%~49%;无效(疾病稳定与疾病进展):各指标变化低于25%,至少维持3个月,或者病情加重,尿中或血液中单克隆M蛋白、浆细胞出现增加现象。
1.4 检测方法
观察组治疗前后均于清晨抽取空腹静脉血3 mL,对照组于健康体检时及1个月后抽取清晨空腹静脉血3 mL。均放入离心机以3000 r/min速度进行10 min离心处理并取上清液,利用全自动血细胞分析仪(麦迪卡医疗设备苏州有限公司)检测ALC、AMC水平,并计算出LMR。
1.5 统计学方法

2 结果
2.1 2组血清ALC、AMC、LMR水平的比较
治疗后观察组血清ALC、AMC、LMR水平均明显高于治疗前,且治疗前与治疗后观察组血清LMR水平明显低于对照组,差异存在统计学意义(P<0.05)。见表1。
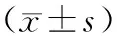
表1 2组血清ALC、AMC、LMR水平的比较
2.2 观察组不同疗效血清ALC、AMC、LMR水平的比较
观察组经治疗后完全缓解42例,部分缓解27例,轻微缓解18例,无效6例。完全缓解组血清ALC、AMC、LMR水平最高,其次为部分缓解组和轻微缓解组,无效组最低,4组血清ALC、AMC、LMR水平比较,差异存在统计学意义(P<0.05)。见表2。
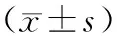
表2 观察组不同疗效血清ALC、AMC、LMR水平的比较
2.3 血清ALC、AMC、LMR水平与疗效的相关性
血清ALC、AMC、LMR水平与多发性骨髓瘤化疗联合免疫调节剂治疗效果均呈正相关(P<0.05)。见表3。

表3 血清ALC、AMC、LMR水平与疗效的相关性
2.4 血清LMR水平对多发性骨髓瘤患者治疗效果的预测价值
ROC曲线分析得出,血清LMR水平预测多发性骨髓瘤患者治疗效果的AUC为0.750,SE为0.037,P<0.001,灵敏度为74.7%,特异度为68.8%,95% 置信区间为0.678~0.822。见图1。
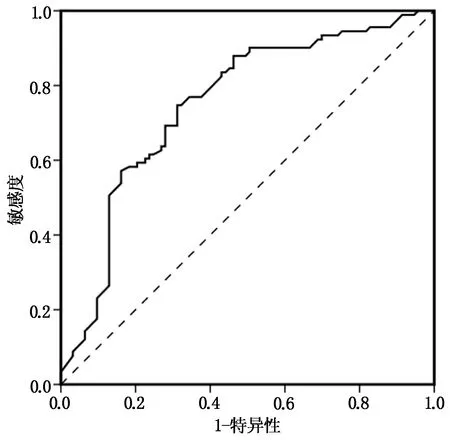
图1 ROC曲线图
3 讨论
多发性骨髓瘤病因尚未明确,是一个长期性疾病,目前不能完全治愈,常见临床典型症状为骨骼损害、肾功能损害、贫血、感染等,由于较多患者骨被破坏,骨折成为常见并发症[8-9],其好发于中老年人,毒物、有化学物质及放射线接触史者等人群。相关流行病学显示,多发性骨髓瘤男性发病多于女性,且发病率随着我国人口老龄化增加而呈现上升趋势,学者们估计我国发病率每年有(1.0~2.5)/10万[10-11]。树突状细胞-细胞因子诱导的杀伤细胞免疫治疗是将患者外周血液中单核细胞分离并培养,使之诱导扩增为树突状细胞与细胞因子诱导的杀伤细胞,将两者按比例混合后回输到患者体内,但由于多发性骨髓瘤患者不仅体液免疫下降,而且细胞免疫也存在异常,外加上对一些细胞免疫的杀伤本身也不敏感,导致单一的免疫调节剂治疗效果并不佳[12-13]。VD方案中硼替佐米在一定程度上可逆转患者紊乱的免疫状态,使多发性骨髓瘤对免疫细胞的敏感性增加[14]。因此,化疗联合免疫调节剂治疗可能会具有更好的治疗效果。
炎症在癌症疾病中具有重要作用,肿瘤微环境中的炎性细胞在肿瘤发生、发展中具有一定作用,且肿瘤细胞能刺激机体全身炎症,将肿瘤情况展现在各种炎性标志物的变化中[15]。本研究结果中显示,治疗后观察组血清ALC、AMC、LMR水平均明显高于治疗前,且治疗前与治疗后观察组血清LMR水平明显低于对照组。提示化疗联合免疫调节剂治疗具有较好的疗效,且观察组治疗后血清LMR由治疗前(4.36±3.41)升高到(5.38±2.96),说明血清与多发性骨髓瘤疗效相关,可预测多发性骨髓瘤化疗联合免疫调节剂治疗患者的预后。血清LMR首先在弥漫性大B细胞淋巴瘤患者中发现与患者预后存在关系,近年来,在许多实体瘤患者预后研究中逐渐证实与LMR同样存在相关性[16]。在早期三阴性乳腺癌患者的研究中发现,LMR可作为患者长期生存的预测因素;在胰腺癌患者接受姑息化疗后发现,LMR可作为预后指标;在结直肠癌患者化疗治疗后发现,LMR变化反映了化疗效果;在肺癌患者接受手术治疗预后较好时发现LMR升高[17-19]。因此,越来越多的研究证明疾病的诊断、疗效及预后和外周血液中的相关炎性指标存在相关性。ALC、AMC均是免疫细胞,可通过抑制肿瘤血管生成、局部免疫抑制,改变患者机体中肿瘤微环境[20]。已有研究证明,患者总生存期与低淋巴细胞计数呈负相关,肿瘤患者预后较差与高单核细胞计数具有关联[21]。LMR是一个经济便利、可常规进行的检测指标,因此,在早期预测肿瘤患者预后中具有一定价值。袁茂林等[22]发现术前外周血LMR在应用新辅助化疗治疗的乳腺癌患者疗效中具有预测价值。徐明彬等[23]认为术前外周血LMR可作为肾透明细胞癌患者独立预后因素。毕海等[24]学者研究发现术前LMR在根治性膀胱全切患者生存预后中具有重要预测价值。本研究结果中显示,血清ALC、AMC、LMR水平与多发性骨髓瘤化疗联合免疫调节剂治疗后疗效均呈正相关。并进一步通过ROC曲线分析得出,血清LMR水平预测多发性骨髓瘤患者治疗后预后的AUC为0.750,灵敏度为74.7%,特异度为68.8%,95% 置信区间为0.678~0.822,说明血清LMR对多发性骨髓瘤化疗联合免疫调节剂治疗后疗效预测具有一定价值。与徐璐等[25]研究结果相似,指出外周血LMR对宫颈癌患者预后具有较高的预测价值。
综上所述,血清LMR在对多发性骨髓瘤化疗联合免疫调节剂治疗效果的预测中具有重要价值,血清LMR上升提示患者预后较好。
