腹腔镜下结直肠癌NOSES术中保留左结肠动脉的中远期疗效观察
2023-07-11付川川王五艺冯晓沛李佳泽郑阳春
付川川, 赵 滨, 易 波, 王五艺, 陈 超, 冯晓沛, 李佳泽, 郑阳春
随着微创外科技术的快速发展,微创治疗理念已深入人心,腹腔镜技术逐渐取代传统的开放手术,成为绝大多数腹部外科疾病的首选治疗方法[1-3]。经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)概念的提出和应用将微创手术带入一个新的阶段。目前,腹腔镜NOSES已经在结直肠癌领域广泛开展,并逐步应用于胃外科、泌尿外科、肝胆胰外科、妇科等领域[3-5]。吻合口漏是影响结直肠癌患者术后生存期的严重并发症。越来越多的临床研究表明,腹腔镜结直肠癌术中保留左结肠动脉(left colic artery,LCA)可有效改善吻合口近端肠管血运,并降低术后吻合口漏的发生[6-7]。本课题组的前期研究也表明,腹腔镜结直肠癌NOSES中保留LCA是安全可行的,且近期临床疗效较好[8]。本文回顾性分析2016年7月至2021年12月于四川省肿瘤医院大肠外科行腹腔镜NOSES的155例结直肠癌患者的临床资料,旨在探讨腹腔镜下结直肠癌NOSES中保留LCA的中远期临床疗效。现报道如下。
1 资料与方法
1.1临床资料 收集2016年7月至2021年12月于四川省肿瘤医院大肠外科行腹腔镜NOSES根治性切除的155例结直肠癌患者的临床资料。其中男75例,女80例;年龄24~85(58.9±11.4)岁;体质量指数(body mass index,BMI)14.3~31.0(22.9±3.0)kg/m2;直肠癌136例,远段乙状结肠癌19例;TNM分期为Ⅰ期63例,Ⅱ期48例,Ⅲ期37例,0期(TisN0M0)7例。术前行新辅助放,化疗11例,未行新辅助治疗144例。根据术中LCA保留情况将其分为保留LCA组80例,不保留LCA组75例。
1.2纳入与排除标准 纳入标准:(1)术前经肠镜活检明确诊断为腺癌或黏膜内癌;(2)肿瘤位于直肠或远段乙状结肠。排除标准:(1)术前或术中发现远处脏器转移或腹腔种植转移者;(2)合并同时性或异时性转移,或合并其他脏器恶性肿瘤者;(3)姑息切除手术患者;(4)病历资料、随访资料不完整患者。
1.3手术方法
1.3.1 一般常规操作 所有手术由同一手术团队完成。患者取改良截石位,右下肢略放低,常规消毒铺巾后,采用5孔法建立气腹及操作通道:观察孔位于脐上,主操作孔位于右下腹麦氏点处,辅操作孔及助手操作孔分别位于右锁骨中线平脐、左锁骨中线平脐、脐与左髂前上棘连线与左锁骨中线交界点处。具体布孔根据肿瘤部位和手术需要有所微调。
1.3.2 系膜游离 采用中间入路进行结直肠系膜的游离。于骶骨岬前上方右侧乙状结肠根部系膜与后腹膜融合处切开,进入左侧Toldt′s间隙,辨认及保护左、右腹下神经,循着间隙上、下拓展,向下直至盆底或肿瘤远端约5 cm处,向上直至肠系膜下动脉(inferior mesenteric artery,IMA)根部。
1.3.3 IMA血管处理 对于不保留LCA者,清扫IMA根部淋巴结后,直接于IMA根部离断(见图1)。对于保留LCA者,按五步法操作,在清扫NO.253组淋巴结的同时保留LCA[9]:第一,充分拓展IMA根部后方间隙,然后距腹主动脉1.0~1.5 cm处切开IMA血管鞘,沿IMA走行向尾侧进行鞘内游离,骨骼化显露IMA直至其发出LCA处下方;第二,看清LCA的发出点后,沿LCA走行向外侧游离,直至与肠系膜下静脉(inferior mesenteric vein,IMV)相交处;第三,随后转而向上,自IMA根部水平向外侧游离,直至显露IMV的近端;第四,清扫IMA根部周围及IMA、LCA、IMV间脂肪、淋巴组织(NO.253组);第五,于高位离断IMV,于LCA发出处下方离断IMA(见图2)[9]。
1.3.4 肿瘤切除及取出 直肠系膜的游离遵循全直肠系膜切除(total mesorectal excision,TME)原则,于直视下沿着盆筋膜脏、壁层之间的无血管间隙锐性向肛侧游离,肿瘤位于腹膜反折下方的低位直肠癌患者需要游离至近盆底,肿瘤位于腹膜反折上方的高位直肠癌或乙状结肠癌患者,则游离至肿瘤远端约5 cm处。结直肠系膜游离完成后,沿边缘血管弓内侧2~3 cm处裁剪结肠系膜直至肿瘤近端约10 cm处,以腔镜下切割闭合器于该处闭合离断肿瘤近端肠管(见图3)。高位直肠癌和乙状结肠癌患者于肿瘤远端约5 cm处闭合离断后,以切除拖出的方式经直肠取标本(NOSES Ⅳ式,见图4)[10-11]。低位直肠癌采用经肛外翻拖出切除的方式,先把肿瘤及标本经肛外翻至体外后,再以弧形切割闭合器于肿瘤远端约2 cm处闭合离断(NOSES Ⅰ式B法,见图5)[12]。极低位直肠癌不适合经肛外翻切除的,则采用经括约肌间切除的方式取标本(NOSES Ⅰ式E法,见图6)。


图1 于IMA根部高位结扎离断图2 保留LCA后低位结扎IMA图3 腹腔内闭合离断肿瘤近端肠管图4 经直肠经保护套取出肿瘤标本图5 肿瘤标本经肛外翻至体外切除图6 经括约肌间切除后取出肿瘤标本
1.3.5 消化道重建 消化道重建采用管型吻合器进行。经括约肌间切除的,采用手工缝合法行乙状结肠-肛管端端吻合[12]。肠道重建后,彻底冲洗盆、腹腔。直肠癌患者术前行新辅助放疗者常规行预防性回肠造瘘,术前未行新辅助治疗的中、高位直肠及乙状结肠癌原则上不行预防性肠造瘘,低位直肠癌根据术中情况及患者意愿行选择性的预防性回肠造瘘。
1.4综合治疗 根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[13]及《中国结直肠癌诊疗规范(2015版)》[14],对于T3期以上和(或)N+期的低位直肠癌患者术前予以新辅助放化疗;未行术前新辅助放化疗者术后予以补充。原位癌(TisN0M0)、Ⅰ期及Ⅱ期结肠癌不伴高危因素者术后不进行辅助化疗;Ⅱ期伴有高危因素及Ⅲ期患者术后按指南及规范推荐方案进行辅助化疗。
1.5术后随访 术后常规定期复查及密切随访,随访方式包括门诊、电话或微信等。术后2年内每3个月随访1次,2年后每6个月随访1次,末次随访时间截至2022年6月30日。随访内容包括常规体格检查、肿瘤标志物、胸部CT、腹部超声或腹部CT或MRI,以及肠镜检查等。
2 结果
2.1两组临床资料比较 两组年龄、性别、BMI、肿瘤部位、TNM分期、肿瘤距肛缘距离、肿瘤长径、术前新辅助放化疗情况、淋巴结清扫数,以及术后综合治疗、辅助化疗、辅助放化疗情况比较差异无统计学意义(P>0.05)。见表1。
表1 两组临床资料比较
2.2两组术后无病生存期(disease-free survival,DFS)比较 随访期间保留LCA组和不保留LCA组各有2例患者失访,失访率2.6%(4/155)。保留LCA组中位随访时间为24(4~65)个月,不保留LCA组为43(7~71)个月。在随访期间,保留LCA组发生局部复发或远处转移4例(5.1%),其中肝转移2例,肺转移1例,多发远处脏器转移1例;不保留LCA组发生局部复发或远处转移7例(9.5%),其中肝转移2例,肺转移、卵巢转移、腹腔转移各1例,吻合口复发1例,多发远处脏器转移1例。两组DFS比较差异无统计学意义(P>0.05)。进一步以TNM分期进行分层分析,两组Ⅰ、Ⅱ、Ⅲ期患者的DFS比较差异均无统计学意义(P>0.05)。见图7。
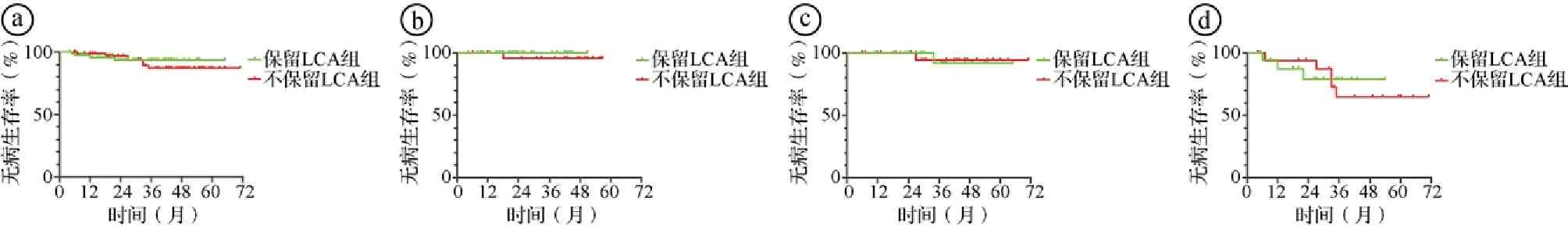
ⓐ两组所有患者DFS比较(log-rank: χ2=0.163,P=0.687);ⓑ两组中的Ⅰ期患者DFS比较(log-rank: χ2=1.000,P=0.317);ⓒ两组中的Ⅱ期患者DFS比较(log-rank: χ2=0.009,P=0.923);ⓓ两组中的Ⅲ期患者DFS比较(log-rank: χ2=0.047,P=0.829)
2.3两组术后总生存期(overall survival,OS)比较 在随访期间,保留LCA组死亡2例(2.5%),死因为肺转移及多发远处脏器转移;不保留LCA组死亡2例(2.7%),死因分别为肝转移和多发远处脏器转移。两组OS比较差异无统计学意义(P>0.05)。以TNM分期进行分层分析,两组Ⅰ、Ⅱ、Ⅲ期患者的OS比较差异均无统计学意义(P>0.05)。见图8。

ⓐ两组所有患者OS比较(log-rank: χ2=0.648,P=0.421);ⓑ两组中的Ⅰ期患者OS比较(log-rank: χ2=0.000,P=1.000);ⓒ两组中的Ⅱ期患者OS比较(log-rank: χ2=2.000,P=0.157);ⓓ两组中的Ⅲ期患者OS比较(log-rank: χ2=0.010,P=0.921)
3 讨论
3.1目前,对腹腔镜结直肠癌根治术中是否保留LCA一直存在争议,其焦点在于保留LCA能否降低术后吻合口漏的发生,以及是否会影响患者的预后[15-17]。主张IMA高位结扎的学者认为,IMA根部离断操作更简单,可以将IMA根部的脂肪、淋巴组织整块切除,有利于NO.253组淋巴结的清扫,肿瘤根治效果更好[15-16]。主张在LCA发出处下方低位结扎IMA的学者认为,保留LCA可以改善吻合口近端肠管的血运,有利于降低术后吻合口漏的发生率,只要术中做到NO.253组淋巴结的彻底廓清,就不会影响肿瘤的根治性[7,17-18]。
3.2对结肠解剖的研究表明,左半结肠的血供来源于中结肠动脉(middle colic artery,MCA)左支通过边缘血管弓和IMA的双重供血[19-20]。腹腔镜结直肠根治术中,当IMA高位结扎后,来自IMA的供血被切断,吻合口近端乙状结肠或降结肠的血供主要依赖来自MCA左支边缘血管弓的供血。对于边缘血管弓吻合完善的患者而言,即使依赖MCA左支边缘血管弓的单一供血,绝大多数情况下也并不会影响吻合口血运,但对于结肠脾曲Griffiths关键点边缘血管弓吻合缺如或薄弱的患者来说,IMA高位离断后,吻合口近端肠管就可能出现明显的缺血甚至坏死[6,19-20]。如术中未察觉,术后就会出现吻合口漏,严重威胁患者的生命安全。如术中切除缺血的肠管过长,则不利于吻合甚至无法吻合,需要游离结肠脾曲或松解横结肠以确保无张力吻合。相反,如术中保留了LCA,不但可以改善吻合口近端肠管的血供,还可以避免因边缘血管弓吻合缺陷带来的潜在隐患[19-20]。Bae等[21]通过静脉注射吲哚菁绿并使用近距离红外荧光成像技术测量吻合口血供,发现保留LCA可为吻合口近端肠段提供更充足的血运。Patroni等[22]的研究也证实,保留LCA可以有效降低吻合口漏的发生率。还有研究表明,在处理IMA根部时,保留LCA可以减少对下腹神经丛的损伤,对患者排尿功能和性功能的保护更为有利[23]。本研究中,保留LCA组术后有2例(2.50%)发生吻合口漏,不保留LCA组有1例(1.33%)发生吻合口漏,吻合口漏发生率均低于既往研究报道[12,16]。
3.3腹腔镜NOSES中保留LCA的另一个优势是可以简化近端肠管血运判断的程序,提高手术安全性[9]。传统的腹腔镜手术,因有腹壁辅助切口,通过该切口不仅可以把肠管拉出至体外切除,还可以通过触摸边缘血管的搏动和观察肠管断面的渗血情况判断近端肠管的血运。但是,腹腔镜结直肠癌NOSES由于省略了传统腹腔镜手术所必需的腹壁辅助切口,系膜的游离、裁剪与消化道重建均于体腔内进行,近端肠管血运主要通过腹腔镜下观察肠壁的色泽判断,或通过外周静脉注射吲哚菁绿等药物在荧光腹腔镜下观察确定[9,24]。但是,如果术中保留了LCA,由于近端肠管仍然是MCA和IMA的双重供血,血供丰富,只要在裁剪系膜的时候确保边缘血管弓不被误伤,在边缘血管结扎的位置切断肠管,就基本不用担心断端的血运问题,减少了术中判断近端肠管生机的环节和时间,提高了手术安全性,对于患有糖尿病、动脉粥样硬化等周围血管病变的老年患者受益尤其明显[9]。
3.4NOSES的初衷是为了减轻手术创伤,保护腹壁功能,促进患者恢复,提高术后生活质量[3]。在腹腔镜结直肠癌根治术中,将保留LCA与NOSES理念相结合,能更好地展现微创技术的优势,实现根治和功能保护的愿景,使患者最大限度受益[9]。本课题组前期对19例腹腔镜结直肠癌NOSES中保留LCA患者近期疗效的研究显示,术后首次下床时间为(14.4±3.6)h,首次肛门排气时间为(15.3±8.9)h,首次进食时间为(2.9±1.1)d,术后无吻合口漏及盆腔脓肿的发生,患者恢复快速,近期疗效满意[8]。Qian等[25]回顾性分析了83例保留LCA的腹腔镜结直肠癌手术也证实,腹腔镜NOSES结合术前肠镜下注射纳米碳标记组(n=38)较常规腹腔镜组(n=45)术后恢复更快,并发症更少。近年来,关于腹腔镜结直肠癌NOSES中保留LCA的价值已得到越来越多学者的认同,但是人们关注的焦点仍然是患者的肿瘤学结局[8,25-26]。迄今为止,国内外尚鲜见腹腔镜结直肠癌NOSES联合保留LCA术后中远期疗效的报道。本研究回顾性分析了155例腹腔镜结直肠癌NOSES患者的资料,结果发现保留LCA组和不保留LCA组平均清扫淋巴结数目及术后OS和DFS比较差异均无统计学意义,提示腹腔镜结直肠癌NOSES中保留LCA不会影响患者的中远期疗效。
综上所述,腹腔镜结直肠癌NOSES中只要做到NO.253淋巴结规范性、彻底性清扫,保留LCA与不保留LCA对患者中远期预后并不会产生显著影响。腹腔镜结直肠癌NOSES中由于保留了LCA,可以改善近端肠段的血运,有助于降低术后吻合口漏的发生风险;同时,由于保留了组织器官的血供,减轻了手术创伤,提高了手术安全性,更符合功能外科的理念[27]。本研究的缺点是样本量较小,随访时间较短,且属于回顾性研究,研究结果尚有待前瞻性、随机对照、大样本量、长期随访的临床研究进一步论证。
