4-羟基苯并噁唑-2-酮通过脂质代谢和内质网应激通路治疗酒精性脂肪肝大鼠的作用机制研究
2023-07-11陆俊霏刘妍颖幸尚平方斌覃思张华陆婷婷朱丹林军广西医科大学药学院广西南宁5300广西医科大学第一附属医院药学部广西南宁5300
陆俊霏,刘妍颖,幸尚平,方斌,覃思,张华,陆婷婷,朱丹,林军(.广西医科大学药学院,广西 南宁 5300;.广西医科大学第一附属医院药学部,广西 南宁 5300)
酒精性脂肪肝(alcoholic fatty liver disease,AFLD)是酒精性肝病的早期阶段,如不加以控制可能会进一步发展成肝硬化甚至肝癌[1]。酒精是酒精性脂肪肝的高危因素,长期大量酒精的摄入可能会引起体内脂质代谢平衡紊乱。酒精可直接或间接调控脂质代谢有关因子,刺激脂质合成,引起肝脏内脂质蓄积[2]。细胞内脂质通常以脂滴形式存在,脂滴积累最终导致脂肪肝的形成[3]。
内质网(Endoplasmic reticulum,ER)是真核细胞中一个由膜系统组成的细胞器,主要作用是为蛋白质合成、转运、折叠以及钙储存提供场所[4]。内质网应激(Endoplasmic reticulum stress,ERS)通常出现在体内功能失调时,此时机体蛋白质正确合成路径被阻断,内质网内出现未获得功能构象或错误功能性构象蛋白的堆积。酒精可通过其代谢加合物触发ERS,这种应激反应过强或过久时会导致细胞和组织损伤,近年越来越多的研究[5-6]也证实ERS 参与了酒精性肝病的发展过程。因此寻找可减轻或者抑制ERS 的药物,对控制酒精性脂肪肝的发生发展具有积极意义。此外,中医认为酒乃粮谷之精气,其气剿悍而有大毒,为湿热之品,饮酒过度当解酒毒,清热利湿,以治病求本[7]。
4-羟基苯并噁唑-2-酮[4-hydroxy-2(3H)-benzoxazolone,HBOA]是爵床科老鼠簕属植物老鼠簕(AcanthusilicifoliusL)中的生物碱类化合物,分子结构见图1。课题组前期[8-9]已经合成了4-羟基苯并噁唑-2-酮化合物并发现其对肝脏有较强的保护作用。有关研究[10]表明该化合物可以改善非酒精性脂肪肝的脂质代谢紊乱。此外在急性肝中毒解救方面发现4-羟基苯并噁唑-2-酮对脂多糖(LPS)所致的小鼠急性肝损伤有一定保护作用[11],该药理功效与传统医学认为“酒伤”当解酒毒的思路有一定契合之处。但实际上,4-羟基苯并噁唑-2-酮对于酒精引起的大鼠脂肪肝作用尚不明确。因此,本研究先采用分子对接的方法计算4-羟基苯并噁唑-2-酮和脂质代谢及ERS相关蛋白靶点的结合能,判断其结合能力,后利用酒精递增灌胃法建立酒精性脂肪肝模型,从脂质代谢平衡和ERS 方面探讨4-羟基苯并噁唑-2-酮对大鼠酒精性脂肪肝的影响。
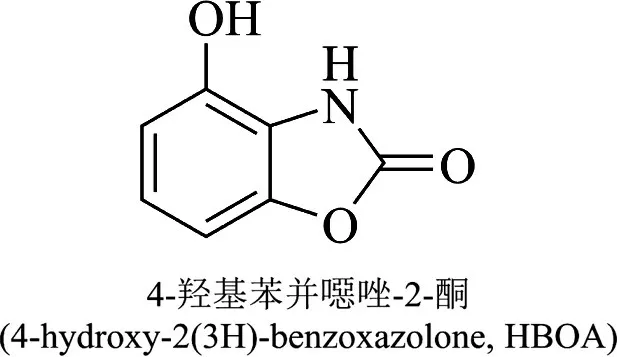
图1 4-羟基苯并噁唑-2-酮分子结构式图Figure 1 Diagram of the molecular structure formula of 4-hydroxy-2(3H)-benzoxazolone
1 材料与方法
1.1 动物 SD 大鼠,雄性,SPF 级,10 周龄,体质量200~220 g,购于广西医科大学实验动物中心,动物质量合格证号:0009731。实验动物生产许可证号:SCXK(桂)2020-0003,实验动物使用许可证号:SYXK(桂)2020-0004。动物实验环境条件控制在(23±2)℃、50%~70%相对湿度,明-暗循环均为12 h·d-1。动物实验过程经广西医科大学实验动物伦理委员会审核认定符合伦理规定,审批编号:202205002。
1.2 药物及试剂 56 度食用酒精,北京红星股份有限公司,批号:20210512;4-羟基苯并噁唑-2-酮,课题组前期实验[8]合成,纯度>98%;水飞蓟宾胶囊,天津天士力圣特制药有限公司,批号:950701001,国药准字H20040299;谷草转氨酶(GOT)、谷丙转氨酶(GPT)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)生化试剂盒,南京建成生物工程研究所有限公司,批号分别为:20211027、20211027、20220704、20220113;兔多克隆抗体GRP78、兔多克隆抗体SREBP-1c、兔多克隆抗体ACC1、兔多克隆抗体PERK、兔多克隆抗体IRE1 和兔多克隆抗体ATF6,武汉三鹰生物技术有限公司,批号分别为: 00089833、00096355、 00098232、00069086、00086646、00102159;兔多克隆抗体磷酸甘油醛脱氢酶(Glyceraldehyde- 3- phosphate dehydrogenase,GAPDH)、兔单克隆抗体p-PERK,美国Cell Signaling 公司,批号分别为:5174S、20; 兔多克隆抗体p-IRE1,美国Signalway Antibody 公司,批号:7608;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G,中国Invitrogen 公司,批号:VC303853;RNA 提取试剂盒,康宁生命科学(吴江)有限公司,批号:23518KD1;逆转录试剂盒,宝日医生物技术(北京)有限公司,批号:AM11060A;引物由生工生物工程(上海)股份有限公司合成。引物序列如表1所示。

表1 引物序列表Table 1 List of primer sequences
1.3 仪器 SpectraMaxPlus384 型酶标仪,香港分子仪器有限公司;Odyssey Clx 型双色红外荧光成像仪,美国Licor 公司;ABI7300 荧光定量PCR 仪,美国Applied Biosystem 公司;PowerPac Basic 电泳仪,美国Bio-Rad 公司;BS-2000 全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司。
1.4 分子对接 通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获取4-羟基苯并噁唑-2-酮(CAS:28955-70-6)的三维结构3D Conformer,保存为SDF 格式;然后使用PyMol 软件将格式保存为PDB 格式文件,作为分子对接配体小分子待用。通过Uniport 数据库(https://www.uniprot.org/)获取相应蛋白受体的3D 结构并保存为PDB 格式文件,然后利用PyMol 软件去除所获得蛋白3D 结构中的水分子及配体,并导出保存为PDB 格式文件作为分子对接蛋白受体待用。通过AutoDock Tools 1.5.6 软件为受体蛋白添加氢原子和设置对接参数并进行分子对接,计算结合能,最后通过PyMol 对所得结果进行可视化处理。
1.5 模型复制 SD 大鼠适应性喂养后随机分为正常组12 只和模型复制组60 只,参考酒精递增灌胃法[12-13]建立酒精性脂肪肝模型。1~4 周灌胃30%酒精4.0 g·kg-1·d-1,5~8 周灌胃40%酒精5.0 g·kg-1·d-1,9~12 周灌胃50%酒精6.0 g·kg-1·d-1,其中酒精用超纯水稀释。在第12 周末,通过油红O 染色对肝组织进行病理检查,肝组织出现了大面积红染,表明造模成功。
1.6 分组及给药方法 在第12 周末确定模型复制成功后,将模型复制组随机分为模型组、水飞蓟宾组(26.25 mg·kg-1)及4-羟基苯并噁唑-2-酮高(100 mg·kg-1)、中(50 mg·kg-1)、低(25 mg·kg-1)剂量组,每组8 只。并于第13 周始至第16 周末,各给药组分别灌胃给予使用0.5%羧甲基纤维素钠溶液配制的相应药物,每日1 次;正常组、模型组给予10 mL·kg-1的0.5%羧甲基纤维素钠溶液灌胃对照。在第13 周始至第16 周末的给药治疗期间,除正常组外,各组均错峰灌胃50%酒精6.0 g·kg-1·d-1,以维持造模。
1.7 状态观察、样品采集与肝指数检测 每日观察各组大鼠精神状态、饮食量、毛色和活动等。末次给药后禁食不禁水12 h,次日清晨称量大鼠体质量。腹腔注射20%乌拉坦(1 g·kg-1)麻醉后经腹主动脉取血,全血静置20~30 min 后以3 500 r·min-1、4 ℃离心15 min(离心半径7.5 cm)收集血清。取出肝脏后用4 ℃、 0.9% NaCl 溶液洗净,观察形态后称量肝脏湿质量并计算肝指数(肝指数=肝湿质量/体质量×100%);称质量后取1 cm×1 cm 大小肝组织以备进行油红O 染色病理检查,其余样本置于-80 ℃冷藏设备保存待用。
1.8 肝组织油红O 染色病理检查 待测样品进行冷冻切片,进行常规油红O 染色,观察肝脏脂肪变性情况。
1.9 大鼠肝脏GOT、GPT 及血清TC、TG、HDL-C、LDL-C 含量检测 采用试剂盒检测法检测肝脏GOT、GPT 及血清中HDL-C、LDL-C 水平,操作方法按试剂盒说明书执行;采用全自动生化分析仪检测血清中TC、TG 水平。
1.10 Western Blotting 法检测肝组织中SREBP-1c、ACC1及GRP78、PERK、p-PERK、IRE1、p-IRE1、ATF6 蛋白的表达 将大鼠肝组织从-80 ℃冷藏设备取出并清理干净,加入预混液(按照RIPA 裂解溶液、蛋白酶抑制剂、磷酸酶抑制剂100∶1∶1 的比例)进行粉碎匀浆,所得浆料冰上裂解20 min 后在12 000×g,4 ℃条件下离心15 min。取上清按照BCA 蛋白测定试剂盒的操作步骤进行总蛋白含量测定,上清中加入蛋白上样缓冲液煮沸变性得待用样品。利用十二烷基硫酸钠-聚丙烯酰胺凝胶(PAGE)进行蛋白电泳分离后转至PVDF 膜,将膜条放入快速封闭液中平摇10 min;洗膜,将该薄膜置于一抗中4 ℃条件下孵育6 h 以上;洗膜,避光条件下置于二抗中平摇孵育30 min 至1 h,洗膜。采用双色红外荧光成像仪进行扫描,ImageJ 2x 软件对条带进行灰度值的测量。p-PERK/PERK、p-IRE1/IRE1 比值分别代表PERK 和IRE1 的磷酸化程度,其余蛋白与GAPDH进行灰度值对比,以表示它们蛋白的相对表达量。
1.11 RT-qPCR 法检测大鼠肝脏组织中SREBP-1c、GRP78 mRNA 表达 按RNA 提取试剂盒的操作方法提取肝组织RNA 后,紫外法检测总RNA 浓度纯度,按逆转录试剂盒操作得c-DNA。 RT-qPCR 反应条件:预变性,95 ℃,30 s;变性,95 ℃,5 s,退火延伸,60 ℃,31 s;循环40 次。
1.12 统计学处理方法 采用SPSS 17.0 统计软件,计量资料结果以均数± 标准差(±s)表示。多组间采用单因素方差分析(One way-ANOVA),两两比较用LSD-t试验。P<0.05 为差异有统计学意义。
2 结果
2.1 分子对接结果 本次对接结果(见图2)发现4-羟基苯并噁唑-2-酮与SREBP-1c、ACC1、GRP78、PERK、IRE1、ATF6 蛋白分子对接结合能分别为-5.53、-5.02、-6.27、-5.60、-6.54、-3.53 kcal·mol-1,表明4-羟基苯并噁唑-2-酮与上述蛋白靶点有较好的结合活性,但对于酒精性脂肪肝的治疗活性需要进一步佐以生物学实验验证。4-羟基苯并噁唑-2-酮与活性位点附近的氨基酸残基连接形成氢键结合到蛋白上,其氨基酸残基见表2。

表2 4-羟基苯并噁唑-2-酮与SREBP-1c、ACC1、GRP78、PERK、IRE1 和ATF6 蛋白分子对接的结合能及所结合的氨基酸残基Table 2 Table of binding energies and bound amino acid residues obtained by molecular docking of 4-hydroxy-2(3H)-benzoxazolone with SREBP-1c,ACC1,GRP78,PERK,IRE1 and ATF6 proteins

图2 4-羟基苯并噁唑-2-酮与SREBP-1c、ACC1、GRP78、PERK、IRE1 和ATF6 蛋白分子的对接图Figure 2 Diagram of molecular docking of 4-hydroxy-2(3H)-benzoxazolone with SREBP-1c,ACC1,GRP78,PERK,IRE1 and ATF6 proteins
2.2 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠一般状态及肝指数的影响 正常组大鼠毛色有光泽,精神佳,食欲旺盛;模型组大鼠毛色泛黄且有湿润感,精神萎靡不喜食不喜动;给药后各组一般状态均有所改善。正常组肝组织呈红褐色,表面光滑;模型组肝组织灰黄有油腻感且边缘较钝;给药后各组肝组织病理情况均有所改善。如表3 所示,与正常组比较,发现模型组肝指数呈明显上升趋势,差异有统计学意义(P<0.01); 与模型组比较,水飞蓟宾组与4-羟基苯并噁唑-2-酮高、中剂量组肝指数均呈明显下降趋势,差异有统计学意义(P<0.01)。
表3 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝指数的影响(±s,n=8)Table 3 Effect of 4-hydroxy-2(3H)-benzoxazolone on liver index of rats with alcoholic fatty liver disease(±s,n=8)

表3 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝指数的影响(±s,n=8)Table 3 Effect of 4-hydroxy-2(3H)-benzoxazolone on liver index of rats with alcoholic fatty liver disease(±s,n=8)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组水飞蓟宾组4-羟基苯并噁唑-2-酮高剂量组4-羟基苯并噁唑-2-酮中剂量组4-羟基苯并噁唑-2-酮低剂量组肝指数/%1.78±0.21 3.14±0.36##1.98±0.16**1.96±0.27**2.55±0.33**2.92±0.32
2.3 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝脏脂肪变性情况的影响 如图3 所示,镜下可见正常组视野中肝细胞胞核呈蓝染小圆点,细胞排列有序且间隙清晰,未见大面积红染,细胞内无红色脂滴沉积。模型组肝组织切片镜下可见大面积红染及弥散性红色脂滴分布,肝细胞结构紊乱胞核偏于一侧。4-羟基苯并噁唑-2-酮各组可见红染面积及脂滴沉积明显少于模型组,表明4-羟基苯并噁唑-2-酮可改善酒精导致的肝脏脂肪变性情况。

图3 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织脂肪变性情况的影响(油红O 染色,×200)Figure 3 Effect of 4-hydroxy-2(3H)-benzoxazolone on hepatic steatosis in rats with alcoholic fatty liver disease(Oil red O staining,×200)
2.4 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝功能指标GOT、GPT 水平的影响 如表4 所示,与正常组比较,模型组肝组织GOT、GPT 水平均呈明显上升趋势,差异均有统计学意义(P<0.01),表明模型组肝功能障碍;与模型组比较,水飞蓟宾组及4-羟基苯并噁唑-2-酮各剂量组大鼠肝组织GOT、GPT 水平均呈明显下降趋势,差异均有统计学意义(P<0.01)。
表4 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织中GOT、GPT 水平的影响(±s,n=8)Table 4 Effects of 4-hydroxy-2(3H)-benzoxazolone on GOT and GPT levels in liver tissue of rats with alcoholic fatty liver disease(±s,n=8)

表4 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织中GOT、GPT 水平的影响(±s,n=8)Table 4 Effects of 4-hydroxy-2(3H)-benzoxazolone on GOT and GPT levels in liver tissue of rats with alcoholic fatty liver disease(±s,n=8)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别正常组模型组水飞蓟宾组4-羟基苯并噁唑-2-酮高剂量组4-羟基苯并噁唑-2-酮中剂量组4-羟基苯并噁唑-2-酮低剂量组GOT/(U·gprot-1)92.09±10.81 134.41±37.53##98.66±15.17**100.42±15.84**102.30±10.71**104.07±8.37**GPT/(U·gprot-1)47.36±7.15 90.77±6.00##64.07±2.31**57.91±11.40**68.57±4.54**68.26±6.02**
2.5 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠血清中TC、TG、LDL-C、HDL-C 水平的影响 如表5所示,与正常组比较,模型组血清中TC、TG、LDL-C水平呈明显上升趋势,HDL-C 水平均呈明显下降趋势,差异均有统计学意义(P<0.01);与模型组比较,水飞蓟宾组及4-羟基苯并噁唑-2-酮各剂量组血清TC、TG、LDL-C 水平均呈明显下降趋势,血清HDL-C 水平呈明显上升趋势,差异均有统计学意义(P<0.05,P<0.01)。以上表明,给予4-羟基苯并噁唑-2-酮治疗后AFLD 大鼠的血脂四项状况有所改善。
表5 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠血清中TC、TG、LDL-C、HDL-C 水平的影响(±s,n=8)Table 5 Effects of 4-hydroxy-2(3H)-benzoxazolone on TC,TG,LDL-C and HDL-C levels in serum of rats with alcoholic fatty liver disease(±s,n=8)

表5 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠血清中TC、TG、LDL-C、HDL-C 水平的影响(±s,n=8)Table 5 Effects of 4-hydroxy-2(3H)-benzoxazolone on TC,TG,LDL-C and HDL-C levels in serum of rats with alcoholic fatty liver disease(±s,n=8)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别正常组模型组水飞蓟宾组4-羟基苯并噁唑-2-酮高剂量组4-羟基苯并噁唑-2-酮中剂量组4-羟基苯并噁唑-2-酮低剂量组TC/(mmol·L-1)1.64±0.13 1.98±0.16##1.70±0.09**1.64±0.11**1.76±0.17**1.82±0.11*TG/(mmol·L-1)0.29±0.06 1.49±0.15##0.36±0.09**0.38±0.09**0.39±0.12**0.42±0.13**HDL-C/(mmol·L-1)1.66±0.18 1.12±0.20##1.79±0.15**1.81±0.19**1.72±0.15**1.68±0.17**LDL-C/(mmol·L-1)0.23±0.04 0.56±0.09##0.30±0.03**0.30±0.07**0.34±0.08**0.39±0.08**
2.6 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织脂质代谢相关蛋白SREBP-1c、ACC1 表达水平的影响 如图4 所示,与正常组比较,可见模型组肝脏SREBP-1c、ACC1 蛋白表达均呈明显上升趋势,差异均有统计学意义(P<0.01);与模型组比较,水飞蓟宾组及4-羟基苯并噁唑-2-酮各剂量组肝脏SREBP-1c、ACC1 蛋白表达均呈明显下降趋势,差异均有统计学意义(P<0.05,P<0.01)。

图4 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织脂质代谢相关蛋白SREBP-1c、ACC1 表达水平的影响(±s,n=3)Figure 4 Effects of 4-hydroxy-2(3H)-benzoxazolone on the expression levels of SREBP-1c and ACC1,proteins related to lipid metabolism in liver tissu of rats with alcoholic fatty liver disease(±s,n=3)
2.7 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织ERS 相关蛋白GRP78、ATF6 表达水平及PERK、IRE1 磷酸化水平的影响 结果见图5。与正常组比较,可见模型组肝组织的GRP78 蛋白表达水平、PERK 磷酸化水平、IRE1 磷酸化水平和ATF6 蛋白表达水平呈明显上升趋势,差异均有统计学意义(P<0.01);与模型组比较,水飞蓟宾组及4-羟基苯并噁唑-2-酮各剂量组可降低肝组织GRP78 蛋白表达水平、PERK 磷酸化水平、IRE1 磷酸化水平和ATF6 蛋白表达水平,差异均有统计学意义(P<0.05,P<0.01)。

图5 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织内质网应激相关蛋白GRP78、ATF6 表达水平及PERK、IRE1 磷酸化水平的影响(±s,n=3)Figure 5 Effects of 4-hydroxy-2(3H)-benzoxazolone on the expression levels of endoplasmic reticulum stress-related proteins GRP78,ATF6,PERK phosphcrylation and IRE1 phosphcrylation in the liver of rats with alcoholic fatty liver disease(±s,n=3)
2.8 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织中SREBP-1c、GRP78 mRNA 表达水平的影响如图6 所示,与正常组比较,模型组肝脏SREBP-1c、GRP78 mRNA 表达呈明显上升趋势,差异均有统计学意义(P<0.01);与模型组比较,水飞蓟宾组及4-羟基苯并噁唑-2-酮各剂量组肝脏SREBP-1c(低剂量组除外)、GRP78 mRNA 表达均呈明显下降趋势,差异均有统计学意义(P<0.01)。

图6 4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠肝组织SREBP-1c 和GRP78 基因mRNA 相对表达的影响(±s,n=3)Figure 6 Effect of 4-hydroxy-2(3H)-benzoxazolone on the relative mRNA expressions of SREBP-1c and GRP78 in liver tissue of rats with alcoholic fatty liver disease(±s,n=3)
3 讨论
酒精性肝病(alcoholic liver disease,ALD)是一系列因过量酒精摄入引起的肝脏疾病的总括,该疾病发生发展的过程中由于临床特征和病理生理指标的变化,ALD 主要可以分成酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化及终末期的肝细胞癌变[14]。因病症的不同在中医学中其大致可以对应“酒伤”“酒癖”“酒疸”“酒臌”等[15]。酒精性脂肪肝属于ALD 较早期阶段,常指由于长期酒精摄入导致细胞脂质代谢紊乱进一步演化为肝细胞脂肪变性的症状,其发病率在酒精有关的肝病中占比高达22.6%[16],此阶段若不加以控制可能会进一步演化为酒精性肝炎甚至累及心血管系统。酒精递增灌胃建立酒精性脂肪肝模型是行之有效的建模方法[12-13,17],其可以避免在饮水中或食料中添加酒精的挥发损失及因大鼠天性厌酒导致摄入量不准确等问题。本次实验结果显示模型组GOT、GPT、TC、TG、LDL-C水平明显升高,HDL-C 水平明显降低并伴有肝脏脂滴沉积肝细胞分布紊乱等病理表现,说明模型复制成功。酒精在代谢过程中产物会对肝脏产生损伤作用而影响肝功能,同时也可以视为ALD 发展的驱动力之一。其代谢产物乙醛可与多种蛋白质形成加合物,有研究表明这些加合物有助于脂质积累[18],而肝脏作为脂质代谢的中枢器官,脂质代谢的破坏或紊乱通常会导致血脂异常和肝脏脂肪积累[19]。此外酒精代谢还是肝细胞出现内质网应激(Endoplasmic reticulum stress,ERS)的重要驱动力。ERS 作为急慢性肝病的特征之一,其可以激活未折叠蛋白反应(Unfolded protein response,UPR)进一步传递ERS 信号,UPR 对于在蛋白分泌期间维持细胞稳态至关重要,但其信号传导也会通过肝星状细胞参与脂肪变性、纤维化等过程驱动肝病进展,细胞内ERS 持续过久过强时将进一步损伤细胞造成肝损伤[20]。目前对于酒精性脂肪肝的治疗没有令人满意的特效药,中医药的开发可能为该疾病的治疗提供一个新的思路。有的中医学者认为对该类疾病主要应从毒邪论治,《黄帝内经》中对酒性的有关记载提到“酒者煮谷之液也,其气悍以清”,湿热毒邪自口而入,土壅木郁,伤及肝胆,损其形体官窍[15]。
老鼠簕是在中国红树林沼泽栖息地中发现的植物,它是一种介于海水与陆地生存的植物,其主要分布在广东、广西和海南等地。据《全国中草药汇编》 记载爵床科老鼠簕属植物老鼠簕(Acanthus ilicifoliusL)其根及全株均可入药,具有清热解毒、消肿散结之功效,民间常用于治疗急慢性肝病、肝脾肿大、泻火解毒及肿瘤。老鼠簕的醇提物具有较好的肝保护[21]、抗肿瘤[22]、抗菌[23]作用,4-羟基苯并噁唑-2-酮(HBOA)是从老鼠簕醇提物中分离得到的主要活性成分之一。本研究以4-羟基苯并噁唑-2-酮作为酒精性脂肪肝的干预药物,实验发现其可以明显改善酒精性脂肪肝大鼠肝组织的肝功能指标和血清中血脂四项水平,表明4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠有一定的治疗作用。
分子对接是推算分子间结合方式和亲和力的一种虚拟方法。结合能大小可以反映亲和力和构象稳定性,结合能越小分子间发生结合的可能性越大[24]。分子间可以自发结合时,其结合能通常小于0 kcal·mol-1;分子间有较好的结合活性时其结合能通常小于-5 kcal·mol-1[25]。此次分子对接结果显示,4-羟基苯并噁唑-2-酮与脂质代谢相关蛋白SREBP-1c、ACC1 及内质网应激相关蛋白GRP78、PERK、IRE1、ATF6 间的结合能小于-5 kcal·mol-1或小于0 kcal·mol-1,说明其间具较好的结合活性。提示当脂质代谢平衡紊乱及ERS 发生时,4-羟基苯并噁唑-2- 酮可能通过调节体内 SREBP- 1c、 ACC1、GRP78、PERK、IRE1、ATF6 蛋白的表达水平恢复体内脂质代谢平衡状态及减轻ERS。
机体中调控脂肪合成的转录因子主要有SREBP家族等,其中SREBP-1c 亚型主要存在于肝脏或脂肪细胞。SREBP 前体被合成后会结合到核膜和内质网膜上,该前体的氨基末端被蛋白酶水解后,将从膜上脱落进入胞核成为成熟的SREBP[26]。SREBP 能够识别并与类固醇调节元件(SRE)相结合,从而影响生脂酶表达,达到调节脂质的作用[27]。ACC1 是生物体中的一种重要的生脂酶,生脂酶表达量增加时体内脂质蓄积,脂肪生成增加将导致脂肪肝形成。有研究[28]表明用白酒灌胃小鼠时,小鼠体内成熟的SREBP-1c 增加,且其靶基因ACC1 表达量也随之增加,说明酒精可能通过活化肝脏的SREBP-1c 增加生脂酶基因ACC1 的表达导致脂肪肝形成。本研究发现,各给药组经治疗后可以下调肝组织内SREBP-1c、ACC1 蛋白表达水平和SREBP-1c mRNA 表达量,提示4-羟基苯并噁唑-2-酮可能通过调控SREBP-1c 及抑制ACC1 的表达缓解大鼠酒精性脂肪肝。
酒精、药物等因素可破坏内质网平衡状态,导致内质网腔内未获得功能构象的蛋白或错误功能性构象的蛋白蓄积,该反应也称为未折叠蛋白反应(Unfioded protein response,UPR)。UPR 的激活常发生在内质网腔内未折叠蛋白的积累反应中,称为内质网应激(ERS)[29]。UPR 的信号开关主要与PERK、IRE1、ATF6 这3 个内质网跨膜蛋白有关[30]。ERS 的标志蛋白GRP78 在正常情况下与PERK、ATF6、IRE1 结合,酒精刺激后,GRP78 与这3 个蛋白解离,解离后PERK、ATF6、IRE1 信号通路分别被激活,其中PERK、IRE1 通过自身磷酸化激活下游蛋白,并启动ERS,减少蛋白质合成促进内质网蛋白降解维持内质网稳态[31]。而长时间酒精刺激会使得ERS 过强导致细胞受损。本次实验观察到,给药治疗后GRP78 的蛋白含量水平及mRNA 表达显著降低,说明内质网应激减弱。另外我们发现,与模型组比较,各给药组经治疗后PERK、IRE1 的磷酸化水平和ATF6 表达量明显降低。表明4-羟基苯并噁唑-2-酮可能通过调控PERK/IRE1/ATF6 信号通路削弱内质网应激而起到保护肝细胞的作用。
综上,可推断4-羟基苯并噁唑-2-酮对酒精性脂肪肝大鼠有一定的治疗作用,其机制可能与调节脂质代谢紊乱抑制SREBP-1c 蛋白表达减少生脂酶ACC1 合成以起到减少脂肪沉积作用及抑制PERK/IRE1/ATF6 信号通路的信号传导以减弱内质网应激过强造成的肝细胞损伤有关。该结果可为中药来源单体化合物4-羟基苯并噁唑-2-酮在酒精性脂肪肝治疗方面的开发利用提供一定的实验依据。
