自噬抑制剂通过氧化应激诱导人头皮毛乳头细胞早衰进程
2023-07-08万梅钟意翁祖铨吴亚光宋潇杨希川
万梅,钟意,翁祖铨,吴亚光,宋潇,杨希川
雄激素源性脱发(androgenetic alopecia, AGA)是由受累区域的毛囊生长期缩短所致,而非毛发生长完全停止。生长期缩短会导致毛干更短更细,称为毛囊微型化[1]。毛乳头细胞(dermal papilla cells, DPC)为位于毛囊基底部的特殊间质成分,在毛囊发育和周期性再生调控中起主导作用[2]。诱导毛囊形成及再生为毛乳头细胞最显著的功能特征,其功能异常是毛囊疾病发生的关键因素。有研究证实AGA 患者脱发区(前额,雄激素敏感部位)的DPC较非脱发区(枕部,雄激素非敏感部位)表现出早衰表型,并且发现衰老标志物 p16 的上调和 DNA 损伤标志物的表达增加[3-4]。这表明DPC的早衰是毛囊微型化的重要因素,因此,防止DPC早衰可能是治疗AGA的新方向。
自噬是一个保守的过程,它分解代谢细胞内成分以维持能量稳态并保护细胞免受氧化应激损伤[5]。自噬通常被认为是一种积极的长寿调节因子,但自噬也可能在健康中发挥有害作用。自噬不仅对皮肤形成本身至关重要,而且延长了毛囊生长期[6],因此,自噬是脱发发展过程中的一个保护过程。因此,了解自噬机制为防止DPC早衰提供了一种有希望的策略。
U0126是一种小分子MEK1/2抑制剂,可通过MEK途径影响细胞存活、分化、增殖、凋亡等生物学效应。体内外实验均表明U0126可抑制细胞自噬和线粒体自噬并具有抗病毒的活性[7]。因此,本研究利用U0126处理DPC建立自噬抑制模型,通过分析DPC早衰表型、评估DPC生物活性因子的变化,初步探讨自噬对DPC早衰的作用机制。
1 材料和方法
1.1材料 本研究经陆军军医大学第一附属医院伦理委员会批准[(伦理审批号(A)KY202240]。所有实验均按照相关指南和规定进行。患者/受试者均签署书面知情同意书。标本来自陆军军医大学第一附属医院皮肤科头皮术后含毛囊的皮肤组织,大小为0.5 cm×2 cm~1 cm×4 cm,采集后立即置于4 ℃无菌生理盐水中保存。采用改良二步酶消化法分离毛乳头[8]。
1.2方法
1.2.1DPC培养 原代DPC用含10% 胎牛血清(Gibco,10091148)和100 U/L青霉素-链霉素的DMEM培养基在37 ℃、5% CO2培养箱中培养。本研究将采用三代DPC进行实验。
1.2.2SA-β-gal 采用SA-β-gal染色试剂盒(Beyotime,C0602)测定DPC衰老活性。分别采用0、10、20、30 μmol/L浓度的U0126处理DPC 后,β-半乳糖苷酶染色固定液固定细胞。PBS洗涤3次,加入染色液。37 ℃过夜后,显微镜下观察SA-β-gal染色情况。计数染色的细胞数。
1.2.3细胞迁移 小室(corning, 353097)上层分别添加0、10、20、30 μmol/L浓度的U0126,下层添加无血清培养基培养DPC 24 h。4%多聚甲醛固定细胞30 min,0.1%结晶紫染色液染色20 min,用棉签拭去上室未迁移的细胞。正置显微镜观察并拍照。用PS软件计数迁移的细胞数。
1.2.4活性氧检测 采用ROS检测试剂盒(Beyotime,S0033S)测定ROS浓度。分别采用0、10、20、30 μmol/L浓度的U0126刺激细胞后移除细胞培养基,加入适量稀释的DCFH-DA。用无血清细胞培养液洗涤DPC 3次。用Varioskan Flash Reader在激发波长488 nmol/L,发射波长525 nmol/L处测定光密度(OD)值。
1.2.5Western blot DPC经药物处理后,裂解细胞。SDS-PAGE分离蛋白并转移到PVDF膜上。封闭液封闭,用稀释的一抗在4 ℃孵育过夜。一抗为Actin(BBI,D191047)、GAPDH(Santa,sc32233)、LC3(MBL,PM036)、C-myc(Santa,sc-40)、Survivin(Santa,sc-17779)、Rb(Santa,sc102)、p16(Santa,sc-56330)。洗涤后,将膜与HRP标记的二抗孵育。Evolution-Capt Edge成像系统用于收集和量化图像。
1.2.6qPCR RNA提取试剂盒(Takara,日本)提取经不同浓度 (0、10、20、30 μmol/L) U0126处理后的DPC总RNA,反转录合成cDNA。定量聚合酶链反应序列见表1。
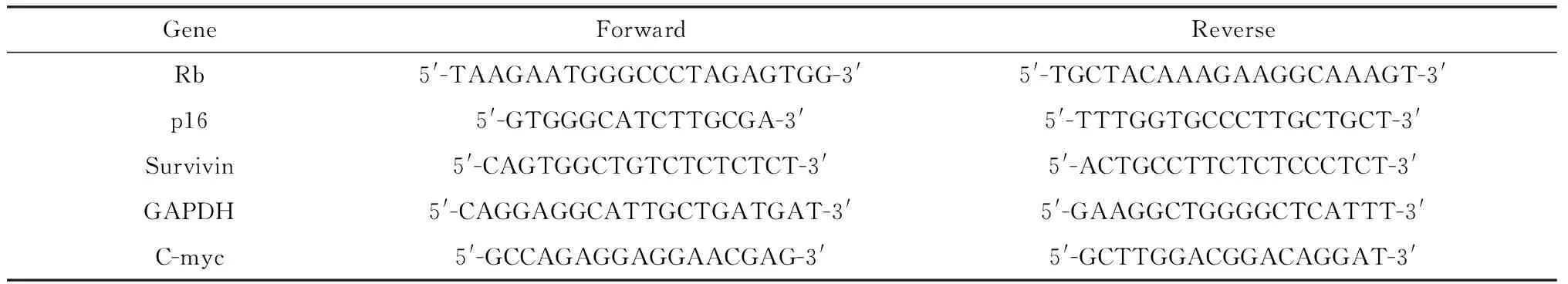
表1 定量PCR引物序列表Tab.1 Real-time PCR primer sequences
1.2.7ELISA 根据试剂盒说明书测定不同浓度U0126处理DPC的培养基中TGF-β1(R&D,DB100B)、TGF-β2(R&D,DB250)、IGF-1(R&D,DG100B)和8-oxo-dG(R&D4380-096-K、4380-192-K)的浓度。通过Varioskan Flash检测在450 nmol/L处光密度(OD)。
1.2.8透射电镜 本实验分为四组,分别为对照组、自噬激活剂雷帕霉素(rapamycin, RPM) 组、RPM+U0126组和U0126组。RPM组和U0126组分别单独用100 nmol/L RPM和20 μmol/L U0126 处理DPC 24 h,RPM+U0126组先用100 nmol/L RPM处理DPC 24 h后再用20 μmol/L U0126处理24 h。药物处理DPC结束后采用胰酶消化法收集DPC,进行固定、切片,再用透射电镜(日立ht7800)进行扫描。
1.3统计学处理 数据统一使用Microsoft Excel 2008 与 Graphpad Prism 8.0 进行数据采集、记录、运算与分析。差异比较采用one-way ANOVA分析,P<0.05表示差异有统计学意义。
2 结果
2.1U0126抑制DPC自噬 透射电镜观察U0126对自噬小体数的影响,结果显示,与对照组相比,RPM显著增多了DPC自噬小体数;与RPM处理组相比,RPM+U0126处理组显著减少了细胞内的自噬小体(图1a, 1d)。Western blot结果表明,与对照组相比,RPM显著升高了LC3Ⅱ/LC3Ⅰ比值;与RPM处理组相比,RPM+U0126处理组的LC3Ⅱ/LC3Ⅰ比值显著降低(图1b, 1c)。这些结果提示U0126抑制了DPC自噬。
Note:**P<0.01,***P<0.001 compared with the control;#P <0.05 compared with the RPM group. Transmission electron microscopy scanning of with U0126-treated and rapamycin-treated DPC, bar=500 μm;~ Western blot results of LC3-Ⅱ and LC3-Ⅰ in U0126-treated DPC; Number of autophagic vacuoles in Fig.1a图1 U0126对DPC自噬的影响Fig.1 Changes of DPC autophagy after treated with U0126
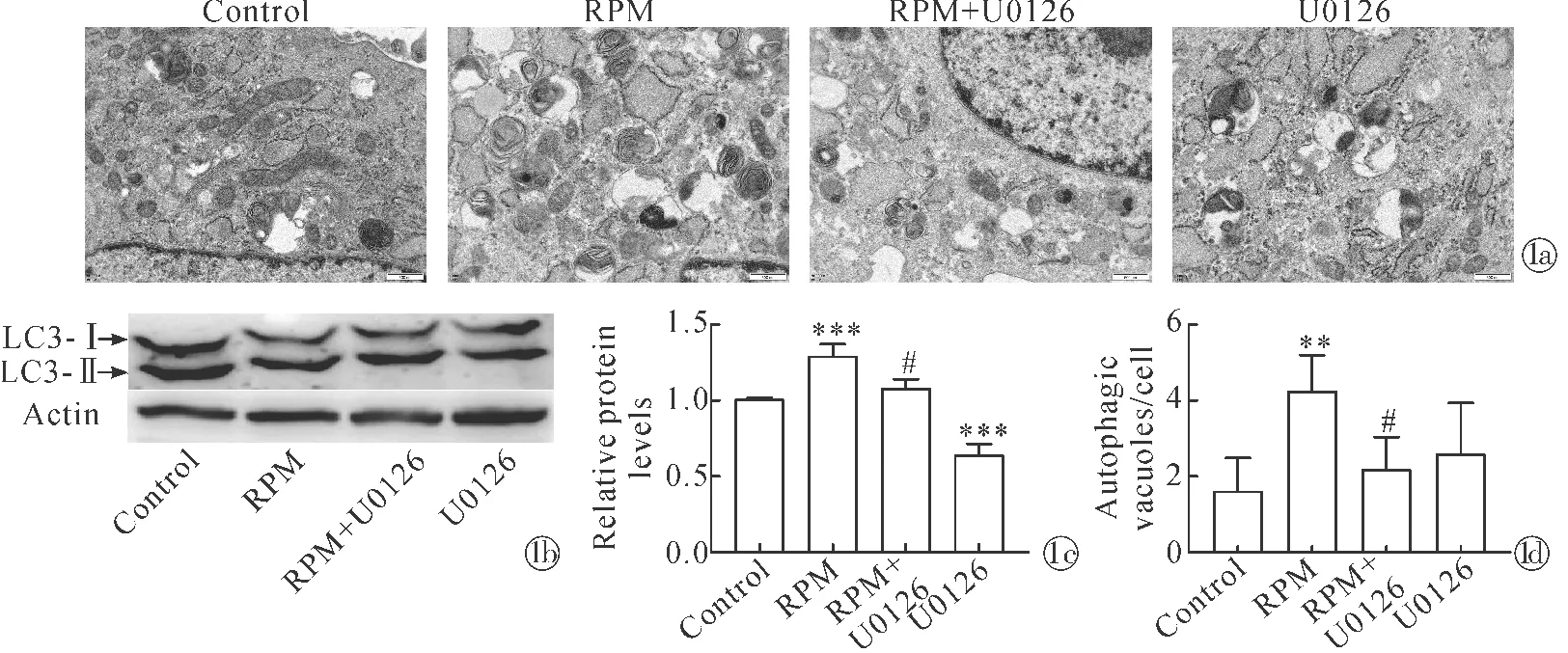
2.2抑制自噬后DPC早衰表型变化 采用SA-β-gal、Transwell等方法评估抑制自噬后对DPC表型的影响。SA-β-gal结果显示,20 μmol/L和30 μmol/L U0126处理DPC后,DPC衰老阳性率显著增加(图2a,2c)。Transwell实验结果显示,经U0126处理后DPC 迁移能力显著降低(图2b,2d)。Western blot和qPCR实验结果显示,经U0126处理后衰老相关蛋白p16的表达显著升高(图2e~2g)。这些结果提示DPC自噬被抑制后出现早衰表型。
Note:*P<0.05,**P<0.01,***P<0.001 when compared with the control group. The effect of U0126 on positive rate of DPC was detected by SA-β-gal, bar=200 μm; The effect of U0126 on cell migration was detected by transwell, bar=10 μm;The staining-positive DPC of SA-β-gal ; The color ration of transwell staining;~ Wes-tern blot results of p16 in U0126-treated DPC; The expression levels of p16 in U0126-treated DPC图2 U0126对DPC早衰的影响Fig.2 U0126-treated DPC exhibit senescent phenotype
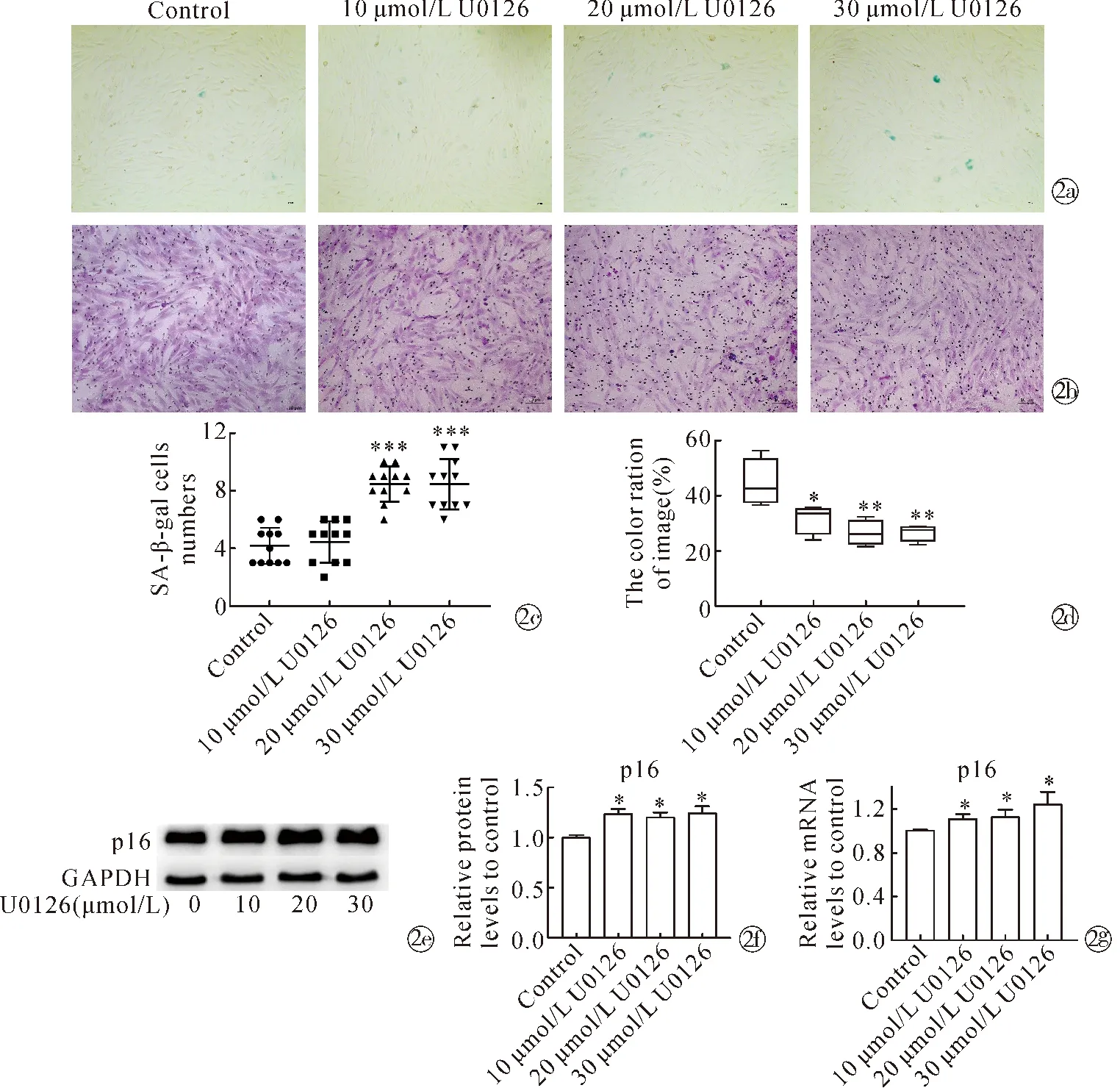
2.3抑制自噬后DPC分泌生物活性因子和毛囊生长周期因子的能力变化 与对照组相比,经U0126处理的DPC中C-myc、Survivin的蛋白表达和mRNA水平显著降低,此外还发现U0126处理DPC后视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)的表达降低(图3a~3c)。与对照组相比,经U0126处理的细胞上清中IGF-1浓度显著降低,TGF-β1和TGF-β2浓度显著升高(图3d)。这些结果提示DPC自噬被抑制后分泌影响毛囊生长周期因子的能力下降。
Note:*P<0.05,**P<0.01,***P<0.001 when compared with the control group.~ Western blot results of C-myc, Survivin, Rbin U0126-treated DPC; qPCR results of C-myc, Survivin, Rbin U0126-treated DPC; ELISA analysis was used to determine the levels of IGF-1,TGF-β1 and TGF-β2 in the culture supernatant of U0126-treated DPC图3 U0126对DPC分泌生物活性因子和毛囊生长周期因子能力的影响Fig.3 Effect of U0126 on the ability of DPC to secrete bioactive factors and hair follicle growth cycle factors
2.4抑制自噬后活性氧和DNA损伤的变化 为了验证U0126调节氧化应激过程,通过荧光探针DCFH-DA检测细胞内ROS水平变化。结果显示,经U0126处理后DPC内ROS水平显著升高(图4a)。有证据证实氧化应激诱导的DNA损伤是细胞衰老的驱动因素之一,因此,为了研究U0126处理后的细胞DNA损伤状态,通过ELISA分析目前公认的用于评估DNA氧化损伤的生物标志物8-oxo-dG变化,结果表明,经U0126处理后DPC内8-oxo-dG浓度显著升高(图4b)。
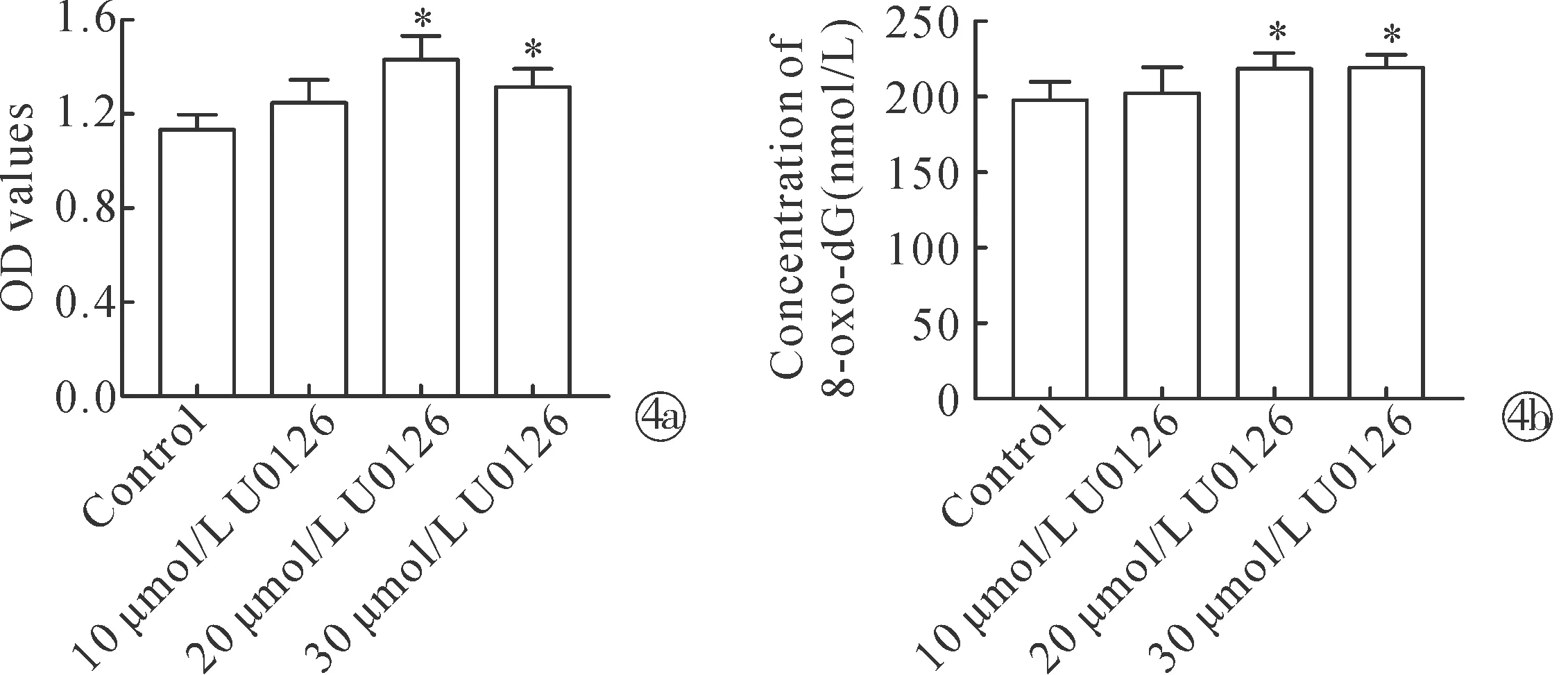
Note:*P<0.05 when compared with the control. ROS levels determined by the DCFH-DA fluorescence assay in U0126-treated DPC; Measurement of DNA oxidative damage using ELISA图4 U0126对DPC ROS和DNA损伤的影响Fig.4 U0126 affects ROS and DNA oxidative damage in DPC
3 讨论
衰老是一种生物学过程,其特征是细胞和功能的依赖性下降,导致生物体的质量下降。衰老的细胞会在衰老的组织和器官中积累,从而损害包括再生在内的生理过程,并导致机体衰老。细胞衰老可导致前列腺癌、肺癌、肝癌等疾病的发生,还可能加速雄激素脱发疾病的进程。
许多证据表明自噬的调节已成为不同物种衰老的一个特征。自噬底物以及受损的自噬调节对组织稳态的时间和空间影响方面的进展研究揭示了自噬与衰老之间的复杂和多因素关系[9]。由于自噬可以去除与衰老相关的受损细胞成分,这一过程在延缓衰老和衰老相关疾病方面发挥着重要作用。目前已有研究证实自噬通过氧化应激减少DPC炎症[10],自噬也可延缓雄激素诱导的DPC凋亡[11]。有证据表明,自噬在调节衰老中也有直接作用,比如抑制自噬加速了血管衰老[12],自噬激活剂诱导了乳腺癌细胞衰老[13]。因此,本研究为了验证自噬与DPC早衰之间的关系,选用U0126处理DPC建立自噬模型。结果发现与自噬激活剂组相比,经U0126处理的DPC组自噬小体数和自噬相关蛋白表达降低,表明U0126在DPC中成功建立自噬抑制模型。本研究抑制DPC自噬后发现SA-β-gal衰老阳性率和衰老相关蛋白p16的表达增加,细胞迁移能力降低,这些结果提示U0126促进了DPC早衰。
DPC早衰主要表现为非凝集性生长,细胞增殖能力下降或丧失,维持毛囊特性等因子表达减弱或丧失。具有凝集性生长的DPC分泌高水平的生长因子,如Survivin、C-myc,以维持其生长特性。本研究的结果发现DPC自噬被抑制后降低了Survivin和C-myc的表达。TGF-β信号是毛囊发育所必需的,DPC分泌的TGF-β1和TGF-β2可促进毛囊向退行期转变[14]。IGF-1是一种多功能调节生长因子,控制DPC增殖和毛囊干细胞的存活。DPC自噬被抑制后降低了分泌IGF-1的能力,增强了分泌TGF-β1和TGF-β2的能力,这使得毛囊生长周期缩短。这些结果提示抑制自噬导致DPC降低了诱导毛囊生长的能力。因此,进一步明确自噬失调促进DPC早衰的作用机制对于开发安全有效的药物具有十分重要的意义。
自噬失调驱动衰老主要通过氧化应激途径,也就是线粒体功能障碍后过度产生ROS的过程。近期有研究发现肌醇1,4,5-三磷酸受体和电压依赖性阴离子选择通道蛋白之间相互作用的增加导致粒体过度产生ROS从而驱动DPC早衰[15]。为了探讨抑制自噬后DPC是否也通过氧化应激途径驱动早衰,本研究检测了经U0126处理后DPC内ROS和DNA损伤,发现抑制自噬后DPC内ROS水平及DNA损伤程度增加,由此说明自噬失调驱动的DPC早衰与超过其生理抗氧化能力的ROS过度积累密切相关。
综上所述,本研究初步探讨了抑制自噬对DPC早衰的影响,发现自噬失调通过氧化应激途径促进了DPC早衰。了解抑制自噬诱导的DPC早衰的机制有望为AGA治疗提供新的策略,最大限度地减少暴露于双氢睾酮(DHT)水平升高的DPC衰老。
