1株梅花鹿源化脓隐秘杆菌的分离鉴定及其生物学特性分析
2023-07-07李俊锋赵自亮朱桓奕田宇森王迎平冯旭东赵光伟张立武杨晓伟
李俊锋 ,赵自亮,朱桓奕,田宇森,王迎平,冯旭东,刘 霞,赵光伟,,张立武,杨晓伟,*
(1.西南大学 动物医学院,重庆 荣昌 402460;2.贵州省动物疫病预防控制中心,贵州 贵阳550008;3.重庆三杰众鑫生物工程有限公司,重庆 荣昌 402460)
化脓隐秘杆菌(Trueperellapyogenes,TP),原称化脓放线菌(Actinomycespyogenes)、化脓棒状杆菌(Corynebacteriumpyogenes),属于放线菌科(Actinomycetaceae)隐秘杆菌属(Trueprerella),是一种无荚膜、无芽孢、无鞭毛、多形态的革兰阳性短棒状杆菌,兼性厌氧[1]。该菌于1893年首次在牛脓汁中分离到,目前在欧美、日本、巴西、中国等全球各地均有报道,其宿主范围很广,在家畜动物(如猪、牛、山羊)、野生动物(如大象、梅花鹿、麝香鹿等)以及伴侣动物(犬、猫等)均有报道[2-4]。该菌为条件性致病菌,是隐秘杆菌属中致病力最强的成员[5],能引起动物发生心内膜炎、肝脓肿、肺炎、乳房炎等多种组织器官脓肿以及流产、不孕等[6-7],给养殖业带来较大的经济损失。
迄今,已证实化脓隐秘杆菌毒力基因主要包括溶血素(PLO)、神经氨酸酶(NanA、NanP)、胶原结合蛋白(CbpA)和菌毛结合蛋白(FimA、FimC、FimE、FimG)。其中,PLO是一种外毒素,免疫原性强,为胆固醇依赖性溶细胞素家族的成员(cholesterol dpendent cytolysin,CDC)[8],能溶解多种动物的血细胞,是化脓隐秘杆菌最重要的1个致病因子[9],因PLO普遍存在于野生型的化脓隐秘杆菌菌株中,其特征在不同宿主源化脓隐秘杆菌中存在差异,因而是实验室检测以及细菌分型的常用靶标[10]。
本试验自重庆永川地区1只病死梅花鹿的肺脏组织中分离到疑似化脓隐秘杆菌的致病菌,进而对该菌进行系统的鉴定,并对其主要的生物学特性进行研究,以期为后续病原学研究和开发有效的生物制品提供参考。
1 材料与方法
1.1 病料及实验动物重庆永川某梅花鹿人工饲养场1只病死梅花鹿(18月龄),患病期间精神沉郁,食欲废绝,鼻有脓性分泌物,剖检其肺脏病变明显,有出血坏死。SPF昆明鼠120只(20~25 g,雌性),购自重庆国家生物产业基地实验动物中心。
1.2 主要试剂胰蛋白胨大豆琼脂(TSA)、胰酪大豆胨液体培养基(TSB)、细菌微量生化反应管及药敏纸片均购自杭州微生物试剂有限公司;特级胎牛血清(FBS)和一管式临床样品DNA抽提试剂盒均购自上海生工生物工程股份有限公司;2×Rapid Taq Master Mix和DL2000 Plus DNA Marker购自南京诺唯赞生物科技有限公司;革兰染色试剂盒购自北京索莱宝科技有限公司;引物合成及测序均由北京六合华大基因公司完成。
1.3 细菌分离无菌采集梅花鹿肺脏病变组织接种兔血TSA平板,置于37℃恒温培养箱中5%CO2培养24~48 h,观察生长状况及菌落特征,并继续传代纯化培养。挑取纯化后的单个菌落接种于含有5%胎牛血清(FBS)的TSB培养基中进行增菌传代,后加无菌甘油,冻存于-80℃保存备用。
1.4 16S rDNA测序鉴定及同源性分析使用一管式临床样品DNA抽提试剂盒提取纯培养细菌基因组,用于后续相关试验。细菌16S rDNA通用引物见表1,反应体系:2×Rapid Taq Master Mix 25 μL,上、下游引物各2 μL,基因组模板2 μL,加ddH2O补足至50 μL。反应条件94℃ 3 min;94℃ 15 s,54℃ 15 s,72℃ 15 s,35个循环;72℃ 5 min。产物经1.0%琼脂糖凝胶电泳检测后回收目的片段,送华大基因科技有限公司进行测序。测序结果在NCBI进行BLAST对比,并用DNAStar 7.0进行同源性分析。
1.5 分离菌革兰染色及生化鉴定勾取细菌制作涂片,对其进行革兰染色,观察细菌形态;纯化菌接种15种生化发酵管(杭州天河微生物试剂有限公司)进行生化试验,记录结果。
1.6 分离菌的生长曲线挑取纯培养单菌落接种于含5%FBS的TSB中37℃ 180 r/min培养36 h。将上述菌液按1%的比例接种于5 mL/管的TSB(5%FBS)中,设3个平行组,利用未接菌培养基做空白对照,37℃、220 r/min培养,从0 h开始每隔2 h 取1组测定D600 nm值,连续监测28 h,绘制该菌的生长曲线。
1.7 分离菌对小鼠的致病性试验吸取纯培养的菌液,0.2 mL/只(D600 nm=0.753)分别接种于小鼠皮下和腹腔,每组3只,观察小鼠的存活情况,并对病死小鼠的心脏、肝脏、肺脏及皮下化脓灶进行细菌分离培养;死亡小鼠迅速取其肝脏、脾脏、肺脏、肾脏及皮下化脓灶固定于福尔马林溶液,制作病理组织切片,HE染色观察病理变化。
1.8 分离菌对小鼠毒力的测定78只小鼠随机分为13组,每组6只,1~12组为感染组,分别经腹腔接种不同浓度的分离菌,分离菌浓度稀释参考赵明迪等[5]报道的方法;第13组为阴性对照组,仅注射等量生理盐水。连续7 d观察并记录小鼠的发病情况与死亡情况,根据改良寇氏法计算该分离株的半数致死量(LD50)。
1.9 分离菌的药敏试验根据抗菌谱选取β内酰胺类、氨基糖苷类和四环素类共23种药物,利用K-B纸片法进行药敏试验。
1.10 分离菌毒力基因检测参考林昶等[10]的报道,针对化脓隐秘杆菌PLO、NanH、NanP、CbpA、FimA、FimC、FimE和FimG共8个主要毒力基因对分离菌进行检测,引物序列详见表1。
1.11 分离菌PLO基因系统进化树的构建PLO基因拼接后将其序列上传至GenBank,将其氨基酸序列与牛、羊、犬、霍加狓等多种动物源化脓隐秘杆菌及其他相近属细菌构建系统进化树。

表1 本试验使用的引物信息
2 结果
2.1 分离菌形态分离菌接种兔鲜血琼脂平板培养48 h后,形成圆形、光滑、湿润、隆起、边缘整齐、直径1 mm的白色半透明小菌落,菌落周围出现明显的透明β溶血环(图1A);在含5%FBS的TSB中时,37℃、180 r/min震荡培养24 h,可见培养基轻度浑浊,试管底部出现少量白色絮状沉淀;革兰染色为阳性小杆菌,有两极浓染的现象(图1B),将该菌命名为YC-1。
2.2 生化鉴定结果YC-1能发酵木糖、蜜二糖、葡萄糖、棉子糖、阿拉伯糖、D-核糖、麦芽糖、蔗糖和乳糖,不能发酵覃糖、枸橼酸盐、甘露醇、动力试验阴性,MR和VP试验均为阴性。
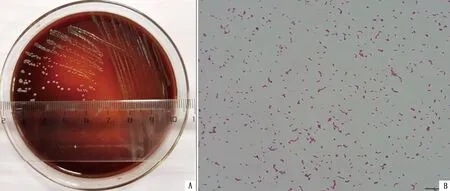
A.分离菌在兔血平板培养结果;B.分离菌革兰染色结果(×1 000)
2.3 分离菌16S rDNA基因扩增及进化树分析分离菌(YC-1)的16S rDNA扩增图见图2A。测序后经BLAST比对显示YC-1与各来源化脓隐秘杆菌同源性均在98%以上(图2B),其中与分离自野猪、野牛、黄牛、狒狒、猞猁等动物化脓隐秘杆菌同源性为100%,可以确认分离菌YC-1为化脓隐秘杆菌,这应是国内首次在此宿主分离到该菌。
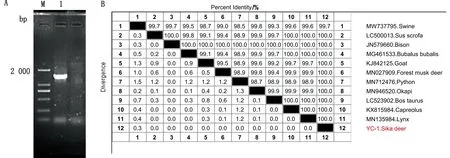
A.YC-1株16S rDNA扩增电泳图(M.DL2000 DNA Marker;1.PCR产物);B.YC-1株16S rDNA与其他动物源化脓隐秘杆菌的同源性比对结果
2.4 YC-1的生长曲线 化脓隐秘杆菌YC-1在37℃恒温摇床培养至2 h时细菌增长数量不明显,2~6 h 细菌生长开始加快,但此阶段生长速率仍较低;从6~10 h细菌增长速率明显加快,其生长曲线近似直线,此阶段为YC-1的生长对数期;生长至24 h 细菌生长达到最高峰,此时D600 nm值为0.946,随后细菌转入平台期至观察期结束(28 h)。
2.5 YC-1对小鼠的致病性YC-1皮下和腹腔接种小鼠后均能引起小鼠发病,皮下注射小鼠在注射部位形成约2 cm的脓肿(图3A),小鼠在感染后7 d死亡;腹腔注射小鼠在感染后3 d即发生死亡,剖检可见小鼠肝脏、肾脏、脾脏出血肿胀,腹腔中布满浓汁(图3B)。病理组织学观察发现小鼠肝脏细胞颗粒变性,坏死,细胞间质中有大量渗出物(图3C);脾脏白髓出血,淋巴细胞弥漫性增生(图3D);肺泡壁结果较完整,肺泡腔中有少量浆液性渗出物,内有炎性细胞(图3E);肾小球内皮细胞和上皮细胞增生,并伴有中性粒细胞和淋巴细胞的浸润(图3F);化脓灶中有大量中性粒细胞以及坏死的淋巴细胞(变性坏死的白细胞),结缔组织疏松或发生溶解,伴有出血(图3G)。
2.6 YC-1对小鼠的半数致死量根据改良寇氏法计算出化脓隐秘杆菌YC-1对小鼠的LD50为 6.80×1010CFU/mL。

A.皮下注射形成脓包(红色箭头指示);B.腹腔感染后白色脓汁充斥腹腔(蓝色箭头指示);C.肝脏组织病变(×200);D.脾脏组织病变(×100);E.肺脏组织病变(×200);F.肾脏组织病变(×200);G.化脓灶组织病变(×100)
2.7 YC-1药敏试验结果药敏结果显示(表2),YC-1对氨苄西林、青霉素、卡那霉素、四环素4种药物表现出不敏感,而对其药物仍较为敏感,药敏试验详细信息见表2。

表2 YC-1药敏试验结果
2.8 YC-1 毒力基因的检测结果PCR扩增(图4A)及测序结果显示,YC-1菌株中具有2种神经氨酸酶(NanH、NanP)、2种菌毛蛋白(FimA、FimE)和溶血素(PLO)共5个毒力基因,FimG、FimC和Cbpa 3个毒力因子未检测到。对溶血素PLO基因的测序结果显示其全长共1 605 bp,GC含量51.53%,共编码534个氨基酸,相对分子质量57.99 kDa,序列已上传至GenBank,登录号为OK513198。将YC-1菌PLO氨基酸序列与其他动物源化脓隐秘杆菌及相近种PLO序列构建遗传进化树(图4B),显示YC-1与霍加狓(长颈鹿科动物)源化脓隐秘杆菌最为接近,与山羊、牛、猪等哺乳动物源化脓隐秘杆菌次之,与其他相近种细菌亲缘关系较远。
3 讨论
尽管化脓隐秘杆菌是一种条件致病菌,但其致病力却不容忽视,当皮肤和黏膜出现机械损伤或其他病原感染时,该菌可迅速扩散至肺脏、肝脏、肾脏及其他组织器官,引起化脓性感染,继而导致败血症导致动物死亡[11]。本试验中分离的YC-1株就是1株典型的引起梅花鹿肺脏组织感染的致病菌,其临床病理表现与牛、羊、骆驼等偶蹄兽相似。由于梅花鹿经济价值高,本试验动物回归未采用原动物,而以小鼠作为替代,发现该菌在不同的接种途径下,既能导致皮肤产生脓肿,又能使小鼠的主要脏器出血、水肿,腹腔中脓汁蓄积,能够复制出与临床相似的症状;进一步的组织病理学观察发现小鼠主要脏器产生坏死、出血和炎性细胞浸润为主要特征的病变,这与以往的报道[12-13]一致,进一步的LD50试验说明YC-1株为一株较高致病力菌株,这为后续开发化脓隐秘杆菌的生物制剂奠定了基础。
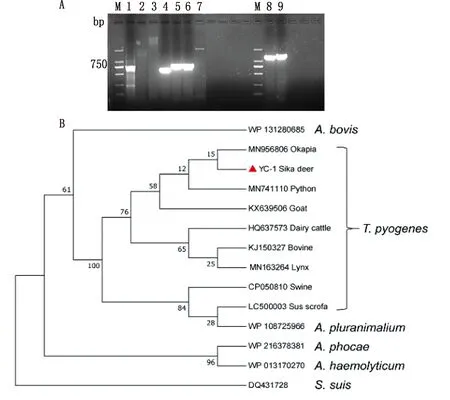
A.YC-1株毒力基因检测结果(M.DL2000 DNA Marker,1~9.毒力基因FimE、Cbpa、FimG、FimA、NanH、NanP、FimC、PLOg1、PLOg2;B.YC-1株PLO氨基酸序列与其他动物源化脓隐秘杆菌及相近种的系统进化树,红色三角代表本试验所分离的YC-1
细菌的致病力与其所携带的致病因子密切相关,溶血素、神经氨酸酶、胶原结合蛋白和菌毛结合蛋白是目前已经证实的与化脓隐秘杆菌毒力相关的致病因子[14]。本试验中YC-1株检测到2种神经氨酸酶(NanH,NanP)、2种菌毛蛋白(FimA,FimE)和溶血素(PLO)共5个毒力基因,其中PLO进化树分析显示与霍加狓源化脓隐秘杆菌最为接近,与其他动物源相对较远。根据以往的报道[12],PLO普遍存在于野生型化脓隐秘杆菌中,并且该基因的序列在不同宿主来源的菌株中会有所差别,本试验结果充分证实了这一点,因此根据PLO信息推测菌株宿主来源是可行的,同时该基因也是临床检测的优选靶点。
对于化脓隐秘杆菌的防控目前仍依赖于药物的治疗,筛选敏感的治疗药物是必由之路。本试验中YC-1株表现出对多种抗生素均敏感,利用筛选出的敏感药物对其他患病梅花鹿治疗取得较好的治疗效果。尽管如此,也不能忽视对该菌耐药性的跟踪监测,以防过度使用药物造成多重耐药菌株的出现。此外,本试验也对YC-1株在TSB培养基中的生长曲线进行了测定,其结果对了解化脓隐秘杆菌的生长特点,为后续开展发酵生产提供了数据参考。
综上,本试验在梅花鹿中分离到1株较强致病力的化脓隐秘杆菌,并对其主要的生物学特性进行了分析检测,其结果有助于化脓隐秘杆菌的防控;鉴于该菌对家畜、野生动物、伴侣动物乃至人类均具有潜在的致病威胁,因此对其进行深入的致病机制进行研究,开发有效的预防制剂等工作是十分必要的。
