犬圆环病毒EvaGreen实时荧光定量PCR检测方法的建立与初步应用
2023-07-07刘若寒李守军
董 杰,刘若寒,李守军,2,周 沛,2*
(1.华南农业大学 兽医学院 广东省兽医临床重大疾病综合防控重点实验室,广东 广州 510642;2.华南农业大学 兽医学院 广东省宠物工程技术研究中心,广东 广州 510642)
犬圆环病毒(canine circovirus,CanineCV)是一类无囊膜DNA病毒,病毒核酸为共价闭合的单链环状DNA分子,基因组大小为2.3 kb,病毒粒子大小为15~25 nm[1]。基因组序列分析显示CanineCV具有圆环病毒属典型的2个主要开放阅读框(open reading frame,ORFs):ORF1 编码复制酶蛋白(replication associatedprotein,Rep)和ORF2 编码衣壳蛋白(capsidprotein,Cap)[2]。脊椎动物CanineCV是通过重组进化而来,Rep基因的 N 端来自微小病毒,C末端来自类小 RNA 病毒。不同犬种的CanineCV Cap蛋白差异可达 8%,与Cap基因相比,Rep基因的变异程度更小,相对保守[3]。自2012年美国首次报道CanineCV以来,多个国家相继报道了从犬科动物中发现新的CanineCV毒株,说明在全球犬科动物群体中已呈现较为广泛的流行[2,4-12]。
CanineCV感染动物后引起的临床症状尚不明确,该病毒多与其他病原体混合感染,可能表现出许多不同的临床症状,以呕吐、出血性腹泻等为主要症状。因此检测CanineCV对于预防、控制和治疗犬圆环病毒病具有重要意义。
早期主要是通过高通量测序方法从犬血清样品中发现CanineCV。目前,在临床样本检测中,多以普通PCR为主,也有运用原位杂交、投射电子显微技术进行病理学检查[13]。相比普通PCR无法定量、敏感性差,原位杂交等技术操作复杂,耗时长等缺点,实时荧光定量PCR(real-time quantification PCR,qPCR )技术具有操作简单、敏感性高、重复性好等优点,在临床检测中更具优势。而EvaGreen qPCR具有PCR抑制率低[14]、可以使用较高浓度、稳定性强、安全性高等远胜于SYBR Green qPCR的优点。
在当下CanineCV理化特性、复制过程、致病性以及部分流行病学特征尚不明确的情况下,本研究拟建立1种基于EvaGreen染料的CanineCV qPCR检测方法,并利用该方法对广东地区收集的177份犬腹泻样本进行CanineCV检测分析,从而了解CanineCV在临床上的基本感染情况。
1 材料与方法
1.1 样本2019年4月-2020年12月,在广东省广州市、东莞市、惠州市、深圳市的部分宠物医院以及东莞市某犬收容所共采集腹泻犬只的血清样本114份以及肛拭子63份。所有样本在低温情况下运输至本实验室,并立即保存于-80℃冰箱。
1.2 病毒株、细菌与细胞所有病毒株CanineCV-DG由广东省兽医临床重大疾病综合防控重点实验室分离鉴定并保存。
阳性对照病毒和细菌:犬瘟热病毒(canine distemper virus,CDV)、犬细小病毒(canine parvovirus,CPV)、犬流感病毒(canine influenza virus,CIV)、猫细小病毒(feline panleukopenia virus,FPV)、猫杯状病毒(feline calicivirus,FCV)病毒株以及大肠杆菌菌株由本实验室分离鉴定并保存;犬冠状病毒(canine corona virus,CCoV)、犬腺病毒2型(canine adenovirus 2,CAV2)、犬副流感病毒(canine parainfluenza virus,CPIV)、犬钩端螺旋体C-51株和黄疸出血型钩端螺旋体NADL株,此八联苗弱毒株为硕腾辉瑞公司产品。F81细胞由本实验室保存。
1.3 主要仪器与试剂TaKaRa梯度PCR仪购自宝日医生物技术(北京)有限公司;NanoDrop One超微量分光光度计购自赛默飞世尔科技(中国)有限公司;Roche LightCycler®480 Ⅱ qPCR仪购自罗氏诊断产品(上海)有限公司;DH5α感受态细胞(TRELIEFTM5α Chemically Competent Cell,货号:TSC01)购自北京擎科新业生物技术有限公司; pMD18-T载体(货号:D101A)购自宝日医生物技术(北京)有限公司。
1.4 引物的设计与合成在NCBI网站上下载全部CanineCV的全基因组序列,使用Mega X 10.1.8进行序列比对,在Rep基因的保守区设计引物qPCR-F/R,用于构建CanineCV的EvaGreen qPCR检测方法(表1)。
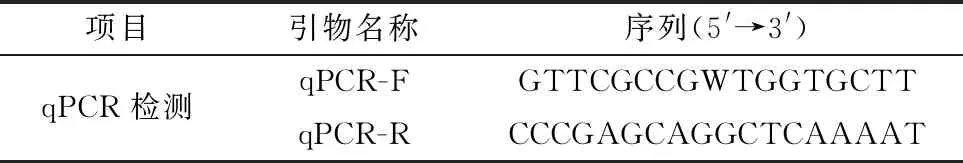
表1 试验设计引物
1.5 构建EvaGreen qPCR检测阳性参考质粒使用qPCR-F/R引物,以CanineCV-DG全基因为模板,利用GeneStar 2×Taq PCR StarMix预混酶扩增EvaGreen qPCR检测方法所需的PCR产物,将纯化后的PCR产物与pMD18-T载体进行连接,构建阳性参考质粒。经PCR鉴定阳性的菌液送至北京擎科新业生物技术有限公司广州分公司进行测序,对构建正确的质粒进行批量制备,作为EvaGreen qPCR检测的阳性参考质粒。
1.6 CanineCV EvaGreen qPCR反应条件的优化根据标准品模板的条件,反应的总体系为20 μL,以阳性参考质粒为模板,其中Bio-Rad SsoFastTMEvaGreen®SuperMix预混酶 10.0 μL,质粒模板1.0 μL,上、下游引物0.6 μL(终浓度为300,400,500 nmol/L),剩余体系用无核酸酶水补齐。扩增条件为预变性95℃ 30 s;变性95℃ 5 s;退火(56,57,58,59℃ 20 s,45个循环;熔解曲线程序为95℃ 15 s;58℃ 1 min;95℃延伸。通过比较熔解曲线、熔解峰、交叉阈值(crossing point,Cp)值等判定出最适条件。
1.7 EvaGreen qPCR检测方法标准曲线的建立使用优化后的反应条件进行标准曲线的建立。根据以下公式[15]将EvaGreen qPCR阳性参考质粒的质量浓度(mg/L)转换为对应的粒子拷贝数(copies/μL):粒子拷贝数(copies/μL)=6×1023(copies/μL) ×质粒质量浓度(g/mL)/MW(g/mol)。用无核酸酶水将已知质量浓度的阳性参考质粒直接进行10倍倍比稀释,共稀释9个数量级(109~103copies/μL)。使用本研究优化后方法进行检测,每个数量级皆设置3个组内重复,结果由Roche LightCycler®480 Ⅱ qPCR仪器自带软件自动生成分析。
1.8 EvaGreen qPCR检测方法的灵敏度验证取3.88×109copies/μL阳性参考质粒依次进行10倍倍比稀释,共9个数量级(109~101copies/μL)的阳性参考质粒作为检测模板,分别进行普通PCR扩增和EvaGreen qPCR扩增。
普通PCR扩增使用GeneStar 2×Taq PCR StarMix预混酶,反应程序为:预变性94℃ 2 min;变性94℃ 30 s;退火57℃ 30 s;延伸72℃ 30 s,变性、退火、延伸程序进行30个循环;终延伸72℃ 5 min。
EvaGreen qPCR使用本研究优化后方法进行扩增,每个数量级皆设置3个组内重复,结果由Roche LightCycler®480ⅡqPCR仪器自带软件生成分析。
1.10 EvaGreen qPCR检测方法的特异性检验为验证本研究所建方法的特异性,提取CDV、CPV、CIV、FPV、FCV、CAV2、CCoV、CPIV、犬钩端螺旋体C-51株和黄疸出血型钩端螺旋体NADL株以及大肠杆菌菌株的核酸作为模板,使用本研究优化后方法进行检测,每个病原体的检测反应设置3个组内重复,结果由RocheLightCycler®480ⅡqPCR仪器自带软件生成分析。
1.11 EvaGreen qPCR检测方法使用优化后的CanineCV EvaGreen qPCR检测方法对114份犬血清样本以及63份肛拭子临床样本总核酸进行检测,以基因组DNA作为模板进行扩增,使用本研究优化后方法进行检测,结果由Roche LightCycler®480ⅡqPCR仪器自带软件生成分析。
2 结果
2.1 EvaGreen qPCR阳性参考质粒的构建以CanineCV-DG为模板,使用qPCR-F/R引物可扩增出目的片段,并将其连接在pMD18-T克隆载体上,构建阳性参考质粒,将其转化至DH5α感受态细胞进行扩大培养。图1为阳性参考质粒的菌液PCR鉴定结果,可见明亮清晰的217 bp单一条带,位置与阳性对照一致,说明阳性参考质粒构建成功。
2.2 EvaGreen qPCR检测方法的优化通过优化引物浓度、退火温度来确定EvaGreen qPCR检测CanineCV的最佳条件。经对反应体系的优化后确定最佳退火温度为58℃、最佳引物浓度为300 nmol/L。
最终确定EvaGreen qPCR检测反应体系(表2)和反应程序:预变性95℃ 30 s;变性95℃ 5 s;退火58℃ 20 s,变性、退火程序进行45个循环;熔解曲线程序为95℃ 15 s;58℃ 1 min;95℃延伸。结果结合扩增曲线和Cp值一起判读,如果扩增曲线高于软件根据背景荧光产生的阈值线,则认为检测的样本为阳性。
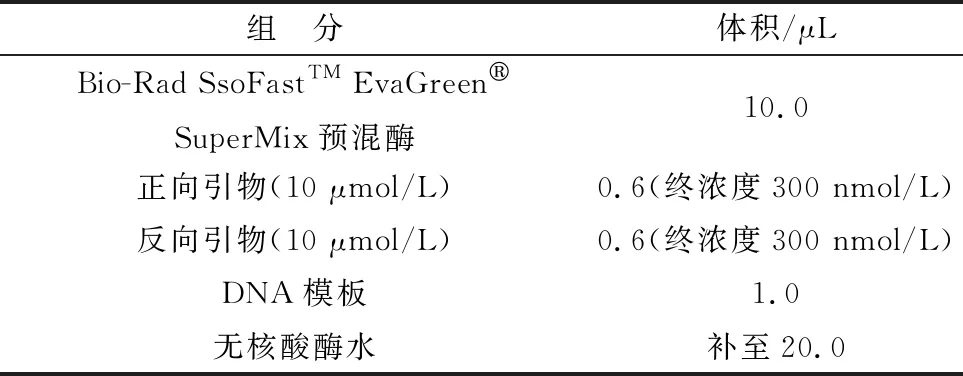
表2 EvaGreen qPCR检测反应体系
2.3 EvaGreen qPCR检测方法的标准曲线将阳性参考质粒进行10倍梯度稀释,获得3.88×103~3.88×109copies/μL的阳性参考质粒,以此作为模板,在最优退火温度58℃和最优引物浓度300 nmol/L条件下进行EvaGreen qPCR标准曲线的建立。扩增曲线(图2),标准曲线图由罗氏LightCycler®480 Ⅱ仪器自带软件分析生成(图3),标准曲线呈现出良好的线性回归,纵坐标y为Cp值,横坐标x为标准样本拷贝数科学计数法因数10的对数,建立的回归方程为y=-3.457x+41.460,扩增效率Efficiency=1.946,误差值Error=0.010 8。利用GraphPad Prism8.0.1进行数据分析,得到相关系数R2=0.999 5,说明该线性回归模型具有较好的拟合性。

A~G.3.88×109~3.88×103 copies/μL的阳性参考质粒
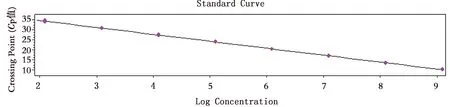
图3 EvaGreen qPCR检测标准曲线
2.4 EvaGreen qPCR检测方法的灵敏度将阳性参考质粒进行10倍梯度稀释,得到3.88×109~3.88×101copies/μL的阳性参考质粒,以此作为模板进行灵敏度检测。首先进行普通PCR的检测,普通PCR检测的检测极限为3.88×103copies/μL(图4)。在最优退火温度和最优引物浓度条件下进行EvaGreen qPCR检测,其检测极限为3.88×101copies/μL(图5)。
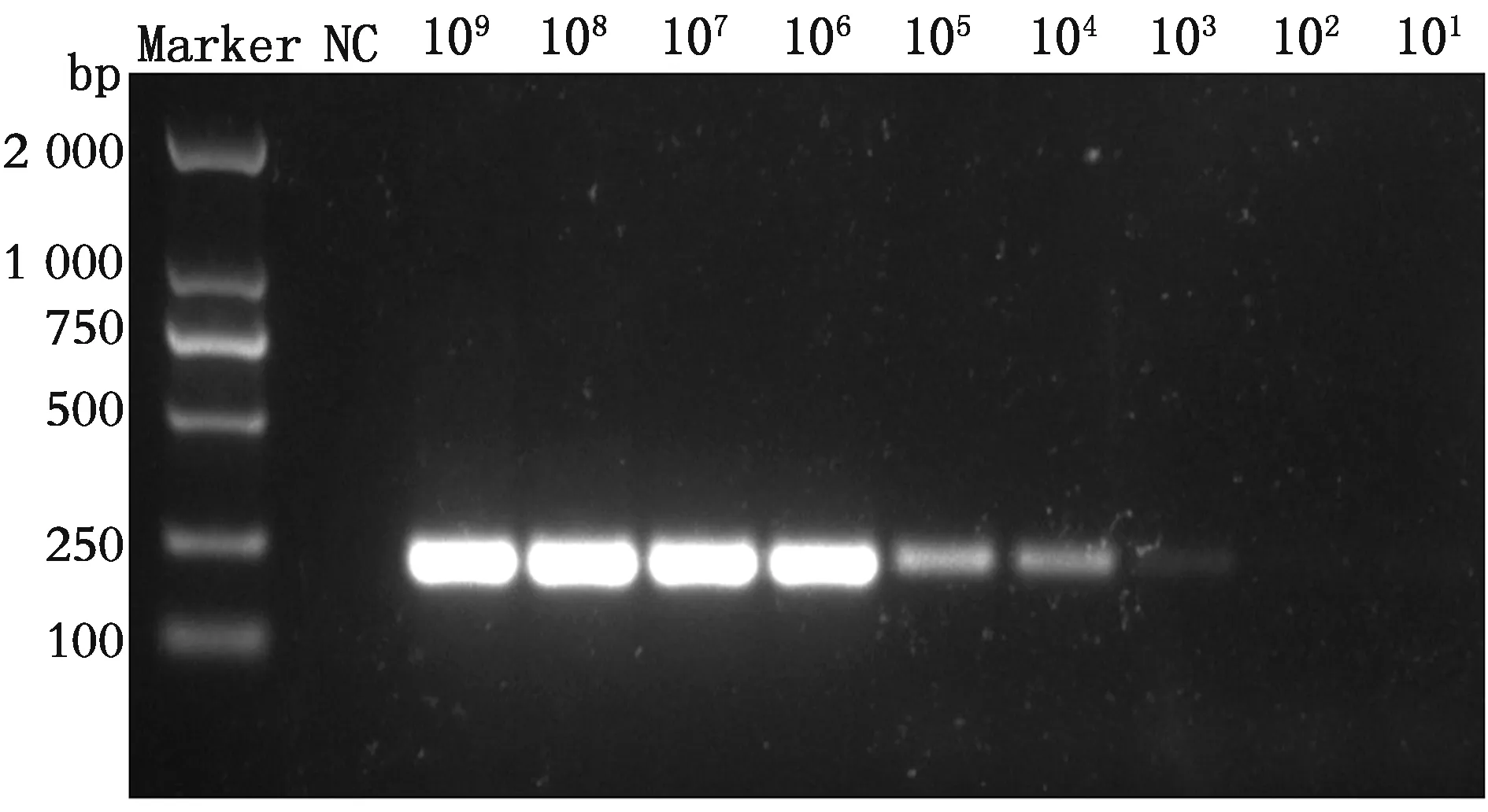
图4 阳性参考质粒PCR灵敏度琼脂糖凝胶电泳图

A~I.3.88×109~3.88×101 copies/μL的阳性参考质粒
2.5 EvaGreen qPCR检测方法的重复性使用浓度为3.88×105,3.88×106,3.88×107copies/μL的阳性参考质粒作为模板,进行重复性试验。每次每组包含3次技术性重复。组内重复和组间重复s值小,且CV均小于2%,说明组内重复和组间重复Cp值数据离散程度小,重复性好,可信度高(表3)。
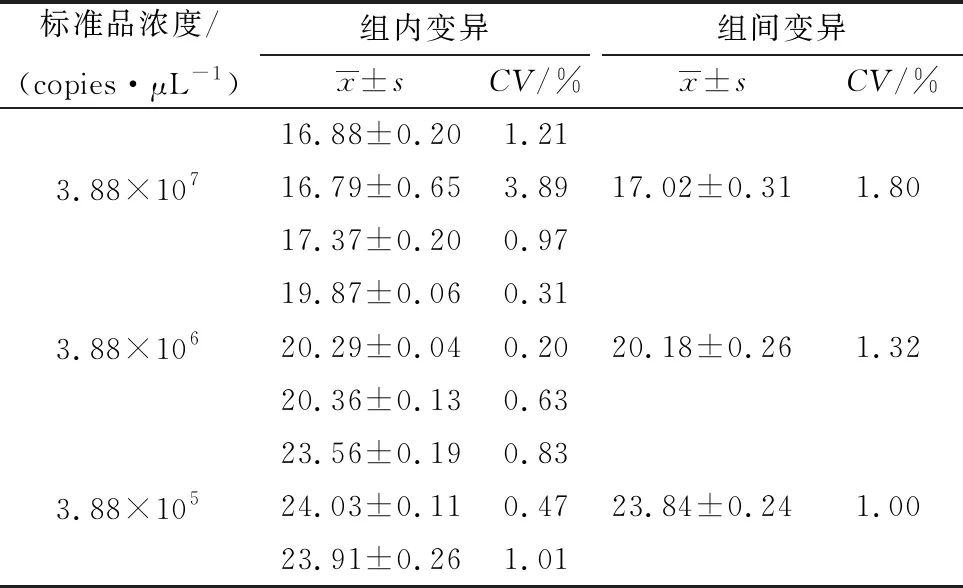
表3 重复性试验Cp值分析(n=3)
2.6 EvaGreen qPCR检测方法的特异性采用本研究建立的CanineCV EvaGreen qPCR检测方法,使用CDV、CPV、CIV、FPV、FCV、CAV2、CCoV、CPIV、犬钩端螺旋体C-51株和黄疸出血型钩端螺旋体NADL株以及大肠杆菌菌株的核酸作为模板进行检测,验证本方法的特异性。CanineCV具有清晰的扩增曲线和明显的单一熔解峰,而CDV、CPV、CIV、FPV、FCV、CAV2、CCoV、CPIV、犬钩端螺旋体C-51株和黄疸出血型钩端螺旋体NADL株以及大肠杆菌菌株与阴性对照均未出现清晰的扩增曲线和明显的熔解峰,未出现特异性扩增,说明本研究建立的CanineCV EvaGreen qPCR检测方法具有良好的特异性(图6)。
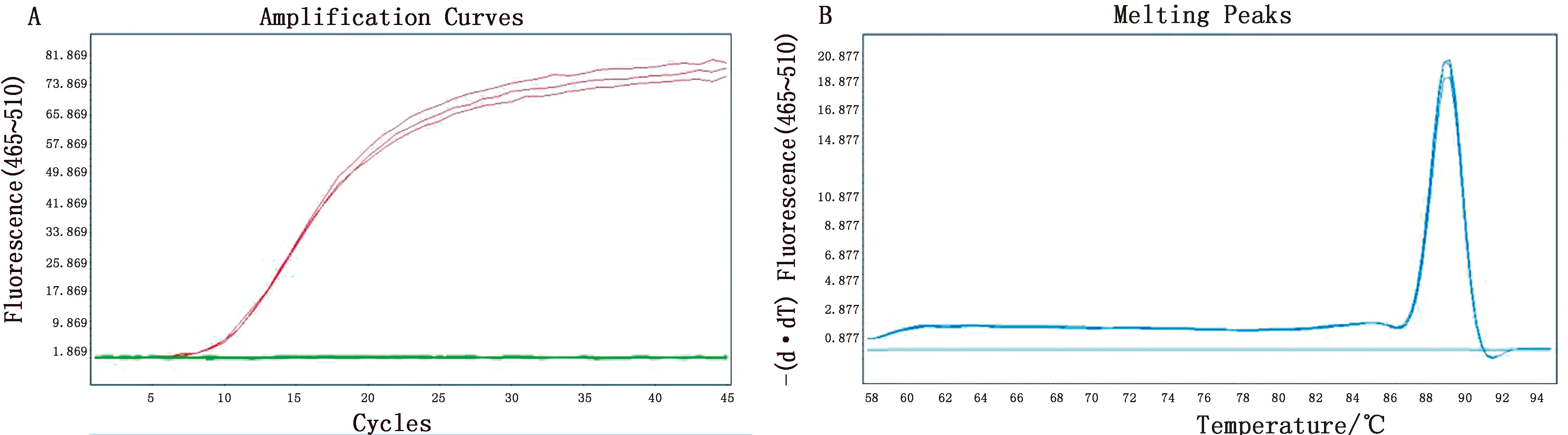
A.扩增曲线;B.熔解峰
2.7 EvaGreen qPCR检测方法采用本研究建立的CanineCV EvaGreen qPCR检测方法对采集的177份临床样本进行检测,检出阳性样本共5份,其中也包括本研究前期使用犬肠道病原体多重PCR检测出的2个CanineCV阳性样本。EvaGreen qPCR方法检出CanineCV的阳性率为2.82%(5/177),高于普通PCR检测的CanineCV阳性率1.13%(2/177)。仅通过EvaGreen qPCR方法检出的CanineCV阳性样本中,3及4号来自东莞某犬收容所的腹泻犬肛拭子样本,5号来自东莞某动物医院的腹泻犬肛拭子样本(表4)。

表4 EvaGreen qPCR阳性样本Cp值(n=3)
3 讨论
目前,CanineCV在世界多个国家均有报道[2,9-10,12,16-18]。在我国四川、重庆、黑龙江和广西等地区犬中均有CanineCV的陆续报道[19-22],可见CanineCV已经在我国广泛流行。因此,建立一种快速、灵敏、高效、安全的检测方法对CanineCV的感染进行监测具有现实意义。
目前,大多数研究人员使用SYBR Green染料来构建CanineCV的qPCR检测方法,SYBR Green染料可以显示出很强的荧光信号,但已有研究证实SYBR Green Ⅰ染料会抑制PCR反应,可定量的扩增区域有限,且检测的重复性低于其他染料[26]。EvaGreen染料是一种新型绿色荧光核酸染料,与SYBR Green染料相比,EvaGreen染料对PCR扩增的抑制作用较小,不易引起非特异性扩增,且稳定性强[13]。
CanineCV的Rep基因与Cap基因相比,变异程度小、更加保守[3],理论上基于Rep基因所建立的qPCR方法比基于Cap基因建立的方法更高效实用。所以,本研究通过比对GenBank上所有CanineCV的Rep基因中的高保守区,在此区域设计1对引物,建立检测CanineCV的EvaGreen qPCR方法。
本方法的标准曲线呈现出较高拟合性的线性回归。熔解曲线分析表明该方法可扩增出特定产物,可作为检测CanineCV的可靠工具。CanineCV更容易出现与其他病原体混合感染的情况[27],因此高特异性是其检测的必须要素。结果表明,该方法对CDV、CPV、CIV、CPIV、CAV2、CCoV等犬常见病原的检测均无交叉反应,特异性良好。与基于SYBR Green染料的CanineCV的qPCR检测方法相比[19],EvaGreen具有更加优异的特异性熔解曲线,说明该方法特异性更高,避免了病毒含量低时,检测结果与引物二聚体以及其他病原体影响造成的假阳性结果混淆。
应用本研究构建的EvaGreen qPCR方法,对114份犬血清及63份肛拭子样品进行了二次筛查,结果EvaGreen qPCR方法检出CanineCV的阳性率为2.82%(5/177),除了犬肠道病原体多重PCR方法检测出的2份阳性样本外,另有3份分别来自东莞某犬收容所的2份腹泻犬肛拭子样本,及东莞某动物医院提供的1份腹泻犬肛拭子样本,且这3份样本均混合感染了CPV。通过检测可以看出本研究建立的EvaGreen qPCR方法检出下限低于犬肠道病原体多重PCR方法,很好地解决了病毒粒子拷贝数低时检出率低的问题。
综上,本研究成功建立了一种用于快速检测CanineCV的EvaGreen qPCR方法,该方法使用安全且具有较好的特异性、敏感性和重复性,可作为CanineCV感染的检测工具。
