金鱼草TPS基因家族的全基因组鉴定和表达模式分析
2023-07-05石森堡谯正林王凤仪胡慧贞陈龙清
石森堡,谯正林,王凤仪,胡慧贞,陈龙清
(西南林业大学园林园艺学院/云南省功能性花卉资源及产业化技术工程研究中心,昆明 650224)
【研究意义】萜烯类化合物是植物中最大的一类次生代谢产物,在植物生长发育阶段具有多种功能[1],例如吸引传粉者、释放挥发性报警素、抑菌等,在植物与环境互作过程中发挥着重要作用[2-4],引起人们广泛关注。萜烯合酶(Terpenoid synthase, TPS)是合成萜烯类物质的关键酶,在植物生长发育过程中具有多种功能。金鱼草(AntirrhinummajusL.)为车前科金鱼草属多年生草本植物,其花型独特、色泽丰富、花香浓郁,是重要的切花及花坛花卉;具有清热解毒、凉血消肿之功效,药用价值较高;种子营养丰富,可榨油食用。同时,金鱼草是研究花卉发育的重要模式植物。萜烯类化合物作为金鱼草花香挥发物中占比最大的一类,研究其形成机理对于金鱼草花香种质的创制及品种培育具有重要意义。萜烯合酶基因TPS是催化萜烯类有机化合物合成的关键酶基因,对TPS基因的鉴定和萜烯类化合物的合成机制是当前研究的热点之一。【前人研究进展】TPS基因有7个亚家族:TPS-a、TPS-b、TPS-c、TPS-d、TPS-e/f、TPS-g和TPS-h。其中,TPS-a、TPS-b和TPS-g是被子植物特有的分支,TPS-d主要集中在裸子植物中[5],而TPS-h到目前为止仅在卷柏中发现[6-7]。萜烯类化合物的合成途径已较为清晰,主要由2条途径生成,即甲羟戊酸途径(MVA)[8]和甲基赤藓醇磷酸途径(MEP)[9]。MVA途径发生在细胞质中,两分子的异戊烯基焦磷酸(IPP)和一分子的二甲基烯丙基焦磷酸盐(DMAPP)在法尼基二磷酸合酶(FPPS)的催化下缩合生成法尼基二磷酸合酶(FPP),该物质是倍半萜的天然前体[10]。MEP途径在质体中发生,一分子IPP和一分子DMAPP在香叶基二磷酸合酶(GPPS)催化下头尾缩合形成的牻牛儿基二磷酸盐(GPP)是所有单萜的普遍前体。一分子DMAPP与三分子IPP在牻牛儿基牻牛儿基焦磷酸合成酶(GGPPS)的作用下缩合生成牻牛儿基牻牛儿基焦磷酸(GGPP),是二萜合成的前体[3]。虽然MVA和MEP 2条途径相互独立,但IPP及其异构体DMAPP是这2条途径的通用前体,可以通过质膜进行转运[1,8]。2019年发布的金鱼草全基因组精细图谱[11]为金鱼草基因功能研究和分子育种奠定了基础。目前对金鱼草萜烯类化合物的研究主要集中在相关单萜和倍半萜合酶基因的表达及验证上。例如橙花醇/芳樟醇(AmNES/LIS-1和AmNES/LIS-2)合酶为双功能酶,在质体中生成芳樟醇,而在胞质中生成橙花醇[12-13]。罗勒烯合酶(ama0a23)与月桂烯合酶(ama1e20、ama0c15)基因也被分离并鉴定[13]。此外,Wright等[14]发现,月桂烯和I-β-罗勒烯生物合成基因的表达和/或相应酶会受到底物香叶基二磷酸亲和力的控制,导致月桂烯和(E)-β-罗勒烯释放量的不同。Zeng等[15]发现,金鱼草中两种单萜烯[月桂烯和(E)-β-罗勒烯]的排放受内源调节剂的影响。【本研究切入点】随着越来越多的植物全基因组图谱的发布,利用生物信息学来挖掘物种功能基因已成为重要手段。目前已完成拟南芥(Arabidopsisthaliana)、水稻(OryzasativaL.)、葡萄(VitisviniferaL.)、番茄(SolanumlycopersicumL.)等物种TPS基因家族鉴定和分析[16-19],但AmTPS基因家族的相关研究尚未报道。【拟解决的关键问题】本研究以金鱼草全基因组数据为基础,筛选AmTPS基因家族成员,利用生物信息学方法鉴定AmTPS基因,并对基因结构、蛋白保守基序、顺式作用元件进行分析,探讨TPS基因家族成员的系统进化、染色体定位和共线性、相关酶蛋白质理化性质并进行了亚细胞定位预测,通过qRT-PCR分析候选基因在不同器官中表达水平,并利用GC-MS测定其花香成分,确定金鱼草主要花香挥发性萜烯类化合物生物合成的TPS基因,为进一步解析AmTPS基因家族的功能奠定基础。
1 材料与方法
1.1 供试材料
以金鱼草矮株花雨系列粉色品种(A.majusL.‘Floral Showers Rose Pink’,以下简写为SR)为植物材料,栽植于云南省昆明市西南林业大学后山温室大棚内,在自然光和20 ~ 25 ℃下正常生长。在盛花期取其花、叶、茎、根等组织于冻存管中,立即放入液氮冷却,后放入-80 ℃冰箱备用。
1.2 数据来源
本研究使用金鱼草基因组数据[11]。从拟南芥信息资源网站TAIR(https://www.arabidopsis.org/)下载拟南芥TPS蛋白序列,番茄TPS蛋白序列来自Falara[19]的研究,水稻、冷杉(Abiesfabri)、江南卷柏(Selaginellamoellendorffii)的TPS蛋白序列来自Yu等[20]的研究。
1.3 试验方法
1.3.1 金鱼草TPSs基因家族鉴定 利用TBtools提取金鱼草基因组CDS并转化为蛋白序列。拟南芥的TPS蛋白序列与金鱼草蛋白序列作BLAST比对(E-value<1×10-5),获得候选AmTPS基因,将获得的序列比对到SwissProt数据库去除重复,再利用NCBI的CDD-Search、PFAM、SMART进一步筛选,同时含有PF03936、PF01397保守结构域的为AmTPS基因。
1.3.2 保守基序和基因结构分析 利用在线软件MEME(https://meme-suite.org/meme/)对AmTPS基因进行蛋白保守基序分析,根据AmTPS基因序列及基因组GFF3数据进行基因结构分析,TBtools可视化。
1.3.3 顺式作用元件分析 为确定TPS基因在金鱼草中的潜在生物学作用,提取AmTPS基因起始密码子(ATG)上游2000 bp序列,利用线上软件PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对AmTPS基因启动子区域的顺式作用元件进行分析。
1.3.4 系统发育分析 利用1.2得到的蛋白数据,使用软件Clustal 11.0将AmTPS蛋白进行序列比对,对gap或者两端的冗余序列进行处理,在序列较短的情况下,人为手动删除、调整。使用软件MEGA 11构建邻接法(Neighbor-Joining Method,NJ)系统发育树,设置Bootstrap值为1000,并利用iTOL美化系统发育树。
1.3.5 染色体定位与共线性分析 使用金鱼草基因组数据,通过TBtools进行利用染色体定位及可视化。
1.3.6 蛋白理化性质分析 利用ExPASy(https://www.expasy.org/)数据库预测AmTPS蛋白质的等电点、分子量、脂肪族系数、不稳定系数、亲水/疏水性等理化性质。亚细胞定位预测使用线上软件Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)和WoLF PSORT tools(https://wolfpsort.hgc.jp/)。
1.3.7 不同器官的qRT-PCR表达分析 用北京艾德莱生物公司RNA试剂盒提取金鱼草根、茎、叶、花(盛开期)的总RNA。用博迈德生物公司M-MLV4 First-Strand cDNA Synthesis Kit合成第一链cDNA。通过软件Premier 5进行qRT-PCR引物设计(表1),以金鱼草泛素基因(AmUBI)为内参[21]。qRT-PCR参照HieffTM qPCR SYBR®Green Master Mix试剂盒(上海)说明书,反应为体系20 μL;反应程序为95 ℃ 1 min,95 ℃ 10 s,60 ℃ 5 s,72 ℃ 12 s,40个循环;3次生物学重复。基因的相对表达量采用2-ΔΔCT计算。

表1 金鱼草AmTPS基因家族的 qRT-PCR引物
1.3.8 GC-MS花香成分测定 本研究采用固相顶空微萃取技术对金鱼草盛花期花朵挥发物进行收集,使用气相色谱-质谱联用仪(GC-MS)对挥发性成分进行分析鉴定。
2 结果与分析
2.1 金鱼草TPSs成员的鉴定
以TPS蛋白保守的C端(PF03936)和N端(PF01397)结构域的隐马尔可夫模型(HMM)作为查询文件,与金鱼草基因组双向BLAST。除去冗余序列,将所获得的TPS基因提交到NCBI-CDD Search中进一步验证TPS保守结构域的存在,共鉴定出30个AmTPS基因,将已鉴定的AmTPS基因命名为AmTPS1~AmTPS30(表2)。

表2 金鱼草TPS基因家族的基本特征
2.2 金鱼草TPSs基因结构和蛋白保守基序分析
如图1所示,以AmTPSs蛋白序列构建系统发育树,30个AmTP蛋白分布在4个亚家族中。基因结构显示,AmTPS基因外显子数量在3~13个,其中AmTPS2含有外显子数量最多(13个),而AmTPS8含有外显子数量最少(3个)。17个AmTPS基因(56.7%)有7个外显子。大多数聚类在一组的AmTPS基因有相似的外显子-内含子结构,特别是在外显子长度与数量方面,相似的基因也会聚类在一起。

图1 金鱼草TPS基因结构分析
对AmTPS蛋白的20个保守基序进行分析表明(图2),基序2(DD×XD)出现次数最多,每个基因均至少出现1次,共出现31次(AmTPS2出现2次)。其次为基序1,共出现29次,除AmTPS1、AmTPS10未出现,AmTPS2出现2次外,剩余AmTPS蛋白均出现1次。基序16出现次数最少,仅出现6次。AmTPS2比较特殊,具有最多的保守基序,共出现32个保守基序,除基序15、基序17仅出现1次,基序16、基序18、基序20未出现外,其余基序均出现2次,且2次基序顺序具有极高的一致性。AmTPS13、AmTPS7显示最少的保守基序(仅7个),但后者基序11出现2次。尽管不同簇之间的基序类型不尽相同,但在同一簇内的AmTPS蛋白通常具有相似的基序,暗示AmTPS蛋白系统发育模型可能受到基序位置的影响。

图2 金鱼草TPS蛋白保守基序分析
2.3 金鱼草TPSs基因启动子顺式作用元件的鉴定
AmTPS基因顺式作用元件可分为植物生长与发育,抗逆、胁迫响应和植物激素响应三类顺式元件(图3)。在植物生长与发育类元件(411/801)中,发现了13种参与光响应、分生组织表达(CAT-box)、开花表达(CCAAT-box)、昼夜节律调控(circadian)、栅栏叶肉细胞分化(HD-Zip1)、醇溶蛋白代谢(O2-site)和种子特异性调节(RY-element)的顺式元件,其中G-box元件占比最高,为27%。在所有顺式元件中,抗逆、胁迫响应元件(69/801)较少,仅有5种,分别是缺氧诱导相关的GC-motif,低温、干旱相关的LTR、MBS,防御压力相关的TC-rich repeats,以及参与黄酮类合成的MBSI。激素响应元件(321/801)数量仅次于植物生长与发育元件,由脱落酸响应元件(ABRE、ARE)、赤霉素响应元件(GARE-motif、P-box、TATC-box)、水杨酸响应元件(TCA-element)、茉莉酸甲酯响应元件(CGTCA-motif、TGACG-motif)以及生长素响应元件(AuxRR-core、TGA-box、TGA-element)组成。综合上述,其生长与发育元件最多,抗逆、胁迫响应元件较少,可能是长期人工种植的结果。

图3 金鱼草TPS启动子中顺式作用元件的分析
2.4 金鱼草TPS蛋白序列系统进化分析
系统发育树结果表明,TPS蛋白分为7个亚家族[5]。AmTPS家族成员含有4个亚家族,96.66%的AmTPS蛋白集中在3个亚家族TPS-a、TPS-b、TPS-g之中,分别占比15/30、5/30、9/30,其中2/3的AmTPS属于TPS-a或TPS-b亚家族;TPS-e/f 亚家族中仅有AmTPS7。如图4所示,在TPS-a亚家族中,双子叶植物(金鱼草、番茄、拟南芥)和单子叶植物(水稻)分别聚类,与前人研究结果TPS-a1、TPS-a2一致,表明TPS-a亚家族是独立进化的[6]。与之相似的还有TPS-c,在单子叶和双子叶植物中分别聚类[22]。TPS-d亚家族并非裸子植物特有的,在菠萝(Ananascomosus)与地钱(Marchantiapolymorph)中也有发现[7];而TPS-h仅存在于江南卷柏中[23]。
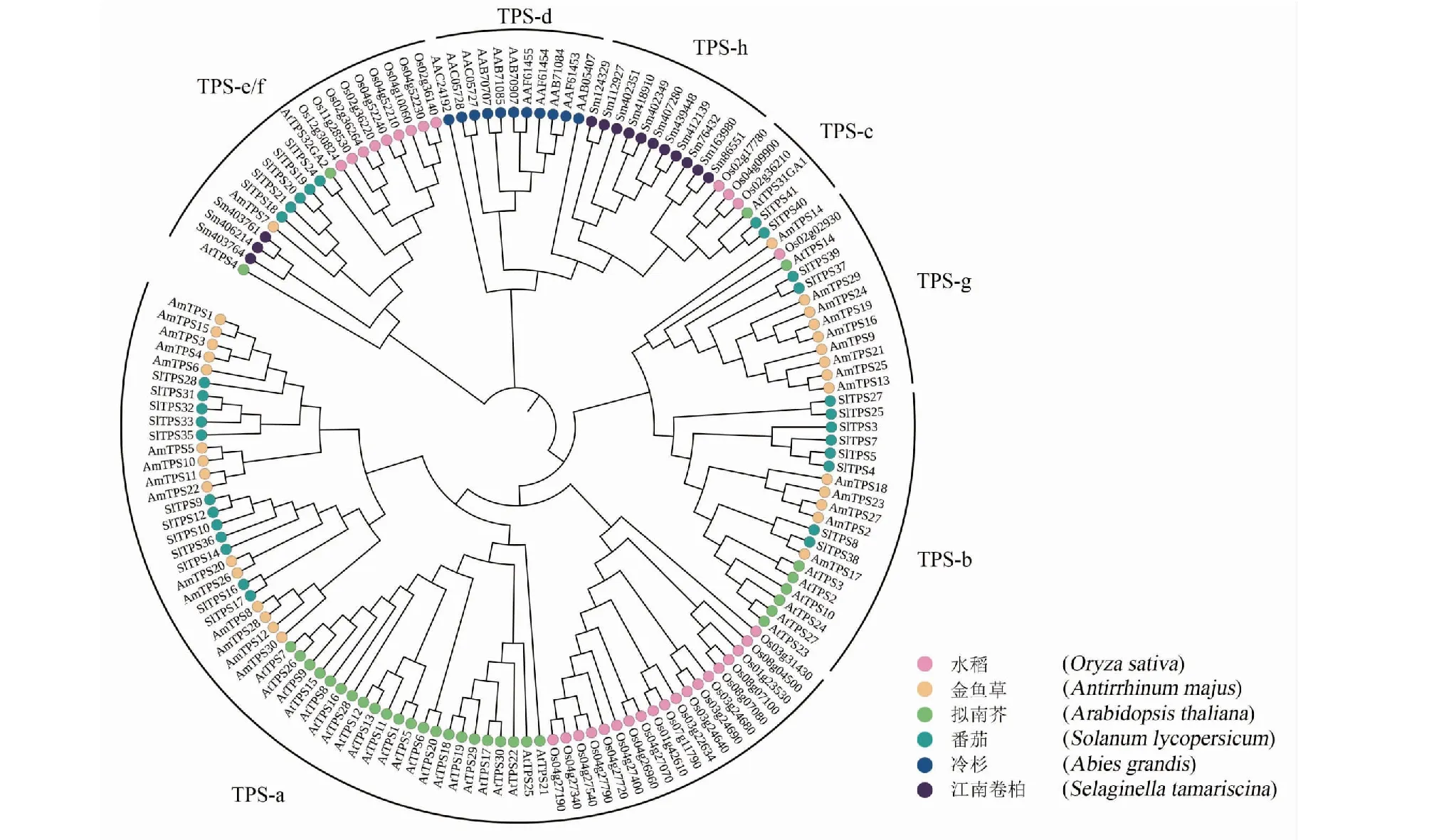
图4 6种高等植物中TPS蛋白的系统发育树
2.5 金鱼草TPSs基因染色体定位和共线性分析
如图5所示,AmTPS基因定位在1、2、5、6、8号染色体,其中2号染色体中TPS基因数量最多(19个)。其次为1号和5号染色体,各出现5和4个TPS基因,6号和8号染色体各有1个TPS基因。从亚家族分类情况来看,TPS-a在4条染色体中均有分布,但主要集中在2号染色体上;TPS-b主要集中在5号染色体上,在1号染色体中仅存在TPS17;TPS-e/f定位在2号染色体中;TPS-g仅出现在2号染色体上,且定位较为集中。基因复制事件显示,AmTPS基因仅在AmTPS28和AmTPS12以及AmTPS5和AmTPS10之间存在串联重复(图4)。为研究AmTPS基因在进化过程中受到何种选择,计算了非同义突变频率(Ka)和同义突变频率(Ks)的比值(表3),发现AmTPS串联复制基因对的Ka/Ks值为0.4078,比值小于1,说明所有AmTPS复制事件在金鱼草进化过程中都受到了纯化选择。

红色、橙色、绿色和蓝色分别表示TPS-a、TPS-b、TPS-g、TPS-e/f;红弧线表示串联重复。

表3 金鱼草TPS基因同义和非同义替换率及其比值
2.6 金鱼草TPS蛋白理化性质及亚细胞定位预测分析
如表2所示,AmTPS开放阅读框(ORF)为873~3372 bp,预测氨基酸数量(AA)为291~1124 aa。蛋白分子量(MW)为34.392~131.778 KDa;理论等电点(pI)为4.98~6.98,均小于7,为酸性氨基酸;疏水平均值(GRAVY)为-0.464 ~ -0.24,均小于0,属于亲水蛋白;AmTPS蛋白的脂肪族指数(AI)为80.78~97.8;蛋白不稳定指数(II)为34.19~56.58,11/30为稳定蛋白,19/30为不稳定蛋白。Plant-mPLoc预测除AmTPS7定位于细胞核中,其余基因均定位于叶绿体;WoLF-PSORT预测8/30定位于叶绿体,20/30定位于细胞质,仅2/30定位于细胞核中;AmTPS亚细胞定位复杂,准确定位需进一步验证。
2.7 金鱼草TPSs基因在不同器官的表达水平
qRT-PCR分析表明,AmTPS基因具有不同的组织特异性,在特定组织部位高表达,在部分组织中低表达甚至不表达。如图6所示,AmTPS14、AmTPS26在花中未表达,AmTPS23、AmTPS28在叶片中未表达,AmTPS11、AmTPS12、AmTPS20、AmTPS23、AmTPS28、AmTPS30在茎中没有表达,而在根部中,AmTPS14、AmTPS23、AmTPS26基因均未显示表达量。此外,不同的亚家族基因的表达量也有所不同。在TPS-a亚家族(共15个基因)中,9个基因在叶中的表达量高于花,6个基因在花中的表达量高于叶,但两者间的表达量无显著差异。TPS-b亚家族中,除AmTPS18在叶中的表达量高于其它部位,其它基因在花中的表达量均最高。TPS-g亚家族(共9个基因)主要合成无环单萜,其中6个基因在花中的表达量极高,是叶中表达量的数十至数百倍,在茎、根中的表达量却极低。金鱼草TPS-e/f亚家族成员AmTPS7基因在花和叶中的表达量近似,根和茎中的表达量也相似。整体而言,AmTPS基因家族的表达量呈现出花中最高,叶中次之,根、茎最低的趋势。
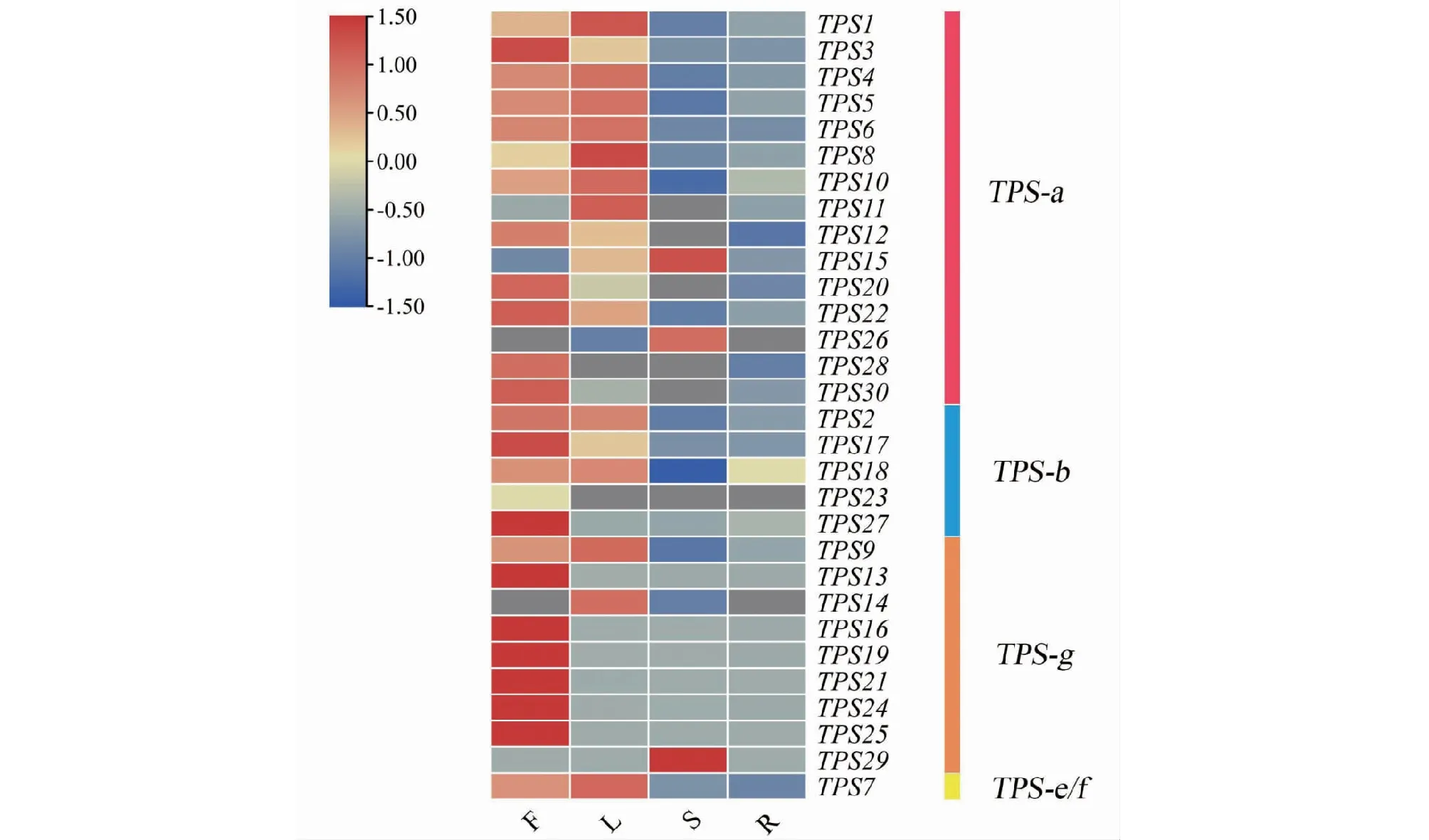
F.盛开期的花;L.叶;S.茎;R.根;灰色.无表达。
2.8 金鱼草GC-MS花香成分分析
在金鱼草盛花期共鉴定出11种化合物(表4),其中TPS-g亚家族基因特异合成的无环单萜罗勒烯、别罗勒烯、月桂烯和芳樟醇相对含量占比80.51%,而环状单萜紫苏醇仅为0.01%,此外也有少量苯类、酮、酚类等化合物。该结果与AmTPS家族基因表达模式吻合,TPS-g亚家族基因合成的无环单萜为金鱼草花香挥发性萜烯化合物的主要贡献者,在金鱼草生命活动中具有重要生物学意义,值得后续进一步研究。

表4 金鱼草SR品种花香成分
3 讨 论
萜烯类化合物是植物第一大类次生代谢产物[15],在植物生命活动中扮演重要角色,TPS基因对植物萜烯化合物合成至关重要。TPS基因家族属于中等基因家族,在不同植物中的数量一般为20~150个[5]。目前,TPS家族在很多植物中已受到初步关注,大量TPS基因被鉴定出来,例如拟南芥(32个)[16]、番茄(29个)[19]、铁皮石斛(Dendrobiumofficinale,34个)[20]、葡萄(152个)[24]等。本研究在金鱼草中共鉴定出30个TPS基因,分布在4个亚家族(TPS-a,TPS-b,TPS-c,TPS-e/f,TPS-g)中,其中TPS-a亚家族是倍半萜产生的主要合成酶,基因数量占整个金鱼草AmTPS家族的一半,推测金鱼草倍半萜种类较多;此外,基因组分析表明,TPS-a亚家族出现的2次串联重复使该亚家族的基因数量得到拓展。TPS-g(9个)亚家族因缺乏保守结构域R(R)x8W而合成无环单萜[25],在AmTPS家族中占比近1/3,远远大于多数其它已报道的植物[23, 26-27],推测无环单萜类化合物种类在金鱼草中占比较高。
启动子是否具有光响应元件对萜烯类化合物的合成规律有一定影响,在一定程度内,萜烯类化合物的产生与光照强度和光照时间成正比[21]。金鱼草AmTPS启动子含有大量光响应元件,推测金鱼草萜烯类化合物的合成、积累与释放受到光的调控。TPS基因在很多植物中都具有组织特异性,尤其在花中表现明显。PbTPS-b和PbTPS-e/f亚家族在荧光蝴蝶兰(Phalaenopsisbellina)花瓣中表达量最高,合成大量单萜[28];春兰(Cymbidiumgoeringii)中,CgTPS-a基因在花瓣中优势表达,合成大量倍半萜[29];番茄(Solanumlycopersicum)中,挥发性单萜在花瓣和成熟叶片中释放量明显高于其他组织,且SlTPS-g相关基因在这两个组织中也高表达[30]。本研究中金鱼草AmTPS-g基因在花中优势表达,合成并释放大量无环单萜,表明上述TPS亚家族的表达受到严格的空间调控。
4 结 论
本研究共鉴定出30个AmTPS基因,序列长度差异较大,亚细胞定位比较复杂。顺式作用元件分别为植物生长与发育,抗逆、胁迫响应和植物激素响应三类,其中生长发育中相关元件最丰富。30个AmTPS聚类在TPS-a、TPS-b、TPS-g和TPS-e/f亚族中,定位在5条染色体上。荧光定量结果显示,AmTPS主要在花器官中高表达,其中TPS-g亚家族差异表达量最高。而GC-MS结果显示,金鱼草花香成分中无环单萜为主要挥发物,推测TPS-g亚家族是金鱼草无环单萜类挥发物合成的关键基因。以上结果为进一步解析AmTPS基因功能提供一定方向。
