外源基质对乌红天麻根际土壤微生物多样性及酶活性的影响
2023-07-05李妍昕石汝杰
张 含,龚 敏,李妍昕,石汝杰
(重庆三峡学院生物与食品工程学院/三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404120)
【研究意义】药用天麻为兰科真菌营养型多年生草本植物天麻(GastrodiaelataBl.)的干燥块茎,是我国传统名贵中药材之一,也是历史悠久的药食两用资源。天麻原名赤箭,始载于《神农本草经》,被列为上品[1]。天麻富含酚类、多糖、甾醇、有机酸等活性成分,具有镇静、降压、抗炎、抗氧化等作用,在临床上主要用于治疗心脑血管病、冠心病、神经衰弱、头痛眩晕、惊风抽搐等[2-8]。由于无序开采导致野生天麻资源日益匮乏,且多代的无性繁殖导致麻种退化,栽培天麻的产量和品质逐渐下降,威胁着中药材品质及临床安全。满足市场对天麻的巨大需求,保障天麻的供给,对促进天麻产业发展具有十分重要的意义。传统人工种植天麻需消耗大量的土地资源,投入成本较高,因此林下仿野生栽培是目前天麻药材生产的主要形式之一。【前人研究进展】林下栽培一方面可使天麻充分利用林地中的枯枝落叶,提高了林地的利用率,另一方面林下凋落物加速了土壤养分积累,影响土壤微生物群落多样性[9]。土壤微生物是凋落物分解过程中的重要分解者,也是保障土壤可持续利用、调控土壤微生态环境稳定性的重要组成部分。研究表明,药用植物根际分泌物会影响根际土壤微生物群落的多样性及结构,而根际土壤微生物群落结构的改变会影响药用植物的次生代谢物质,从而导致抗逆性减弱、减产及病虫害加剧[10-14]。天麻为异养生物,为其生长发育提供营养的蜜环菌质量直接影响天麻的产质量,也有研究表明,天麻、蜜环菌、土壤三者间存在一定的生态循环关系[15-16]。因此,微生物在林下天麻的生长发育过程及种植土壤的生态环境中扮演着重要角色。【本研究切入点】目前有关栽培模式、菌材种类对天麻产量及土壤性质的影响研究较多,但缺乏不同外源基质处理下天麻根际土壤微生态变化的研究,其对作物根际土壤中微生物群落结构的影响研究更少,不能满足对天麻实际生产的理论指导要求。因此,研究不同栽培方式下乌红天麻种植土壤理化性质与微生物群落的变化对于进一步解析耕作机理具有重要的现实意义。【拟解决的关键问题】本研究在不同栽培基质条件下,利用Illumina Miseq高通量测序技术分析重庆市万州区乌红天麻种植基地的土壤微生物群落组成、结构和多样性,并与土壤酶活性进行相关性分析,探究不同外源基质处理下土壤理化性质驱动微生物群落变化的土壤微生物学机制,以期揭示栽培措施改良土壤生态环境和提升天麻产质量的土壤微生态学机理,为林下天麻种植提供科学依据。
1 材料与方法
1.1 试验地概况
试验地位于重庆市万州区龙驹镇梧桐村乌红天麻林下种植基地(30°38′49.69″N,108°42′32.21″E),海拔1115 m,年平均气温17.7 ℃,年均降水量1250 mm,雨量充沛,年均无霜期280 d。种植基地土壤为沙壤土,其基本理化性质:pH 6.66,有机质含量34.94 g/kg,速效氮含量67.42 mg/kg,速效磷含量13.97 mg/kg,速效钾含量43.45 mg/kg。
1.2 试验材料
供试天麻品种为乌红杂交天麻,购自重庆康诺菌业有限公司。
1.3 试验设计
采用窝栽的方式,在整平的床底摆上青冈木及3~4袋蜜环菌菌棒,菌棒两侧及两端摆上麻种,每个处理用种量均为1.5 kg,随后覆土并覆盖2~3 cm厚的树叶保湿。共设4个外源基质覆土处理,分别为HSS处理(火山石+原土,体积比1∶1混合)、NT处理(泥炭+原土,体积比1∶1混合)、ZS处理(蛭石+原土,体积比1∶1混合),以原土不添加基质为对照处理(CK),原土为种植基地的林下沙壤土。种植穴长×宽×深为1 m×1 m×0.15 m,其中火山石用量101 kg、泥炭用量60 kg、蛭石用量95 kg,分别与等体积的土壤充分混匀施用,每个处理重复3次。
1.4 土壤样品采集
2021年10月26日采集乌红天麻根际土壤样品,去除地表枯枝落叶及0~5 cm厚土壤,将乌红天麻连同周围的土体取出后,抖掉根系外围土,取根表附近的土壤,剔除石砾和植物残根等杂物;将多个采样点的土壤混匀后运用四分法取500 g土样装入无菌袋密封,编号后装入采集箱;将土样均分为2份,1份用干冰包埋后迅速转回实验室-80 ℃保存,用于土壤微生物的多样性分析;1份运回实验室风干,用于土壤酶活性分析。
1.5 测定指标及方法
1.5.1 土壤酶活性测定 土壤酶活性参照关松荫[17]、杨兰芳等[18]和黄娟等[19]的方法测定:蔗糖酶和纤维素酶活性采用3,5-二硝基水杨酸比色法测定,过氧化氢酶活性采用紫外分光光度计法测定,脲酶活性采用改良靛酚蓝比色法测定,酸性磷酸酶和碱性磷酸酶活性采用磷酸苯二钠比色法测定,β-葡糖苷酶活性采用硝基酚比色法测定,荧光素二乙酸酯(FDA)水解酶活性采用荧光素比色法测定。每个处理设置3次重复,并设无底物、无土壤处理作为对照。
1.5.2 土壤微生物多样性分析 采用CTAB方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物,New England Biolabs公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR扩增,确保扩增效率和准确性。PCR产物使用2%琼脂糖凝胶进行电泳检测;对检测合格的PCR产物进行磁珠纯化,采用酶标定量,根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶电泳检测PCR产物,对目的条带使用QIAGEN公司提供的胶回收试剂盒回收产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq 6000系统进行上机测序。
基于Illumina NovaSeq测序平台进行双末端测序(Paired_End),分别对乌红天麻根际土壤细菌16S rRNA基因的V3~V4区和真菌ITS1区序列进行高通量测序,扩增细菌16S rDNA基因引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[20],真菌ITS1区段引物为ITS1-1F-F(CTTGGTCATTTAGAGGAAGTAA)和ITS1-1F-R(GCTGCGTTCTTCATCGATGC)[21]。通过对每个样本的Reads进行拼接、过滤、去嵌合体等预处理,对有效数据(Effective tags)默认以97%的一致性聚类为OTUs(Operational taxonomic units,操作分类单元),根据样本序列物种分类学注释结果,统计各个样本的物种在门、纲、目、科、属和种水平上的分类单元数量。测序工作委托北京诺禾致源科技股份有限公司完成。
1.6 数据处理
在北京诺禾致源科技股份有限公司微生物多样性云分析平台(https://magic.novogene.com/),使用Qiime软件(Version 1.9.1)计算Chao1、Shannon、Simpson、ACE、Goods-coverage指数,使用R软件(Version 2.15.3)绘制Rank abundance曲线和PCoA图,并进行Alpha和Beta多样性指数组间差异分析;使用R软件中的vegan包进行Mantel_test分析,使用R软件中的psych包绘制环境因子Spearman相关性热图。利用Microsoft Excel 2016分析数据并制作表格,利用Origin 2021绘制柱状图,运用IBM SPSS Statistics 23软件进行不同处理的差异显著性分析。本研究以3次重复的测定值的算术平均值进行统计分析。
2 结果与分析
2.1 根际土壤酶活性
如图1所示,各处理的β-葡糖苷酶活性间无显著性差异,但土壤蔗糖酶、纤维素酶、过氧化氢酶、脲酶、酸性磷酸酶、碱性磷酸酶和FDA水解酶活性表现出显著性差异。与CK处理相比,HSS处理下的FDA水解酶活性显著提高235.88%;NT处理下的纤维素酶、酸性磷酸酶和碱性磷酸酶活性分别较CK处理显著提高249.40%、76.47%和173.15%;其中ZS处理的蔗糖酶、过氧化氢酶和脲酶活性在4个处理中均表现为最高,较CK显著提高21.16%、29.67%和249.05%;HSS、NT处理的蔗糖酶和过氧化氢酶活性无显著性差异。
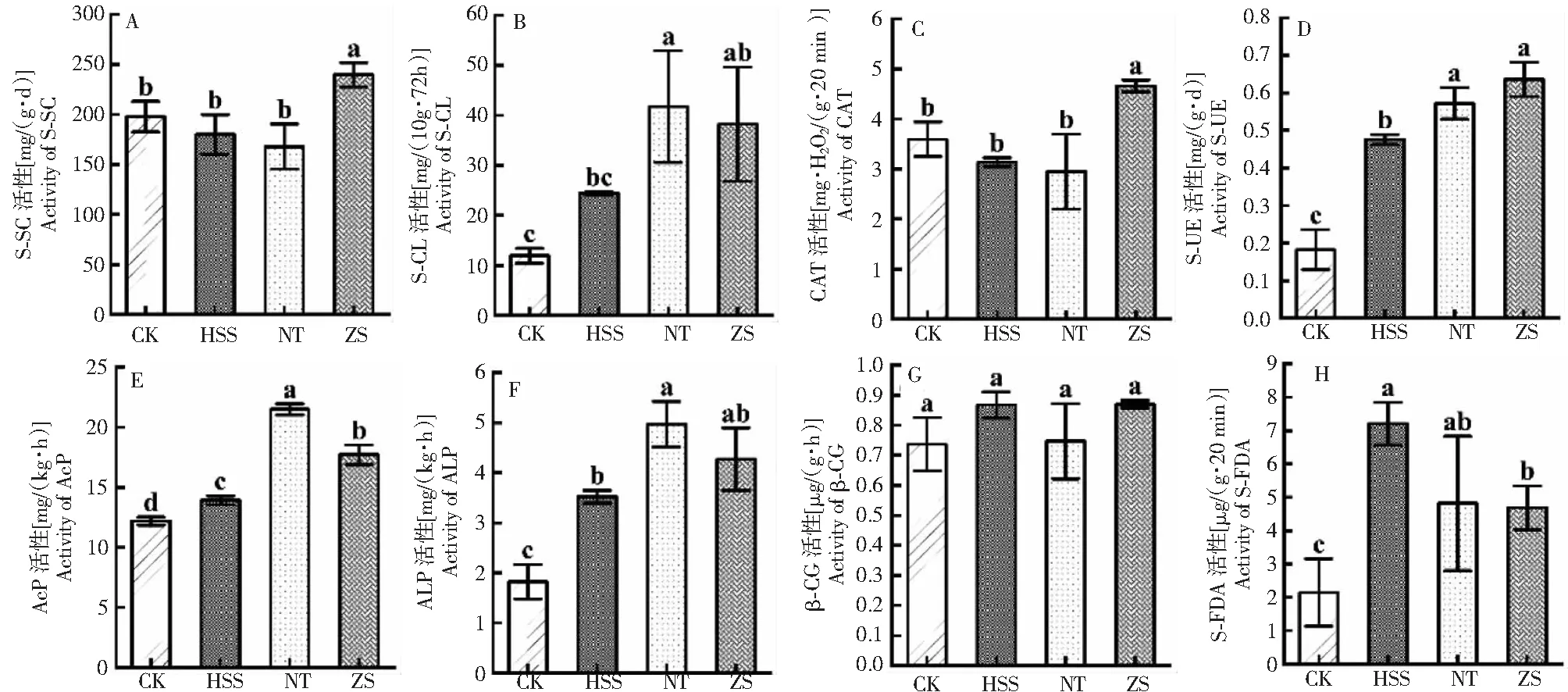
A. 蔗糖酶 S-SC;B. 纤维素酶 S-CL;C. 过氧化氢酶 CAT;D. 脲酶 S-UE;E. 酸性磷酸酶 AcP;F. 碱性磷酸酶 ALP;G. β-葡糖苷酶 β-CG;H. 荧光素二乙酸酯(FDA)水解酶 S-FDA;不同小写字母表示处理间差异显著(P <0.05),下同。
2.2 土壤微生物群落结构特征
2.2.1 土壤微生物群落α多样性 天麻根际土壤细菌与真菌的多样性指数如表1所示。Shannon指数和Simpson指数、Chao1指数和ACE指数分别是衡量微生物多样性和丰富度的重要参数。Shannon指数和Simpson指数越高,物种多样性越高;ACE指数和Chao1指数越大,物种丰富度越高[22]。天麻根际土壤微生物群落的覆盖率(Goods_coverage)为98.92%~99.90%,表明测序结果已覆盖测试样品中的绝大部分物种,能够真实有效地反映各处理下天麻根际土壤微生物群落的多样性,具有研究意义和实用价值。由表1可知,NT处理下的细菌Shannon指数大于CK处理,表明NT处理会提升天麻根际土壤细菌群落物种多样性。4种处理下土壤细菌的Chao1指数和ACE指数无显著性差异,表明在4种处理下天麻根际土壤细菌群落丰度相近,但从平均值来看,NT处理下的土壤细菌群落丰度高于其他3种处理,HSS处理下土壤细菌群落丰度最低。HSS处理的土壤真菌Shannon、Chao1、ACE指数均显著高于CK处理,分别是CK处理的1.33、2.37、2.34倍,表明HSS处理下土壤真菌的物种总数、菌群丰富度及复杂程度更高。
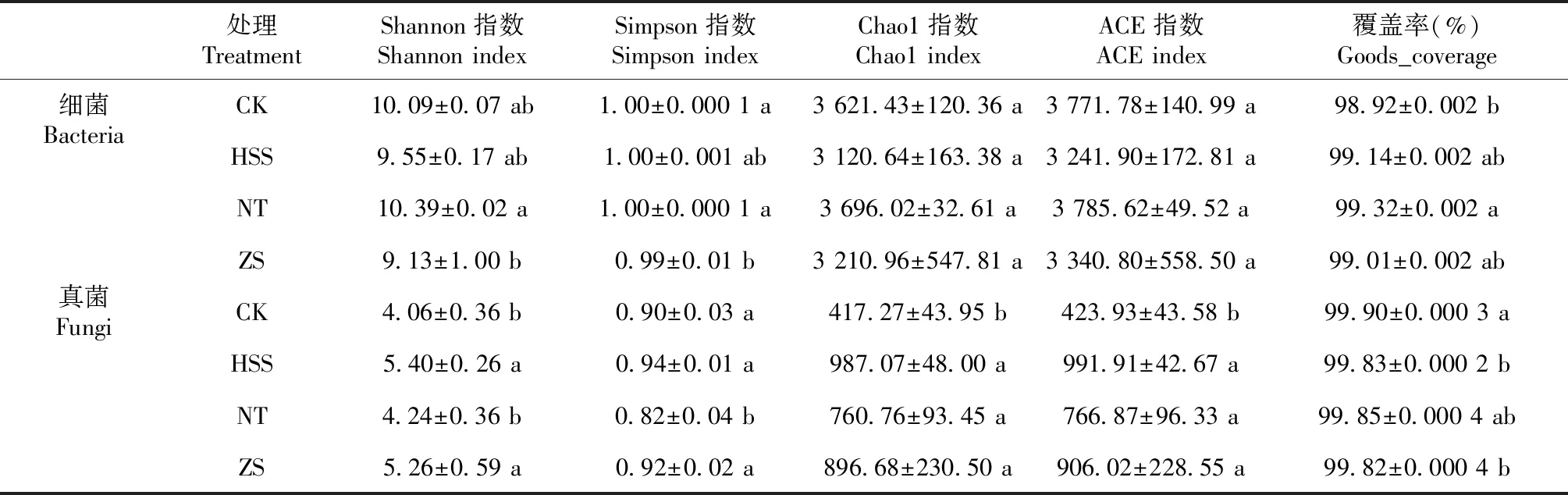
表1 根际土壤中细菌和真菌群落Alpha多样性指数
2.2.2 OTU聚类分析 为研究各样本的物种组成,对所有样本的Effective Tags以97%的一致性进行OTUs(Operational taxonomic units)聚类,然后对OTUs的序列进行物种注释,每个分类单元即为一个OTU。由表2可知,在CK、HSS、NT、ZS处理中分别获得6030、5202、5982、5630个细菌OTU,以及785、1778、1365、1612个真菌OTU。
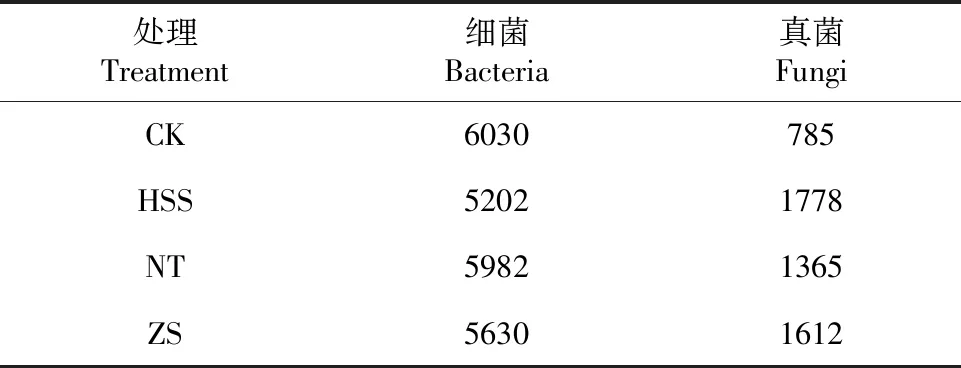
表2 土壤样本测序获得的细菌、真菌OTU序列读数
Venn图能够反映组间或样品之间共有和特有OTU数目,能直观地表现出组间或样品间OTU的重叠情况[23]。由图2-A可知,在细菌中,CK、HSS、NT和ZS处理共产生8942个OTU,共有的OTU数为3148个,占总数的35.20%;各处理所包含OTU个数排序为CK>NT>ZS>HSS,说明CK的土壤细菌类群最丰富,NT处理次之。由图2-B可知,在真菌中,CK、HSS、NT和ZS处理共产生2974个OTU,共有的OTU数为296个,占总数的9.95%;各处理所包含OTU个数排序为HSS>ZS>NT>CK,表明加入不同外源基质处理的天麻根际土壤真菌OTU数目显著高于原土处理,其中以HSS处理效果最佳,是CK处理的2.26倍。
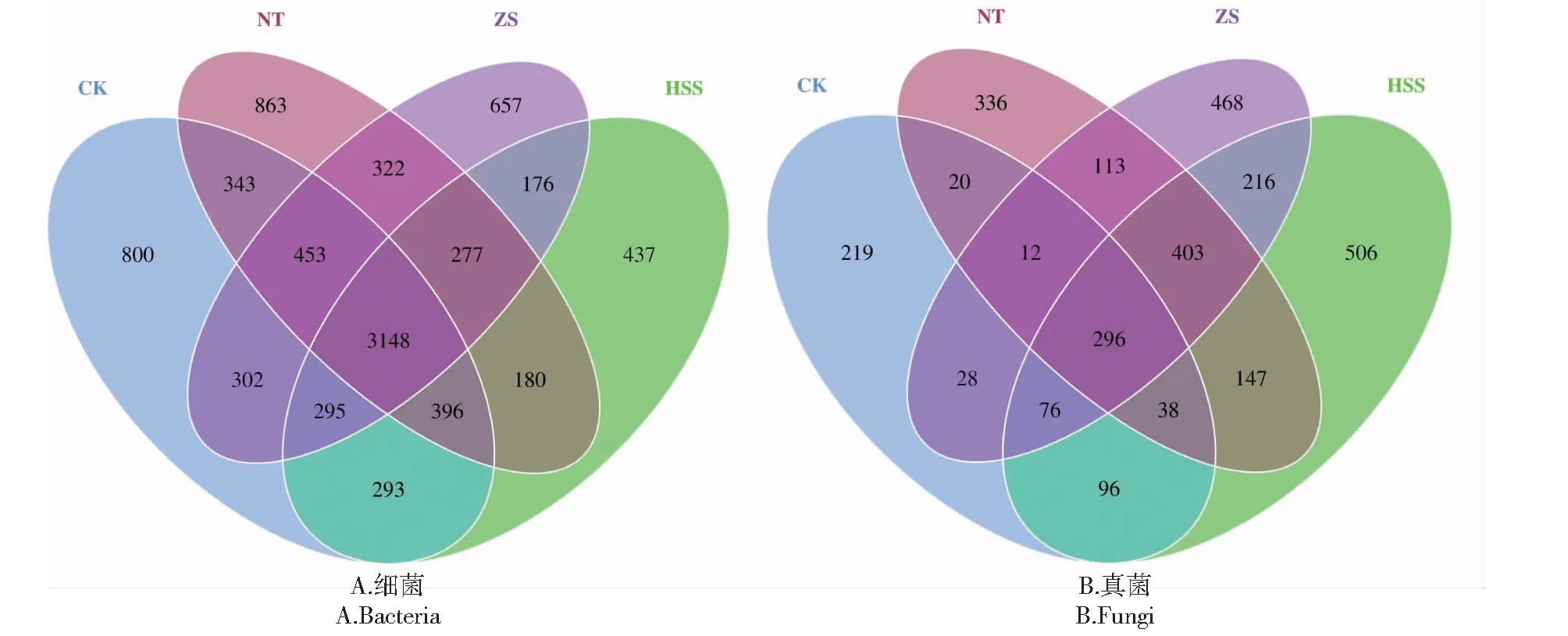
图2 不同处理下天麻根际土壤细菌、真菌的Venn图
2.2.3 物种丰度分析 丰度分布曲线(Rank abundance)能直观地显现各样本中OTUs的均匀度和丰富度,水平方向上曲线宽度反映了物种的丰富度,物种的丰富度越高,曲线在横轴上的跨度越大;曲线平滑程度反映了样本中物种的均匀度,曲线越平缓,物种分布越均匀[24]。由图3-A可知,水平方向上NT处理的曲线宽度最大,故在此处理下的土壤细菌丰富度最高,而HSS处理下的细菌丰富度最低;从垂直方向上看,各处理的丰度分布曲线跨度相当,可近似认为不同处理下天麻根际土壤细菌的均匀度基本一致。由图3-B可知,在水平方向上HSS处理下土壤真菌丰富度最高,CK处理的真菌丰富度最小;从垂直方向上看,HSS、NT、ZS处理的曲线平滑度均稍大于CK处理,表明使用不同外源基质可提升天麻根际土壤真菌群落多样性及均匀度。
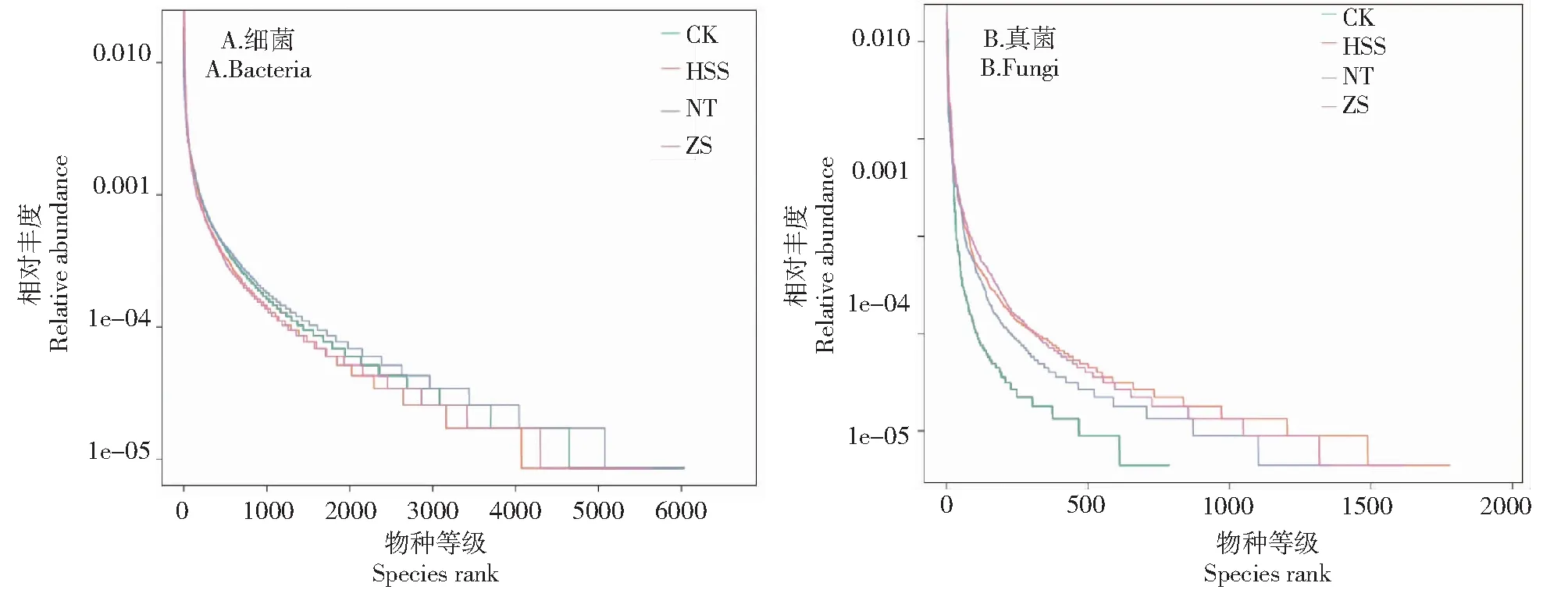
图3 不同处理下天麻根际土壤细菌、真菌的丰度分布曲线
2.2.4 土壤微生物群落结构组成 由图4-A可知,在不同外源基质处理下天麻根际土壤细菌群落门水平排名前10的菌群,其相对丰度从大到小分别为:变形菌门(Proteobacteria,15.61%~23.21%)、未确定分类地位的细菌门(unidentified_Bacteria,13.45%~21.49%)、酸杆菌门(Acidobacteriota,10.17%~24.39%)、拟杆菌门(Bacteroidota,1.18%~20.51%)、厚壁菌门(Firmicutes,1.46%~13.47%)、疣微菌门(Verrucomicrobiota,3.03%~5.34%)、粘球菌门(Myxococcota,1.91%~3.00%)、绿弯菌门(Chloroflexi,1.40%~2.59%)、RCP2-54(1.10%~2.08%)、弯杆菌门(Campylobacterota,0.02%~3.40%)。除去未确定分类地位的细菌门,变形菌门、酸杆菌门、拟杆菌门和厚壁菌门的相对丰度最高,占细菌群落组成的44.68%~59.76%,属于优势细菌。与CK相比,HSS、NT、ZS处理均使天麻根际土壤中拟杆菌门和厚壁菌门的相对丰度提高,但也在一定程度上降低了变形菌门的相对丰度,以ZS处理影响最为显著。HSS处理下的酸杆菌门相对丰度明显高于其他处理,ZS处理下的变形菌门和酸杆菌门的相对丰度最低。

图4 不同处理对土壤细菌和真菌主要群落组成的影响
由图4-B可知,在不同外源基质处理下天麻根际土壤真菌群落门水平排名前10的菌群,其相对丰度从大到小分别为:担子菌门(Basidiomycota,19.46%~58.77%)、子囊菌门(Ascomycota,33.44%~46.83%)、被孢霉门(Mortierellomycota,0.41%~16.57%)、罗兹菌门(Rozellomycota,0.60%~7.77%)、球囊菌门(Glomeromycota,0.02%~0.88%)、壶菌门(Chytridiomycota,0.05%~0.64%)、毛霉菌门(Mucoromycota,0.02%~0.72%)、捕虫霉门(Zoopagomycota,0.005%~0.04%)、蛙粪霉门(Basidiobolomycota,0%~0.03%)和Calcarisporiellomycota(0.001%~0.02%)。不同外源基质处理下土壤优势真菌群落均为子囊菌门、担子菌门、被孢霉门和罗兹菌门,占到真菌群落组成的90%左右。与CK处理相比,HSS、NT、ZS处理均使天麻根际土壤担子菌门的相对丰度降低,但提高了被孢霉门的相对丰度;NT处理下罗兹菌门和子囊菌门相对丰度降低;HSS和ZS处理下子囊菌门、罗兹菌门相对丰度显著增加。
2.2.5 土壤微生物群落β多样性分析 基于Weighted Unifrac距离对样品进行了主坐标分析(PCoA,Principal Co-ordinates Analysis)。由图5-A可知,主坐标分析结果显示PC1和PC2分别解释变量方差的83.36%和7.81%,两者累积贡献率达91.17%,具有统计学意义。PC1将ZS中的细菌群落明显与HSS、NT、CK区分开,PC2将HSS、ZS中的细菌群落与CK、NT区分开。可以看出,NT和CK处理下的土壤细菌群落组成聚集在同一个象限,表明两组细菌群落之间进化距离最近。由图5-B可知,主坐标分析结果显示PC1和PC2分别解释变量方差的30.69%和26.11%,两者累积贡献率达56.80%。其中PC1将HSS、ZS处理下的真菌群落明显与NT、CK区分开,PC2将NT、HSS中的真菌群落明显与ZS、CK区分开。每个处理的3个重复样品点均聚类于同一象限,说明样本的重复性较好,组内变异相对较小;而不同样品点分布在不同象限,表明不同处理下土壤真菌群落结构存在差异。
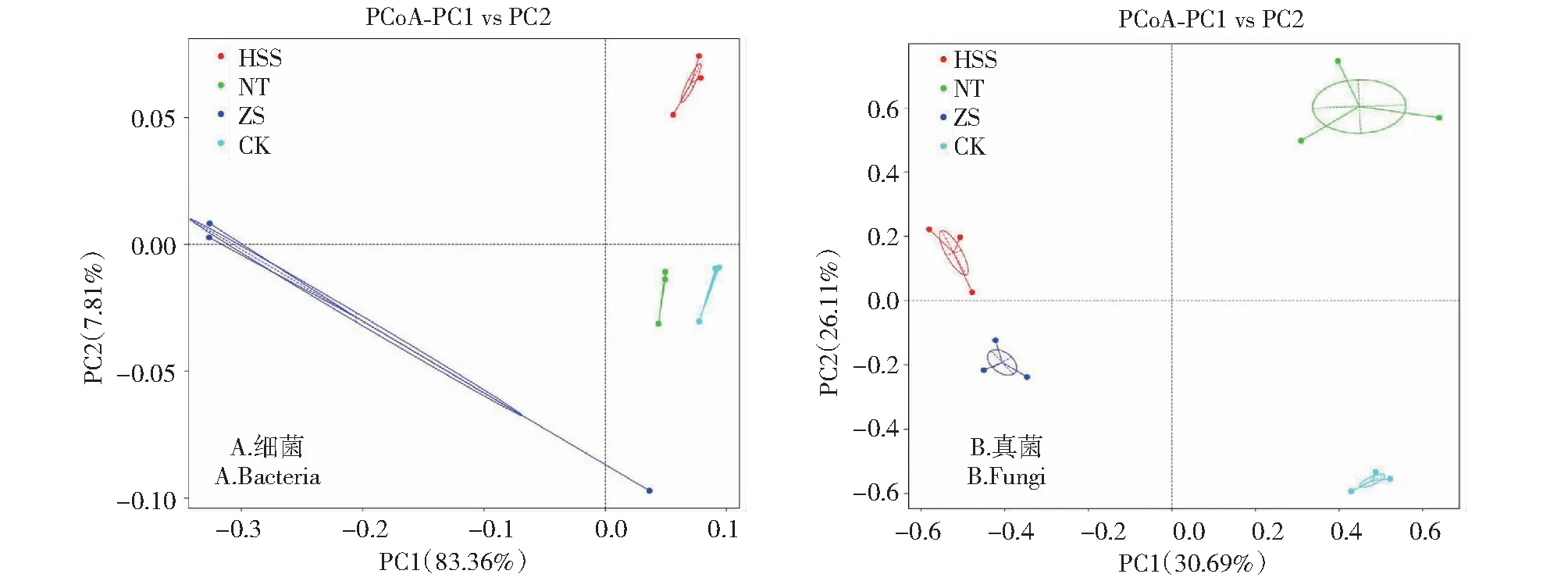
图5 不同处理下土壤细菌和真菌的PCoA主坐标分析
2.3 土壤微生物群落结构与环境因子的响应关系
2.3.1 根际土壤微生物群落与酶活性的Mantel_test分析 由表3可知,土壤蔗糖酶、纤维素酶、过氧化氢酶、脲酶、酸性磷酸酶、碱性磷酸酶、β-葡糖苷酶、FDA水解酶活性与不同外源基质处理下乌红天麻根际土壤细菌、真菌群落结构的相关性对比中,r值均大于0,呈正相关。对于细菌群落,除蔗糖酶和过氧化氢酶之外,其余6种土壤酶的P值均大于0.05,表明土壤蔗糖酶和过氧化氢酶对细菌群落结构影响最大;土壤纤维素酶、脲酶、酸性磷酸酶和碱性磷酸酶活性均与真菌群落结构呈显著正相关,且酸性磷酸酶活性对真菌群落结构具有最显著的影响。

表3 土壤微生物群落结构与酶活性之间的Mantel_test检验分析结果
2.3.2 根际土壤微生物群落与土壤酶活性的相关关系 为进一步分析属水平上细菌、真菌菌群与环境因子的关系,选取不同外源基质处理下天麻根际土壤中相对丰度前15的细菌物种将其聚类,进行Spearman相关性分析,根据显著性制出热图。由图6-A可知,土壤纤维素酶、脲酶、酸性磷酸酶均与罗氏菌属(Roseburia)、乳杆菌属(Lactobacillus)呈极显著正相关,与伯克霍尔德氏菌属(Burkholderia-Caballeronia-Paraburkholderia)呈极显著负相关;纤维素酶、脲酶活性均与拟普雷沃菌属(Alloprevotella)呈极显著正相关,与ADurb.Bin063.1、藓杆菌属(Bryobacter)、酸杆菌属(Acidibacter)呈显著负相关;脲酶、酸性磷酸酶活性均与柠檬乳杆菌属(Limosilactobacillus)、Lachnospiraceae_NK4A136_group呈显著正相关;酸性磷酸酶、碱性磷酸酶活性均与念珠菌固体杆菌属(Candidatus_Solibacter)呈显著负相关;纤维素酶活性与柠檬乳杆菌属、Lachnospiraceae_NK4A136_group、螺杆菌属(Helicobacter)呈极显著正相关,与mle1.7、念珠菌固体杆菌属呈显著负相关;过氧化氢酶活性与ADurb.Bin063.1呈显著负相关;脲酶活性与拟杆菌属(Bacteroides)、螺杆菌属呈显著正相关,与念珠菌固体杆菌属呈极显著负相关;酸性磷酸酶活性与螺杆菌属呈极显著正相关,与拟普雷沃菌属呈显著正相关;碱性磷酸酶活性与罗氏菌属、乳杆菌属呈显著正相关,与伯克霍尔德氏菌属、藓杆菌属呈显著负相关;蔗糖酶、β-葡糖苷酶、FDA水解酶与菌属相关性不显著。

纵向为环境因子信息,横向为物种信息;*、**表示变量间分别在P<0.05和P<0.01水平上显著相关。图例中红色表示正向相关,蓝色表示负向相关,颜色越深表示其正(负)相关性越大。
由图6-B可知,土壤纤维素酶、脲酶、酸性磷酸酶、碱性磷酸酶活性均与f_Thelephoraceae.g_unidentified、丝盖伞属(Inocybe)呈极显著负相关;脲酶、酸性磷酸酶、碱性磷酸酶活性均与布氏白粉菌属(Blumeria)呈显著负相关;纤维素酶、酸性磷酸酶、碱性磷酸酶活性均与蜡蘑属(Laccaria)呈显著负相关;纤维素酶、碱性磷酸酶活性均与unidentified_Sordariomycetes_sp呈显著正相关;红菇属(Russula)与纤维素酶、酸性磷酸酶活性呈极显著负相关,与脲酶、碱性磷酸酶活性呈显著负相关;蔗糖酶活性与f_Sebacinaceae.g_unidentified呈极显著负相关;纤维素酶活性与被孢霉属(Mortierella)呈显著正相关,与布氏白粉菌属呈极显著负相关;过氧化氢酶活性与unidentified呈显著正相关,与f_Sebacinaceae.g_unidentified、unidentified_Auriculariales_sp呈显著负相关;脲酶活性与被孢霉属呈极显著正相关,与蜡蘑属呈极显著负相关;酸性磷酸酶活性与unidentified_Sordariomycetes_sp、棉革菌属(Tomentella)呈极显著正相关;碱性磷酸酶活性与棉革菌属呈显著正相关;β-葡糖苷酶活性与unidentified_Rozellomycota_sp呈显著正相关;FDA水解酶活性与木霉属(Trichoderma)呈极显著正相关,与古根菌属(Archaeorhizomyces)呈显著负相关。
3 讨 论
目前传统的仿野生栽培天麻所用基质都是重新回填挖掘栽培床时移开的土壤,缺乏人工组配基质的成分和质地对天麻品质及根际土壤微生态影响的研究报道[25]。外源基质适宜的物理化学性质是保障根系健康生长的基础,影响作物对基质适宜性的指标主要有容重、通气孔隙度、粒径、pH、EC值等[26]。陈双臣等[27]研究表明,以大粪干+玉米秸秆+锯沫/菇渣(1∶2∶1)的配方栽培番茄时,显著提高了种植土壤中的脲酶、纤维素酶和磷酸酶活性。阮梦雅等[28]在甜樱桃幼树限根栽培研究中发现原土添加蘑菇渣(园土、蘑菇渣、有机肥体积比为50∶49∶1)显著提高了土壤中脲酶和碱性磷酸酶的活性。程立巧等[29]研究表明,育苗基质(草炭、炉渣、蛭石体积比为1∶1∶1)的根际土壤微生物数量和酶活性水平较高,能够为番茄幼苗生长提供良好的生长环境。本研究中土壤酶活性结果表明,3种外源基质处理下的天麻根际土壤酶活性均显著高于CK处理,总体来说ZS处理下的天麻根际土壤酶活性较CK提高最为显著,表明添加外源基质均能显著改善土壤的酶活性,这与前人的研究结论一致[30-31]。目前关于根际土壤中各项理化指标、酶活性及植物体内养分的传送和转导、植物生理生化状况的作用机理还不明确,有待进一步研究。
根际土壤微生物能够将腐殖质等有机质进行分解及降解,可改善药用植物的根际土壤物理化学特性,促进药用植物根系对营养物质的吸收,控制药用植物根际土传染病等,进而提高了药用植物的品质[32]。本研究发现,NT处理增加了乌红天麻根际土壤细菌群落丰度及多样性,而ZS处理显著抑制土壤中细菌的生长,引起细菌多样性显著降低,但3种外源基质处理下的土壤细菌丰度较CK无显著性差异。PCoA图也可以看出3种外源基质处理对细菌群落结构的影响有相同之处也有不同之处,HSS、NT、CK土壤样点分布较为集中,但ZS土壤样点较为分散,表明ZS处理下乌红天麻根际土壤细菌群落发生较大变化,推测可能是由于蛭石的加入改善了天麻根际土壤的基本理化性质,为现有微生物提供了良好的生存环境,导致细菌群落结构发生了显著变化[33]。Luo等[34]研究发现天麻根际土壤主要细菌门为变形菌门、放线菌门和酸杆菌门,主要真菌门为担子菌门和子囊菌门。本研究土壤细菌群落组成(门水平)分析显示,优势细菌门分别为变形菌门、酸杆菌门、拟杆菌门和厚壁菌门。3种外源基质处理均显著提升了拟杆菌门、厚壁菌门的相对丰度,推测是受到外源基质自身结构的影响,可为水分子提供良好的通道,从而提升土壤中的含水量,促进植物与土壤的养分循环,使植物生物量和土壤养分增加[35]。拟杆菌门属于富营养型细菌,它们在营养状况良好采样位置的细菌群落中占优势[36];厚壁菌门有极强的环境适应性,具有降解土壤中难溶化合物、降解原油、固定空气中氮、防治植物病虫害等作用,其能在营养丰富的环境下快速增长,是一类极其重要的土壤益生菌[37]。变形菌门是公认的共营养型菌门,它更喜欢有效碳含量高的环境[38],其相对丰度与养分含量呈正相关,但本研究中3种外源基质处理均降低了土壤变形菌门的相对丰度,推测是由于土壤中养分的提升为其他土壤微生物提供了充足的养分,加速了与固氮微生物间的竞争[39]。
本研究发现,HSS处理显著提升了真菌总体丰富度及物种数量,提高了真菌物种的多样性。这可能是由于火山石具有孔隙多、质地较轻、保温隔热且无污染等特点,改善了土壤通气性及保水性,其与原土混合配施还可间接改变土壤pH,有利于真菌生长繁殖和多样性的提升。由PCoA图可以看出,3种外源基质处理对真菌微生物群落结构影响差异明显,以NT处理最为显著,其原因可能是外源基质覆土处理为一些菌群提供了特定的养料,对代谢产生了促进作用[40]。本研究土壤真菌群落组成(门水平)分析显示,优势真菌门为担子菌门、子囊菌门、被孢霉门和罗兹菌门,且3种外源基质处理均显著提升了被孢霉门的相对丰度。被孢霉门是土壤养分含量丰富标志类群,与土壤养分有密切联系[41]。不同外源基质处理下土壤中担子菌门的相对丰度与CK相比显著降低,担子菌门既包括可分解木质纤维素的真菌,也包括一些有害真菌,使作物发生病害[42],表明不同外源基质覆土处理可在一定程度上减少天麻病害的发生。
由此可见,天麻根际土壤微生物各门类细菌和真菌丰度均存在差异,其结构也发生了显著变化。本研究还发现乌红天麻根际土壤细菌和真菌中还有很多未分类或未确定种属的物种,同样也受到不同外源基质的影响,但其功能和特点尚不清楚,还有待通过深度测序或利用其他先进手段对微生物进行更细致的分类研究,并结合土壤的相关指标进行深入探索。
酶是土壤组分中最为活跃的有机成分之一,土壤酶活性增强亦表征土壤生物活性提高,增强植株抗性[43]。土壤酶活性对环境因子的变化反应灵敏,根际酶活性不仅受根际分泌物质的影响,还受到微生物活动的影响[44]。根据Mantel_test检验和Spearman相关性热图分析结果可知,与酶活性相关的真菌属个数大于细菌属个数,表明天麻根际土壤酶活性与真菌相关性更强;土壤蔗糖酶和过氧化氢酶对细菌群落结构影响最大,酸性磷酸酶活性对真菌群落结构具有最显著的影响。乌红天麻在生活史周期中向土壤环境中释放代谢产物,代谢产物影响其根际土壤中的微生物群落,微生物群落的变化会导致土壤酶活性的变化,并反作用于天麻,影响天麻的生长。
4 结 论
相较于常规覆土栽培,添加外源基质覆盖处理主要通过调节天麻根际土壤中的蔗糖酶、过氧化氢酶和酸性磷酸酶的活性进而影响根际微生物种群多样性、丰富度及其生理生态功能,其中NT处理(泥炭+原土,体积比1∶1混合)效果最好,为乌红天麻的引种栽培提供了科学依据,可在生产中推广使用。
