小麦不同营养型病原真菌的候选GPCR蛋白预测及对比研究
2023-07-05夏雄飞张凯强任文来韩长志
夏雄飞,张凯强,任文来,韩长志,3
(1.西南林业大学生物多样性保护学院,昆明 650224;2.文安县农业农村局,河北 文安 065800;3.云南省森林灾害预警与控制重点实验室,昆明 650224)
【研究意义】近年来,小麦病害的发生给中国农业生产带来了巨大的经济损失,严重制约着中国小麦产业的健康稳定发展,威胁着国家粮食安全[1]。其中,白粉病菌(Blumeriagraminisf.sp.tritici)、叶枯病菌(Zymoseptoriatritici)、叶斑病菌(Parastagonosporanodorum)分别是引起小麦白粉病、叶枯病、叶斑病的病原真菌,其营养型分别为活体[2]、半活体[3]及死体营养型[4]。G蛋白偶联受体(G-protein coupled receptors, GPCR)蛋白广泛存在于植物病原真菌中,在感知和传递外界信号方面发挥着重要功能。不同营养型病原真菌GPCR蛋白的数量及理化性质、遗传关系等方面是否存在着同质性或差异性,对于进一步开发不同作用靶标的新型农药具有重要的指导意义。【前人研究进展】GPCR蛋白广泛存在于真核生物中,其主要功能在于接收信号源物质,并将信号源物质在受体中进一步“翻译”后传递至下游信号链[5],具有典型的7重跨膜螺旋结构域[6],在植物病原真菌等生物的细胞增殖、分化、凋亡等生理生化反应中发挥重要作用[7],进而影响真菌的生长、分生孢子形成以及对植物的免疫应答等。前人多以单个小麦病原菌为对象开展次生代谢产物、效应子、分泌蛋白等致病因子以及遗传关系的研究,如小麦叶斑病菌产生的聚酮化合物、非核糖体肽等次级代谢产物以及效应子在发病过程中的作用分析[8-9],小麦白粉病菌候选互作蛋白筛选[10]、遗传多样性分析[11],以及小麦叶枯病菌与小麦互作过程中的分泌蛋白情况分析[12]等。喻红利等[13]前期通过TOPCONS、TMHMM、Philius等方法对禾谷炭疽菌的候选GPCR蛋白进行预测,明确该菌220个候选GPCR蛋白的理化性质及遗传关系[14],该研究方法与前人利用酿酒酵母(Saccharomycescerevisiae)进行异源GPCR蛋白检测分析相比[15],较好地实现了全部候选GPCR蛋白的高效预测。此外,祝友朋等[13]还对不同营养型植物病原真菌次生代谢产物合成基因簇进行了差异性研究。然而,关于小麦不同营养型病原真菌候选GPCR蛋白的生物信息比对分析尚未见报道。【本研究切入点】以小麦不同营养型病原真菌的蛋白序列为研究对象,利用3种不同的蛋白跨膜预测方法(TOPCONS、TMHMM、Philius)分析其含有的跨膜情况,通过筛选具有7重跨膜结构的蛋白,并结合SMART保守结构域分析其结构特征。同时,对所获得的候选GPCR蛋白开展氨基酸序列长度、理论等电点、不稳定系数、最强亲(疏)水性氨基酸残基情况、遗传关系等分析。【拟解决的关键问题】基于生物信息分析的方法,明确小麦不同营养型病原真菌的候选GPCR蛋白理化性质差异性以及遗传关系同质性特征,对于不同营养型病原真菌的候选GPCR蛋白受体-配体相互作用解析以及开发不同作用靶标的新型农药具有重要的指导意义。
1 材料与方法
1.1 数据来源
小麦白粉病菌(登录号:GCA_900519115.1)、叶枯病菌(登录号:GCF_000219625.1)、叶斑病菌(登录号:GCF_000146915.1)的蛋白序列来源于NCBI数据库 (https://www.ncbi.nlm.nih.gov/)。
1.2 试验方法
1.2.1 找寻候选GPCR蛋白 基于多种在线预测软件,首先,通过 TOPCONS (http://topcons.cbr.su.se/pred/)、TMHMM 2.0 (https://services.healthtech.dtu.dk/service.s/TMHMM-2.0/)以及Philius (http://www.yeastrc.org/philius/pages/philius/runPhilius.jsp)[13]分析小麦病原真菌全部蛋白的跨膜结构的情况;其次,通过 SignalP 5.0 (https://services.healthtech.dtu.dk/services/SignalP-5.0/)[17]分析信号肽;再次,通过SMART (http://smart.embl-heidelberg.de)[18]预测保守结构域,剔除包含已证实功能的保守结构蛋白,保留不含任何已证实功能的蛋白(图1),最终获取3种病原真菌的候选GPCR蛋白。

A:典型候选GPCR蛋白;B:其他蛋白。
1.2.2 氨基酸理化性质情况分析 基于2种在线预测软件,首先通过 Protparam(https://web.expasy.org/protparam/)进行理论等电点和不稳定系数分析;其后,通过 Protscale(https://web.expasy.org/protscale/)预测最强亲(疏)水性氨基酸情况[14]。
1.2.3 候选GPCR的遗传关系分析 通过软件MEGA 11.0进行多重比对分析并建立遗传系统进化树[19]。
1.3 数据统计
数据统计采用软件Microsoft office 2019,图表制作采用软件Origin 2018、Adobe Photoshop 2019。
2 结果与分析
2.1 候选GPCR蛋白预测
基于TOPCONS、TMHMM、Philius 3种程序预测不同小麦病原真菌全部蛋白的跨膜情况,从表1可知,符合7重跨膜结构特性且不包含信号肽的蛋白数量的小麦白粉病菌为40~54个,平均为46个,占比为0.49%~0.65%;小麦叶枯病菌为82~97个,平均为90个,占比为0.75%~0.89%;小麦叶斑病菌为107~146个,平均为124个,占比为0.67%~0.91%。进一步通过SignalP 5.0对信号肽情况进行分析,明确小麦白粉病菌、叶枯病菌、叶斑病菌具有8重跨膜结构且包含信号肽的蛋白数量分别为2、3、10个。同时,利用SMART预测保守结构域,明确小麦白粉病菌、叶枯病菌、叶斑病菌具有候选GPCR蛋白数量分别为11、32、69个。小麦叶斑病菌的候选GPCR蛋白数量明显高于其余2种病菌。

表1 3种小麦病原真菌的候选GPCR蛋白预测结果
2.2 氨基酸序列长度分析
通过对小麦白粉病菌、叶枯病菌、叶斑病菌的候选GPCR蛋白氨基酸长度进行分析(图2)。候选GPCR蛋白氨基酸序列长度分别为215~652、244~1028、236~563 aa,平均序列长度分别为407、399、383 aa。因此,小麦3种病原菌候选GPCR蛋白的氨基酸序列平均长度相近。

图2 3种小麦病原真菌候选GPCR的序列长度比对
2.3 理论等电点与不稳定系数分析
基于Protparam在线分析候选GPCR蛋白理论等电点与不稳定系数。从图3可见,小麦白粉病菌、叶枯病菌、叶斑病菌候选GPCR蛋白的理论等电点分别为5.43~9.84、5.75~10.24、5.67~10.42,平均值分别为8.77、8.79、8.79。3种病菌各含有酸性蛋白质(理论等电点小于6.01)1、1、2个,占比分别为9.09%、3.13%、2.90%;碱性蛋白质(理论等电点大于8.00)9、27、57个,占比分别为81.89%、84.38%、82.61%。
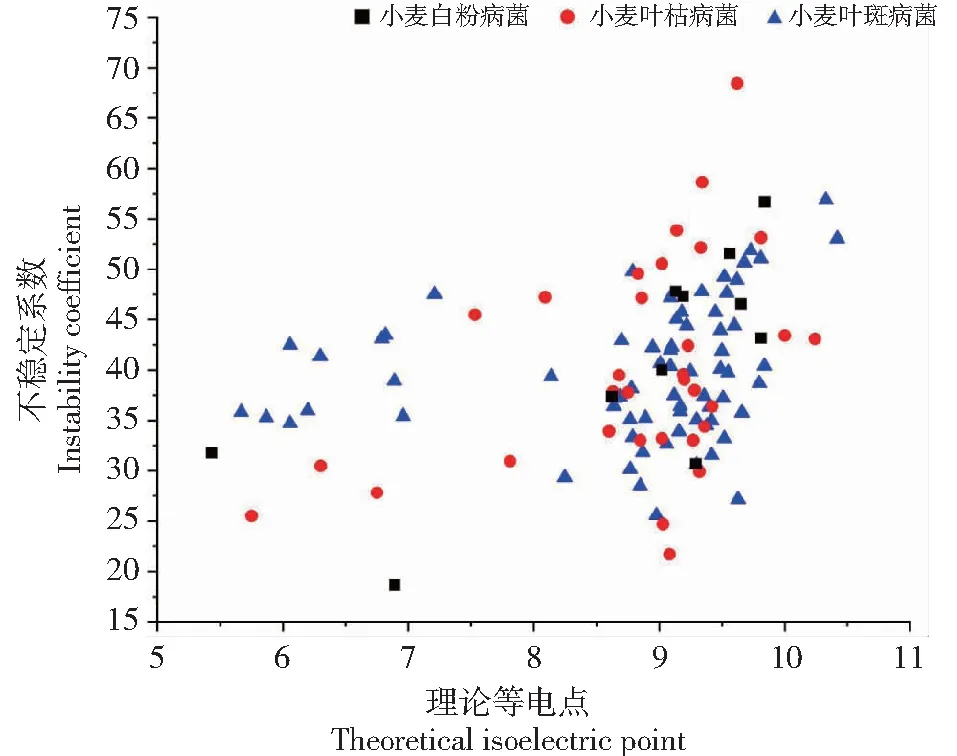
图3 3种小麦病原真菌候选GPCR氨基酸残基的理论等电点与不稳定系数的关系
同时,小麦白粉病菌、叶枯病菌、叶斑病菌候选GPCR蛋白的不稳定系数分别为18.68~56.69、21.71~68.43、25.47~56.80,平均值分别为41.07、40.05、39.59。3种病菌各含有不稳定性蛋白(不稳定系数高于40.01)7、13、31个,占比分别为36.36%、59.38%、55.07%,稳定性蛋白(不稳定系数低于40.01)4、19、38个,占比分别为63.64%、40.62%、44.93%。结果表明,小麦白粉病菌具有较多的酸性且稳定蛋白,叶枯病菌具有较多的碱性且不稳定蛋白。
2.4 最强亲(疏)水性氨基酸残基分布
基于Protscale在线分析候选GPCR蛋白最强亲(疏)水性氨基酸残基。从图4可见,候选GPCR蛋白的最强亲水性(亲水性值小于0)氨基酸残基小麦白粉病菌有9种,含量最高的为天冬氨酸和精氨酸,占比18.18%,其中异亮氨酸为其独有;小麦叶枯病菌有12种,含量最高的为谷氨酸,占比21.62%;小麦叶斑病菌有16种,含量最高的为精氨酸,占比22.67%,且独有缬氨酸、色氨酸、络氨酸、苯丙氨酸。
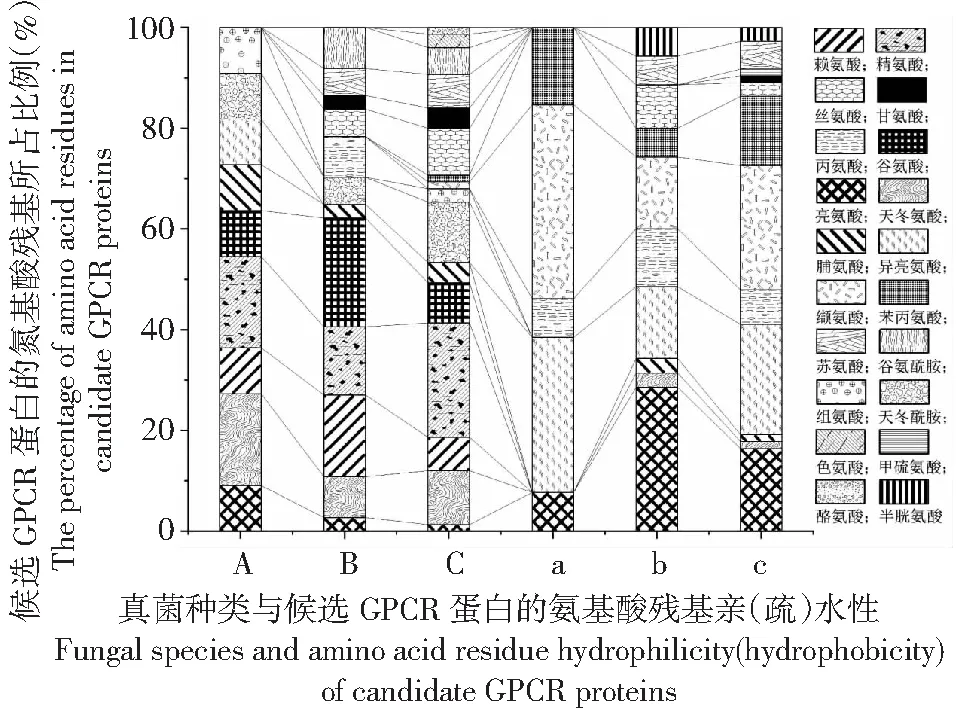
A、B、C分别表示小麦白粉病菌、叶枯病菌、叶斑病菌候选GPCR蛋白的氨基酸亲水性残基;a、b、c分别表示小麦白粉病菌、叶枯病菌、叶斑病菌候选GPCR蛋白的氨基酸疏水性残基。
同时,候选GPCR蛋白的最强疏水性(亲水性值大于0)氨基酸残基小麦白粉病菌有5种,含量最高的为缬氨酸,占比38.46%;小麦叶枯病菌有10种,含量最高的为亮氨酸,占比28.57%;小麦叶斑病菌有12种,含量最高的为缬氨酸,占比24.66%,且独有甲硫氨酸和甘氨酸。
2.5 亲(疏)水性最值分析
基于Protscale在线分析候选GPCR蛋白的氨基酸亲(疏)水性最值。从图5可知,小麦白粉病菌、叶枯病菌、叶斑病菌的候选GPCR蛋白氨基酸残基亲水性最值(小于0)分别为-0.722~-3.778、-1.478~-3.756、-1.544~-3.633,平均值分别为-2.680、-2.750、-2.730。
同时,小麦白粉病菌、叶枯病菌、叶斑病菌候选GPCR蛋白氨基酸残基疏水性最值(大于0)分别为2.889~4.500、2.456~3.722、2.144~3.978,平均值分别为3.330、3.090、3.200。
2.6 遗传关系分析
通过对小麦3种营养型病原真菌的112个候选GPCR蛋白序列进行遗传关系分析。从图6可知,3种病原真菌的候选GPCR蛋白明显分为三大类,分别采用A、B、C进行区分。其中,在A类中共涉及71个候选GPCR蛋白,为最大的一类,包含小麦白粉病菌、叶枯病菌、叶斑病菌的候选GPCR蛋白数量分别为6、19、46个;B类中则有36个候选GPCR蛋白,包含小麦白粉病菌、叶枯病菌、叶斑病菌的候选GPCR蛋白数量分别为3、12、21个;C类中则仅有数量较少的候选GPCR蛋白。就其功能而言,仅发现5个候选GPCR为假定蛋白(Hypothetical protein)。
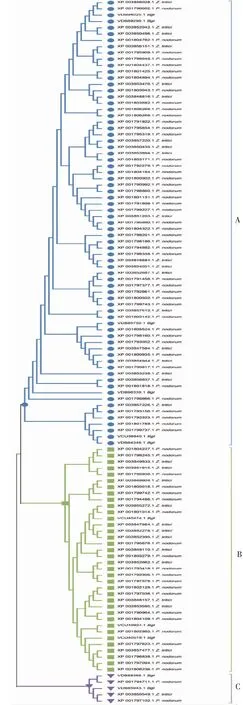
A、B、C分别表示3个遗传分支。
3 讨 论
GPCR蛋白作为生物细胞中重要的信号传递受体,对维持生命的正常运转发挥着重要作用,当前在医疗健康方面所应用的药剂中有超过50%以该蛋白为作用靶标[20],未来以植物病原真菌的GPCR蛋白为靶标进行化学防控具有可行性。前人研究发现,致病疫霉(Phytophthorainfestans)的GPCR蛋白相关亚基Gγ参与孢子囊的发育和游动,其氨基酸序列与非卵菌Gγ亚基的整体相似性较低[21],说明不同物种编码GPCR蛋白的氨基酸序列存在差异性,该发现与本研究中3种小麦病原真菌的候选GPCR蛋白及其理化性质存在一定差异性的分析结果相似。
此外,玉米黑粉菌(Ustilagomaydis)作为活体营养型真菌,在碱性环境条件下侵染宿主时,其GPCR蛋白相关代谢途径表达更加突出[22],而本研究中的小麦白粉病菌候选GPCR碱性蛋白占比较低,是否与pH适应过程有关,有待于今后进一步研究。稻瘟菌(Magnaportheoryzae)作为半活体营养型真菌,其GPCR相关蛋白PLG1可以促使病菌在疏水表面侵染宿主相比亲水表面产生更多附着物[23],同样,小麦叶枯病菌、白粉病菌、叶斑病菌的GPCR蛋白残基亲(疏)水性与病菌侵染识别之间是否存在关联性,有待于进一步明确。灰葡萄孢(Botrytiscinerea)作为死体型真菌,其GPCR相关蛋白bmp1与上述稻瘟菌对于在亲(疏)水表面的侵染表现相反[24],推测其GPCR蛋白氨基酸残基种类的多样性可能与其侵染识别相关。
4 结 论
小麦叶斑病菌的候选GPCR蛋白数量明显高于其余2种病菌,白粉病菌则具有较多的酸性且稳定蛋白,叶枯病菌具有较多的碱性且不稳定蛋白。3种病菌的最强亲(疏)水性氨基酸残基的数量与种类均有较大差异。上述蛋白之间的亲缘关系较近。本研究对不同营养型候选GPCR蛋白受体-配体相互作用解析以及开发不同作用靶标的新型农药奠定理论基础。
