西藏曲拉中优良乳酸菌的筛选与评价
2023-06-30吕嘉伟卢灏泽刘振东王妍凌杨冬莹张海鹏张金萍
吕嘉伟,卢灏泽,刘振东,薛 蓓,王妍凌,杨冬莹,张海鹏,张金萍,黄 翠,薛 洁
(1.西藏农牧学院食品科学学院,西藏林芝 860000;2.中国食品发酵工业研究院有限公司,北京 100015;3.国家酒类品质与安全国际联合研究中心,北京 100015;4.西藏民族大学医学院,陕西咸阳 712082;5.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
西藏曲拉为藏族传统奶酪[1],是以西藏特色畜产品牦牛产生的牦牛乳为原料制备而成,由于其自然发酵的特性,曲拉中存在丰富的微生物资源,但由于缺乏工业化生产的条件,曲拉大部分以家庭手工式生产,生产规模较小、品质控制较难,限制了当地曲拉产业的发展[2]。适当改进生产工艺,在保留其原有风味的基础上,保证曲拉的安全性,使曲拉的外表更美、品质更佳,可在一定程度上加快西藏曲拉的推广。
将鲜乳生产成各类发酵乳制品离不开发酵剂,目前我国乳品企业所用的菌株大多需要进口,我国的益生菌开发应用起步较晚,拥有自主知识产权的菌种较少。传统发酵乳品中含有丰富的微生物资源,其中不乏具有优良性状的菌株,因此自然发酵乳品有一定的开发潜力。朱建宁等[4]从牦牛曲拉中筛选出的耐久肠球菌(E.durans)具有较好的耐受性,在较高的渗透压、较高的胆盐浓度、较低的pH环境下,生长较为良好,有作为益生菌的潜能;梁竟一等[5]从青海地区的乳制品中筛选出1 株瑞士乳杆菌(L.helveticus)有较好的抗幽门螺杆菌功效,可作为功能性乳品开发的专利菌株[5];刘敏等[6]从内蒙古采集的自然发酵乳中筛选出的酵母菌X4 具有优良的耐受性,利用其制作切达奶酪,可显著改善产品的质构特性,对咀嚼性和硬度等均有所提升。
各类乳制品中分离所得的菌种,具有良好性能的菌株可进一步开发利用,以提升品质、丰富产品类型[7]。近年来,许多学者对内蒙古、新疆等地的奶制品进行了较为详尽的研究[9],相对而言,对西藏曲拉的各方面研究较少。本研究对牦牛曲拉中含有的微生物资源进行挖掘,构建牦牛曲拉菌种资源库,筛选具有优良性状、有深入研究价值与开发潜力的菌株,为曲拉品质提升奠定基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌种、样品
菌种:大肠埃希氏菌(E.coli)CICC 20234、金黄色葡萄球菌(S.aureus)CICC 10786,由实验室从菌种保藏中心(CICC)购买。
曲拉样品:采自西藏各地的牧民家中,采样时间为2021 年3 月,所有样品均为自然发酵工艺制成。各样品采集地详情见表1。
1.1.2 试剂与耗材(表2)

表2 药品与试剂
1.1.3 仪器设备(表3)
表3 仪器与设备
1.2 试验方法
1.2.1 微生物的分离培养、鉴定
将所有曲拉样品准确称取10 g,单独分装于无菌采样袋中。酒精灯、接种环、涂布棒、一次性平板培养皿、具塞试管、1.5 mL 离心管。参照凌代文[14]的方法进行微生物的分离培养、鉴定。
1.2.2 乳酸菌发酵能力测定
凝乳时间测定:将乳酸菌活化后,按3 %接种量接种于灭菌后的脱脂乳培养基中,放置于37 ℃恒温培养箱,发酵至牛乳组织黏稠,有明显凝块,记录凝乳的时间。
发酵乳滴定酸度测定:按照GB 5009.239—2016《食品安全国家标准食品酸度的测定》,测定发酵乳的滴定酸度,平行测定3次。
发酵乳后酸度测定:将凝乳后的发酵乳放置于4 ℃,分别于1 d、7 d、14 d 测定其滴定酸度,平行测定3次。
发酵乳持水率测定:将凝乳后的发酵乳放入15 mL 离心管,4000 r/min,离心10 min,弃上清液,按以下公式计算其持水率,平行测定3次。
持水率=(M2-M0)/(M1-M0)×100%
式中:M0——空离心管的质量;
M1——离心前的总质量;
M2——弃去上清液后的总质量。
1.2.3 乳酸菌耐受性测定
菌株耐盐性能测定:将NaCl 加入MRS 液体培养基,调节培养基的盐浓度。液体培养基灭菌后接种菌株,37 ℃恒温培养24 h。在不同时间点取样并测定菌液的吸光值,波长设定为600 nm。平行测定3次。
菌株耐酸性能测定:将HCl 加入MRS 液体培养基,调节培养基的pH。液体培养基灭菌后接种菌株,37 ℃恒温培养24 h。在不同时间点取样并测定菌液的吸光值,波长设定为600 nm。平行测定3次。
菌株耐胆盐性能测定:将牛胆酸钠加入MRS液体培养基,调节培养基的胆盐浓度。液体培养基灭菌后接种菌株,37 ℃恒温培养24 h。在不同时间点取样并测定菌液的吸光值,波长设定为600 nm。平行测定3次。
菌株耐温度性能测定:将乳酸菌充分活化后,接种于MRS 液体培养基,分别放置于15 ℃、37 ℃、45 ℃的恒温培养箱,恒温培养24 h。在不同时间点取样并测定菌液的吸光值,波长设定为600 nm。平行测定3次。
1.2.4 乳酸菌抑菌能力测定
将大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)活化后,按1 %的接种量接种于LB 固体培养基,充分摇匀后将添加菌液的LB 培养基倒入灭菌后的平板,平板凝固后,用无菌镊子放置牛津杯,向牛津杯中加入100 µL 活化好的乳酸菌液,37 ℃恒温培养48 h。观察平板上是否产生抑菌圈,有抑菌圈的测定其直径长度。
2 结果与分析
2.1 细菌鉴定结果与系统发育分析
经过分离纯化后,共得到42 株乳酸菌,部分菌株的PCR 扩增产物电泳图、平板照片如图1、图2所示。
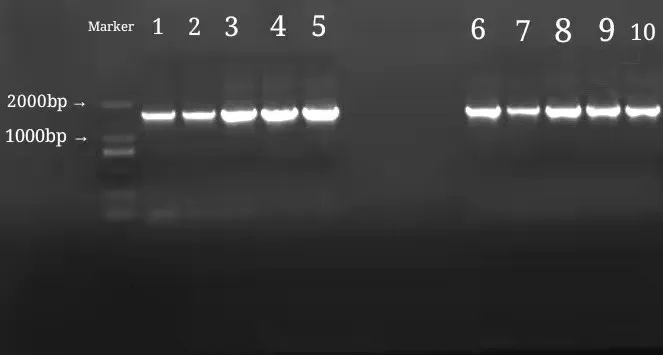
图1 乳酸菌PCR产物凝胶电泳图
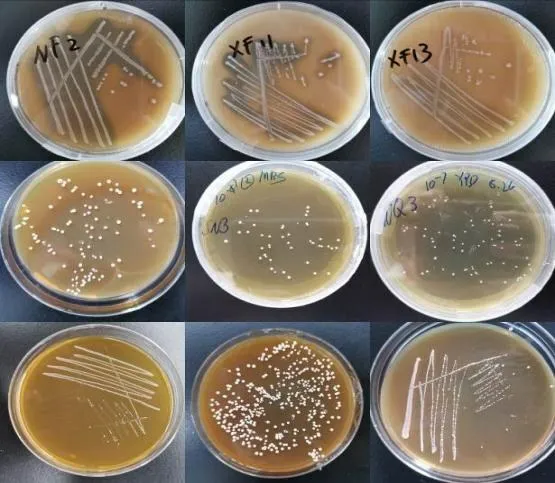
图2 部分乳酸菌平板照片
从图1 可以看出,所有菌株的特异性片段分子量在1500 bp 左右,条带清晰,表明菌株DNA 提取与PCR扩增均成功,可进行下一步测序分析。由图2 可知,乳酸菌在MRS 平板上的菌落较小、形态为圆形、表面光滑、边缘整齐、菌落颜色为乳白色,在加了CaCO3的MRS平板上有明显的溶钙圈。
表4 显示了所分离菌株的鉴定结果,其中肠膜明串珠菌(L.mesenteroides)11 株、假肠膜明串珠菌(L.pseudomesenteroides)5 株、肠膜明串珠菌右旋葡聚糖亚种(L.mesenteroides subsp.dextranicum)4 株、粪肠球菌(E.faecalis)10 株,植物乳杆菌(L.plantarum)4株、乳酸片球菌(P.acidilactici)4 株、布氏乳杆菌(L.buchneri)2株、类肠膜魏斯氏菌(W.paramesenteroides)2 株,共有5 个属、7 个种,共计42 株乳酸菌。
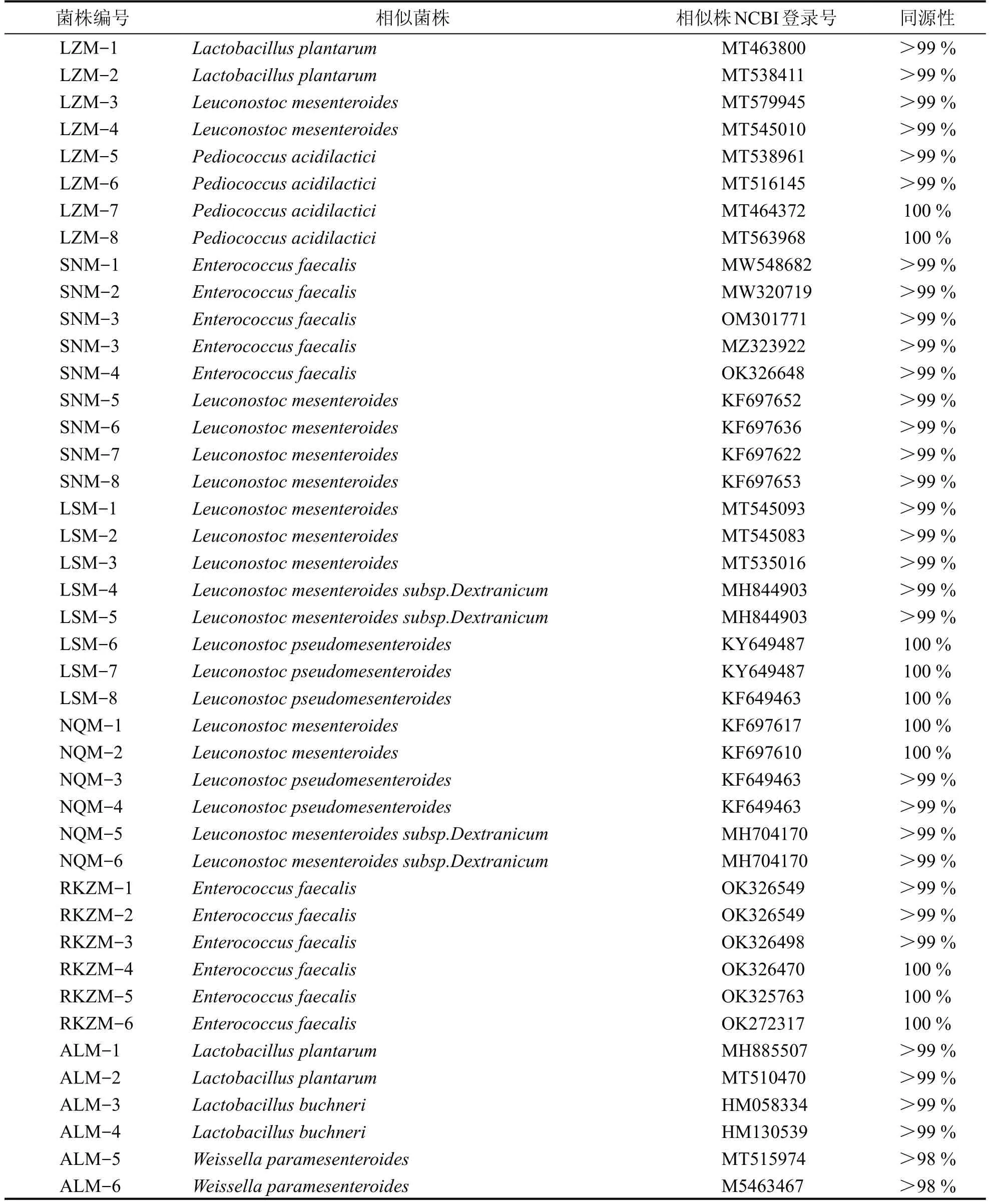
表4 乳酸菌序列比对结果
图3 为部分菌株的系统发育树,详细显示了各菌株间的分类关系,可直观的看出各菌株间亲缘性关系。在发育树中,不同属的乳酸菌被分为3 个分支,乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)在同一分支,乳球菌属(Lactococcus)、肠球菌属(Enterococcus)在同一分支,明串珠菌属(Leuco-nostoc)、魏斯氏菌属(Weissella)在同一分支,同一属不同种的乳酸菌在系统发育树上的位置相近。
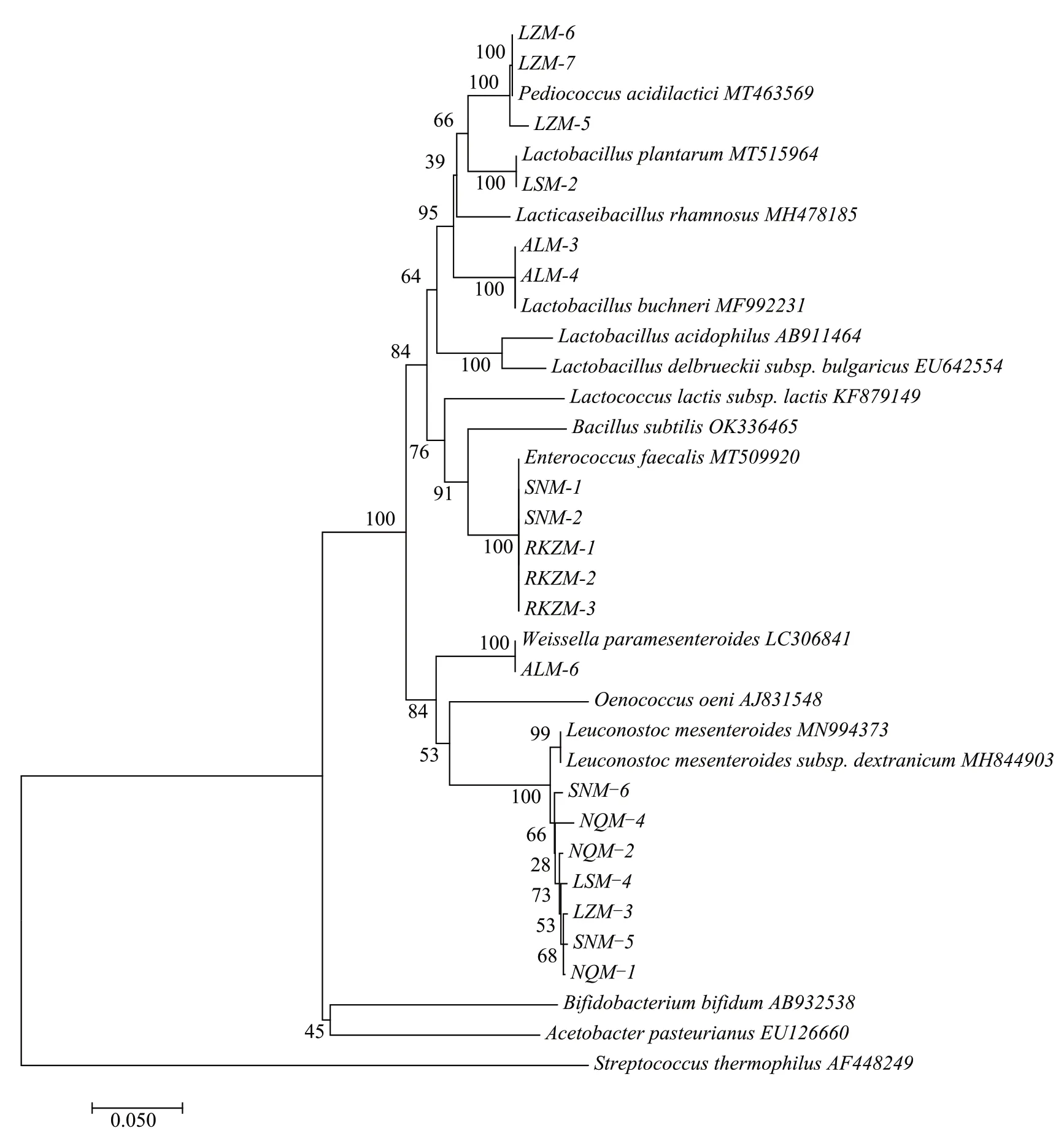
图3 部分菌株16S rRNA序列构建的系统发育树
2.2 乳酸菌发酵能力
凝乳状态是奶酪质量最直接的指标,凝乳时间是评价乳酸菌性能的重要指标,本研究比较了不同乳酸菌的凝乳时间,结果如表5所示。
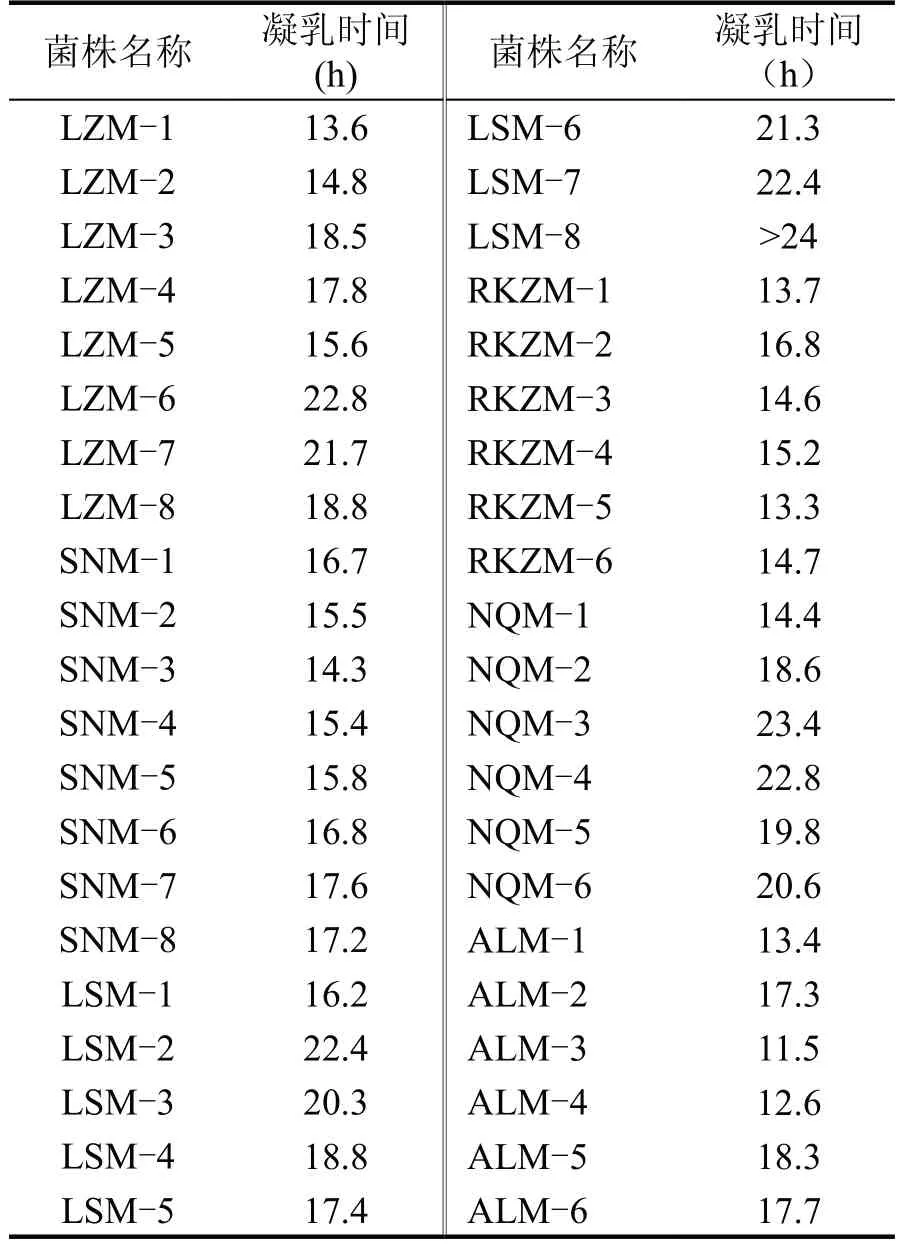
表5 不同菌株的凝乳时间
将所有乳酸菌接种于脱脂乳中进行发酵试验,以筛选发酵时间适中的菌株,发酵时间过短,菌株产酸过快,发酵乳的风味形成不完全,发酵时间过长,菌株产酸能力较弱,虽对风味形成有一定贡献,却增加了生产成本[15]。各菌株的凝乳时间如表5所示,不同菌株的凝乳时间在13~24 h 之间,一般商业化乳酸菌制造发酵乳的发酵时间为6~10 h,是因为其活性较高、且由多种菌复配而成。因此选取不同菌属中凝乳时间较短,产酸能力较强的8 株菌,分别为LZM-1、LZM-5、SNM-5、RKZM-1、RKZM-5、NQM-1、ALM-1、ALM-3,将以上菌株进行后续的滴定酸度测定、持水率测定、耐受性试验、抑菌能力试验。各菌株滴定酸度变化结果如表6所示。
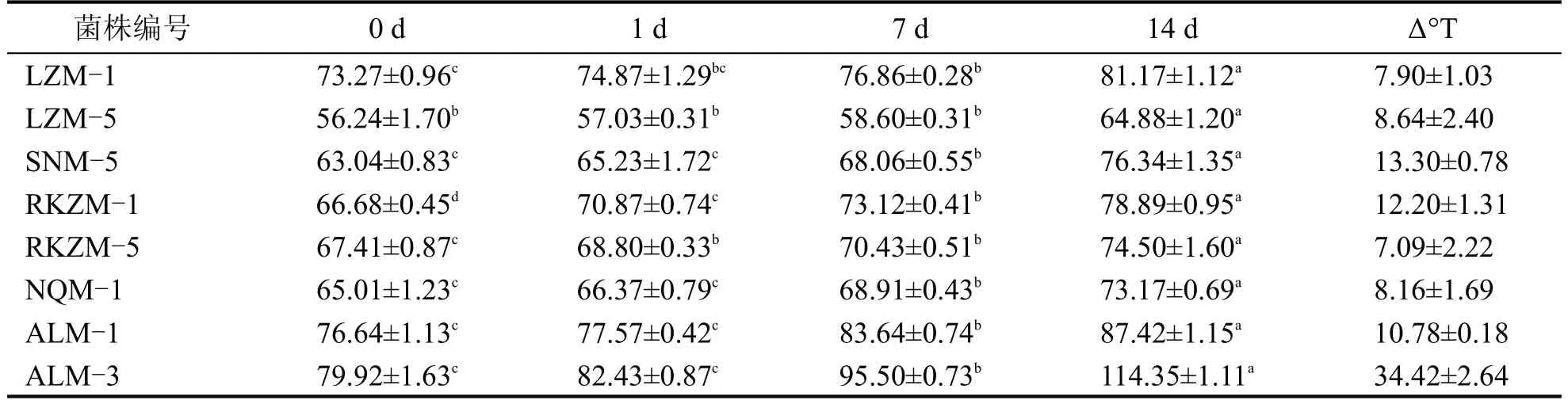
表6 不同菌株滴定酸度变化 (°T)
表6 为初筛菌株所制备发酵乳滴定酸度变化情况,结果显示,LZM-1、ALM-1、ALM-3、RKZM-5 产酸能力较强,ALM-3 的后酸化程度较高,贮藏14 d 后滴定酸度增长了34.42°T±2.64°T,后酸化能力较强的菌株不利于酸乳的贮藏。因此,LZM-1、ALM-1、RKZM-5有作为乳制品发酵剂的潜能。
表7 为初筛菌株所制发酵乳持水率的变化情况,持水率越高,表示发酵乳越黏稠,组织状态较好。LZM-1、ALM-1、RKZM-5 的持水率在贮藏过程中变化不大,ALM-3 的持水率在贮藏的前7 d 逐步增加,在14 d下降明显,原因是其酸度不断上升,酸乳质地崩解,持水率下降。
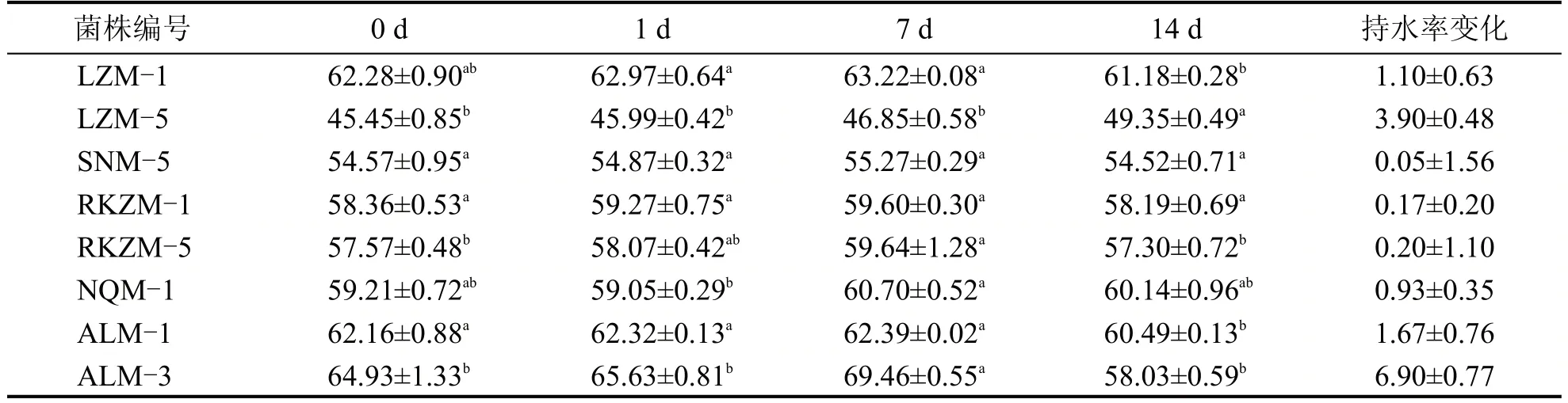
表7 不同菌株持水率变化 (%)
2.3 乳酸菌的生长曲线
在MRS 液体培养基中接种活化好的乳酸菌,将培养基放置于恒温培养箱中培养,培养温度为37 ℃。每间隔2 h,利用酶标仪测定菌液在600 nm处的吸光值,结果如图4所示。
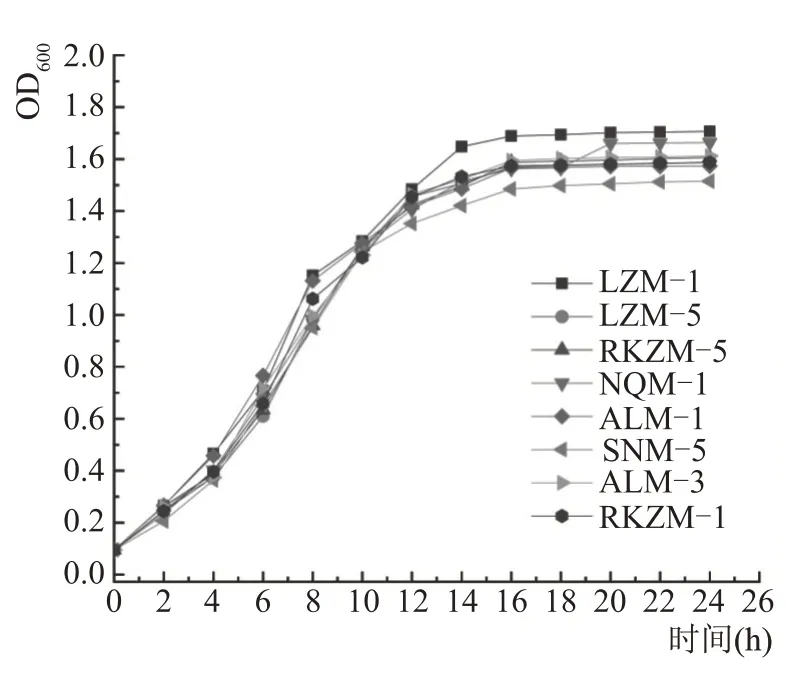
图4 初筛菌株的生长曲线
图4 显示所有菌株在4 h 后进入对数生长期,OD 值增长迅速,在16 h 后进入稳定期,OD 值增长幅度不大,无明显变化。在达到稳定期后,LZM-1有最高的吸光值,生长最为旺盛,SNM-5 的吸光度值最低,生长情况不如其他菌株。
2.4 乳酸菌耐受性结果
盐渍是许多奶酪生产工艺中重要的一步,加盐可促进奶酪内部乳清的排出、增加奶酪的硬度,还可以改善奶酪的风味,防止杂菌对奶酪造成污染[16]。因此用于生产奶酪的菌种应具有一定的耐盐性。
图5 为8 株乳酸菌的耐盐性能测定结果,随着NaCl 浓度的增加,菌株的生长逐渐受到抑制,随着培养时间的增加,菌株的生长逐渐恢复。所有菌株都可以在7 % NaCl 环境下生长,具有一定的耐盐特性。
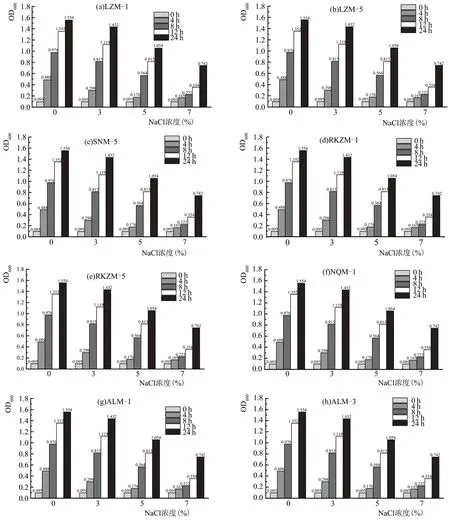
图5 不同菌株耐盐性能
乳酸菌为发挥其益生作用,需先经过胃,然后在人体肠道内定殖,因此需要具有一定的酸耐受性与胆盐耐受性,商业化的益生菌必须具有良好耐酸耐胆盐性能[17]。图6 为8 株乳酸菌的耐酸性能测定结果,所有菌株在pH6.5 的条件下生长迅速,在pH4.0的条件下生长受到抑制,但仍能正常生长,在pH3.0、pH2.0 的条件下,所有菌株的OD 值几乎不增加,菌株不能正常生长。所筛选的8 株乳酸菌均能耐受pH4.0的条件,耐酸性能较为良好。
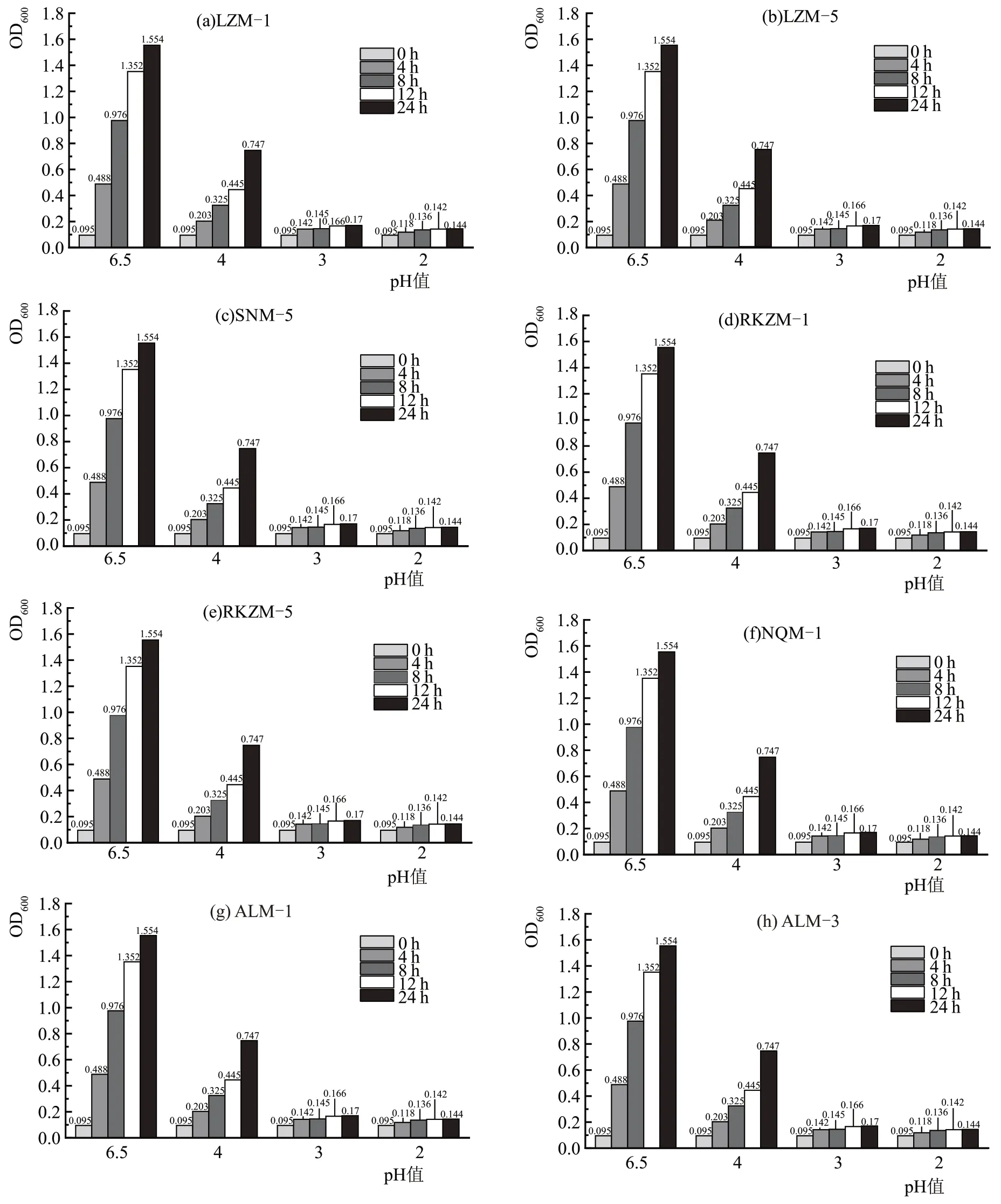
图6 不同菌株耐pH性能
图7 为8 株乳酸菌的耐胆盐性能测定结果,胆盐对乳酸菌的抑制作用较为明显,培养基中胆盐浓度为0.1 %时,所有菌株的OD 值下降十分迅速,ALM-3、LZM-1、RKZM-1、SNM-5 的生长较好于其他菌株;胆盐浓度为0.3%时,RKZM-5 的OD 值尚有增加;胆盐浓度为0.5%时,所有菌株的OD 值增长均不明显。通常人体肠道内含有0.3%以下的胆盐。所有菌株都可耐受0.1 %浓度的胆盐,具有一定的胆盐耐受性。
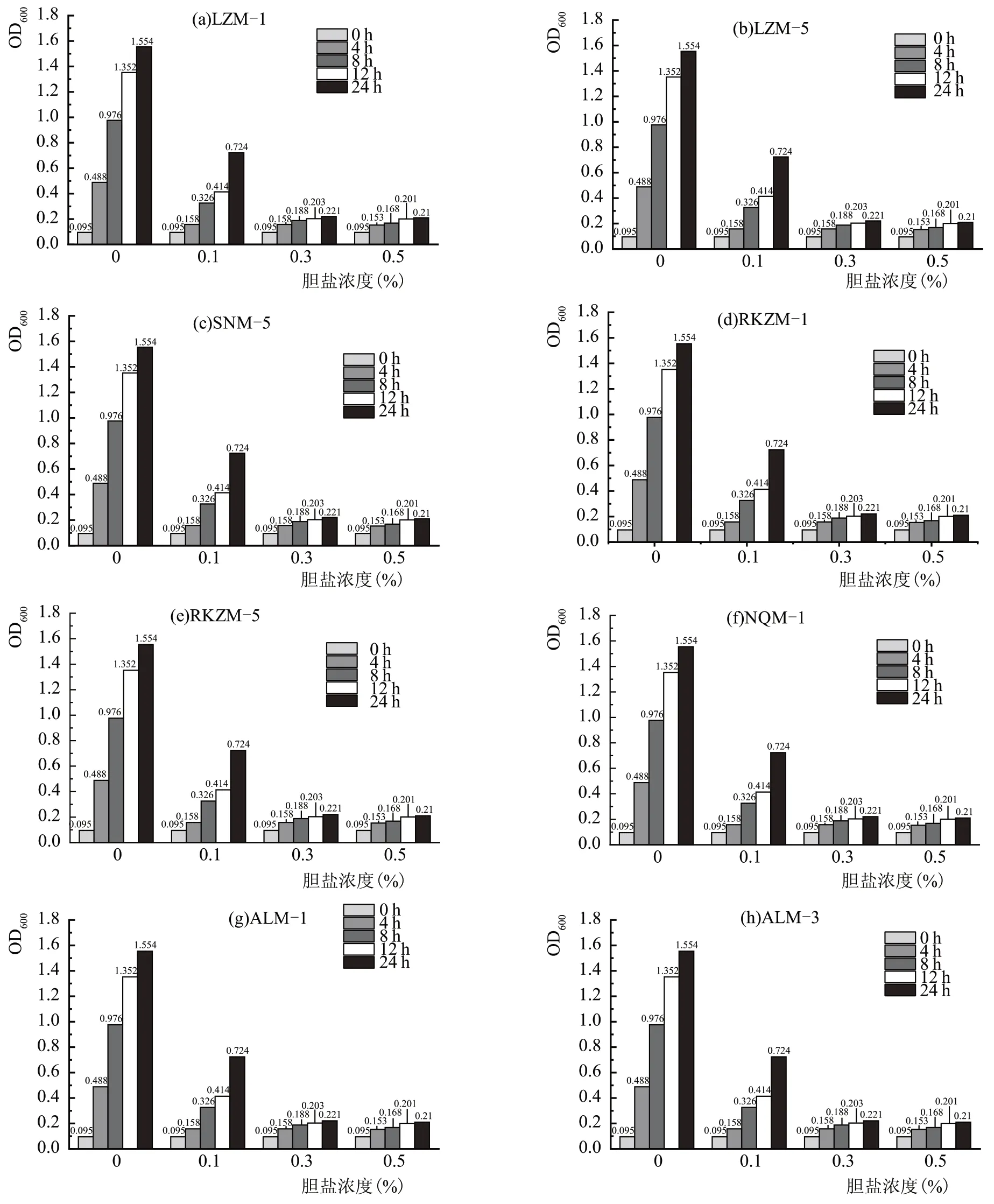
图7 不同菌株耐胆盐性能
在乳制品的生产发酵过程中,根据产品需要设定相应的发酵温度,部分菌株的发酵温度较高,因此乳酸菌对较高的温度应有一定耐受性,在奶酪的成熟过程中,贮藏室的温度较低,乳酸菌应该在较低温度下可以正常生长[18]。如图8 所示,所有菌株在45 ℃下均可正常生长,但其活性不如生长在37 ℃的菌株。LZM-5、RKZM-5 在15 ℃生长较为缓慢,其余菌株在15 ℃生长初期较为缓慢,延滞期较长,在12~24 h 时生长速度加快,最终生长良好。综上所示,所有乳酸菌在37 ℃下生长良好,在45 ℃也可正常生长,在15 ℃下LZM-5、RKZM-5生长十分缓慢,其他菌株可正常生长。
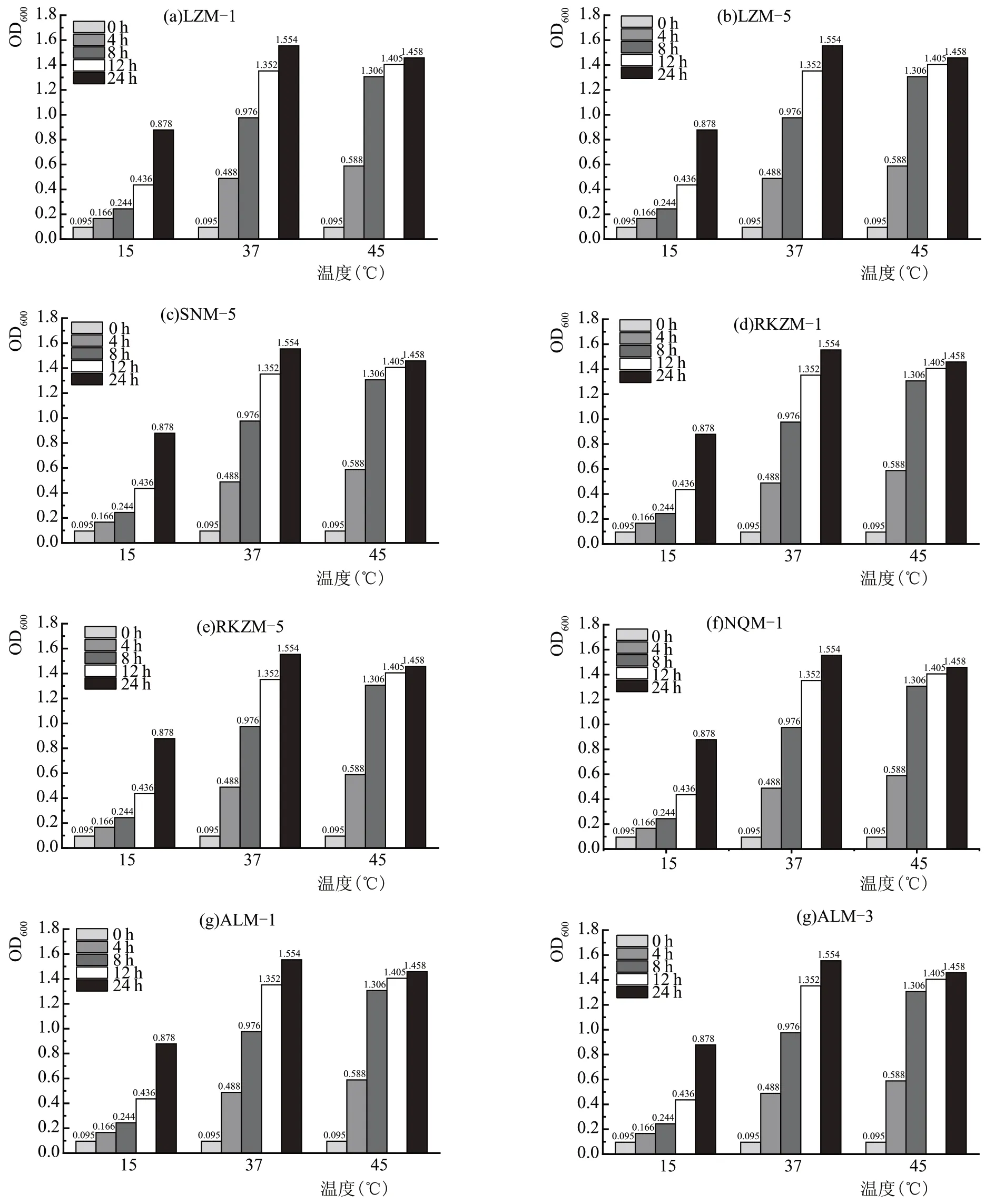
图8 不同菌株在不同温度的生长情况
2.5 乳酸菌抑菌能力
奶酪在成熟贮藏等过程中,需要存放较长时间,在此期间内易受各种杂菌污染,奶酪中的乳酸菌具有天然的抑菌效果,可有效抑制各种致病菌的生长,以保证奶酪在贮藏期间的安全性[19]。本研究分析了8 株乳酸菌对大肠杆菌和金黄色葡萄球菌的抑菌效果,结果如表8所示。
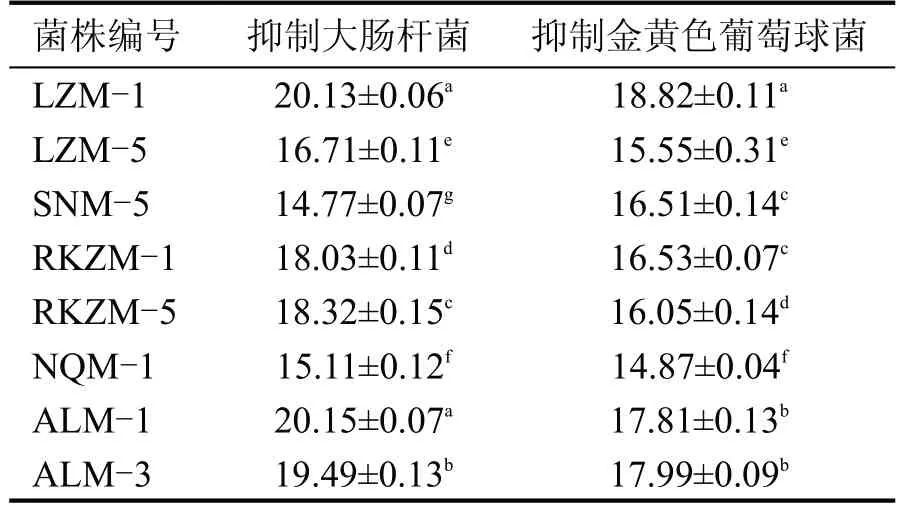
表8 乳酸菌抑菌圈直径 (mm)
由表8、图9 显示,乳酸菌的抑菌圈直径越大,对致病菌的抑制效果越好。8株乳酸菌都对最常见的两种致病菌有一定的抑制效果。植物乳杆菌LZM-1和ALM-1,布氏乳杆菌ALM-3对这两种常见致病菌的抑制效果均较好,肠膜明串珠菌SNM-5 和NQM-1 的抑菌效果则相对较差一些。抑菌效果更好的菌株有一定的益生潜能。
图9 部分菌株的抑菌圈
3 结论
通过对乳酸菌进行发酵试验初步筛选出8 株凝乳时间较短的乳酸菌,测定8 株乳酸菌的滴定酸度与持水率,LZM-1、ALM-1、RKZM-5 的后酸化能力较弱,在贮藏14 d 内,滴定酸度与持水率的变化率较小。耐受性结果显示,可耐受7 % NaCl 浓度、pH4.0 酸性条件、0.1 %胆盐浓度,并且可在15 ℃与45 ℃环境中生长,对大肠杆菌与金黄色葡萄球菌有明显的抑制效果,所筛选菌株有进一步挖掘开发的潜力。
乳酸菌按照其在乳制品中的作用,可分为发酵剂乳酸菌和非发酵剂乳酸菌,发酵剂乳酸菌多为乳杆菌属(Lactobacillus)或乳球菌属(Lactococcus),在牛乳中产酸速率高,可促进凝乳。非发酵剂乳酸菌在奶酪生产过程中产酸作用弱或不产酸,主要起加快奶酪成熟、改善奶酪风味的作用[20]。一些嗜温型乳酸菌如明串珠菌属(Leuconostoc)、肠球菌属(Enterococcus)等在奶酪成熟过程中作为产香菌,可加快成熟并产生风味物质,对奶酪的整体风味起修饰作用[21]。以上各种微生物均在西藏曲拉中占有较高的丰度,这些微生物共同发酵制成曲拉。曲拉作为我国传统发酵食品,自然发酵的方式赋予了曲拉独特的风味,同样有可能使致病菌生长繁殖,导致其安全性受到严重影响。因此,探明发酵过程中的关键微生物,对优良菌种进行工业化应用,对保证曲拉安全性、改善曲拉风味与品质等具有重要意义。
