自体富血小板血浆用于肛瘘术后创面修复的实验研究
2023-06-29王厚东张秀峰裘建明鲁振锋
王厚东 张秀峰 裘建明 鲁振锋 沈 忠
肛瘘是常见的肛肠疾病,目前手术是肛瘘的主要治疗方式,但术后切口愈合缓慢,并且容易假性愈合及复发[1-4]。自体富血小板血浆(platelet-rich plasma,PRP)是通过差速离心的方法从自体血中提取出来的血小板浓缩物,近年广泛应用于糖尿病足、慢性下肢静脉性溃疡、压疮等难愈性创面的临床治疗,效果良好[5-7],而PRP 在肛瘘术后创面修复方面的研究较少。本研究通过在猪肛瘘术后创面局部注射PRP,观察术后创面的愈合效果。现报道如下。
1 材料与方法
1.1 实验动物 体质量30 kg 雄性巴拿马猪10 只[上海西普尔必凯实验动物有限公司,SCXK(沪)2018-0006],饲养于浙江中医药大学动物实验研究中心清洁级动物房的标准笼中,使用许可证号:SYXK(浙)2018-0012。标准饲料,自由摄食、饮水。饲养条件为温度26 ℃,湿度50%,环境噪声<60 dB。动物饲养条件符合《实验动物管理条例》,所有动物相关操作均遵循浙江中医药大学有关动物伦理规定及条例。
1.2 主要试剂及仪器 猪促血管生成素素-2(angiopoietin-2,ANG-2)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒,江苏酶免实业有限公司,MM-0455O2;猪表皮细胞生长因子(epideermal growth factor,EGF)ELISA 试剂盒,江苏酶免实业有限公司,MM-0416O2;猪白细胞介素6(interleukin-6,IL-6)ELISA 试剂盒,江苏酶免实业有限公司,MM-0418O2;猪白细胞介素12(interleukin-12,IL-12)ELISA 试剂盒,江苏酶免实业有限公司,MM-0864O2;重组Anti-Vimentin 抗体,Abcam 公司,Ab92547;猪CD34 双抗,江苏酶免实业有限公司,MM-77718;Medifuge 离心机,意大利Silfradent 公司;酶标仪,MD 公司;正置荧光显微镜,日本尼康;成像系统,日本尼康。
1.3 实验方法
1.3.1 肛瘘造模 肌肉注射速眠新Ⅱ号(2 mg/kg)和阿托品(0.05 mg/kg)诱导麻醉,气管插管后予以3%异氟烷3 L/min 维持麻醉。麻醉成功后,取仰卧位,固定好四肢及尾部。清理残留猪肛管内粪便后碘伏消毒肛周直径约15 cm 范围及肛管,铺巾。参考A Ba-Bai-Ke-Re 等[8]的挂线法造瘘。右侧位距离肛缘约3 cm 做一大小约0.5 cm 切口,血管钳钝性分离皮下组织至齿状线上,注意避开肛门括约肌,血管钳由齿状线上突破直肠黏膜穿出,引入丝线,在丝线引导下穿入橡皮筋,并固定,同法在左侧位对称部位做一挂线(见图1)。所有实验动物挂线手术操作均为同一实验员。

图1 肛瘘造模
1.3.2 瘘管造影评估瘘管形成 术后第28 天去掉橡皮筋,第38 天进行瘘管造影评估瘘管形成情况。麻醉后取仰卧位,两后肢充分外展,清理猪肛管及下端直肠内残留粪便,轻柔置入60 mL 注射器外套筒,注意避免损伤肠黏膜,待C 臂机摄片确定合适位置后,实验员穿着铅衣,做好个人防护,予以泛影普胺自瘘管外口缓慢注入,防止外漏,边注入边摄片,观察瘘管管腔是否形成。
1.3.3 肛瘘切除及内口关闭 瘘管造影提示所有实验猪的瘘管造模成功,麻醉成功后,沿着外口距离外口边缘1.0 cm 做标记,环形切开皮肤及皮下组织,锐性结合钝性分离瘘管至内口处,右手提起外口及瘘管,可触及内口处粘膜凹陷,丝线全层荷包缝合内口处后,切除瘘管,创面充分止血,切除标本送病理学检查,见图2。

图2 肛周瘘管切除术
1.3.4 PRP、乏血小板血浆(platelet-poor plasma,PPP)的制备与使用 术后第3 天,抽取10 mL 外周静脉血,按照差速离心机说明书要求选择PRP 模式,进行差速离心。离心得到的产物抽取红细胞上层约2 mL 液体为富含血小板的PRP,剩余上层液体则为PPP,留取样本进行血常规检查PRP、PPP 及外周静脉血中血小板浓度。
清理手术创面,采用自身对照,将实验动物左右侧创面随机分为PRP 组与PPP 组。生理盐水及碘伏冲洗创面后,PRP 组侧创面予以PRP 注射,PPP 组侧创面予以PPP 局部注射。注射范围为创面及皮肤创缘0.5 cm,针距间隔1.0 cm,深度0.5 cm,每点注射0.1 mL。
1.3.5 随访创面愈合情况及免疫组化分析 随访观察切口愈合情况,待创面闭合后行B 超检查进一步评估创面愈合情况。愈合标准为:肛瘘分泌物消失,创面愈合良好。甲级愈合:愈合优良,没有不良反应的初期愈合;乙级愈合:愈合欠佳,愈合处有炎症反应,如红肿、硬结、血肿、积液等但未化脓;丙级愈合:切口化脓,需切开引流。术后第12 天取创面组织标本,ELISA 检测组织样本中EGF,Ang-2、IL-6、IL-12含量,免疫组化检测CD34 表达水平以及免疫荧光检测波形蛋白(Vimentin)表达情况。
1.3.6 统计学方法 应用SPSS 17.0 软件进行统计学分析,计量资料数据采用均数±标准差()表示;正态性检验采用Kolmogorov-Smirnov 检验,方差齐性检验采用Levene 检验;两样本均数比较采用t 检验;多样本均数比较采用单因素方差分析(one-way ANOVA),多样本均数间两两比较采用LSD-t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 造影及瘘管病理检查结果 10 只猪20 条瘘管造影提示造模成功(见图3),病理结果可见管腔内肉芽组织及管壁纤维组织,见图4。
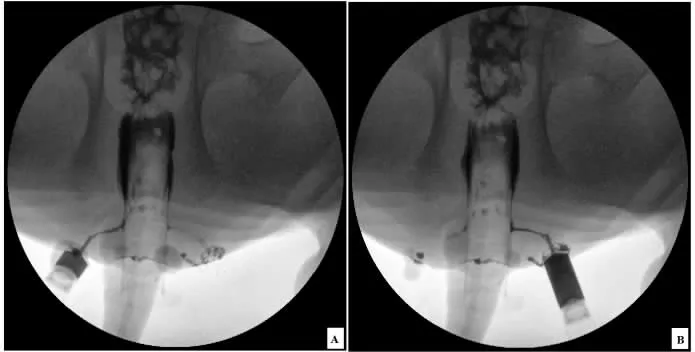
图3 瘘管造影

图4 瘘管病理图片(HE 染色,400×)
2.2 外周静脉血、PRP 及PPP 中血小板浓度比较常规检查显示,周静脉血、PPP 及PRP 中血小板平均浓度为(194.10±44.44)×109/L、(80.90±28.58)×109/L、(668.90±188.30)×109/L,各组间比较,差异有统计学意义(P<0.05)。
2.3 肛瘘愈合情况 所有瘘管切除后创面均为甲级愈合,未发现有明显假性愈合及不愈合创面(见图5)。PRP 注射组平均愈合时间为(16.9±2.0)d,显著低于PPP 注射组(21.2±2.1)d,差异有统计学意义(t=-4.660,P<0.01)。B 超评估所有创面未见明显假性愈合。
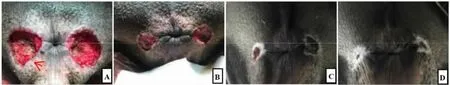
图5 术后随访图片
2.4 EGF、Ang-2、IL-6、IL-12、CD34 及Vimentin 表达水平 ELISA 结果显示,PRP 注射组创面组织中EGF 和Ang-2 含量高于PPP 注射组,差异有统计学意义(P<0.01)。免疫组化结果显示,PRP 注射组的CD34 水平显著高于PPP 注射组(P<0.05)。免疫荧光检测结果显示,Vimentin 蛋白在PRP 注射组的组织中的水平高于PPP 注射组(P<0.01)。在组织炎症反应方面,炎症因子IL-6 及IL-12 在PPP 注射组的创面组织中含量均显著高于PRP 注射组(P<0.01)。见表1。
表1 两组创面中央组织EGF、Ang-2、CD34、Vimentin、IL-6 及IL-12 含量比较()
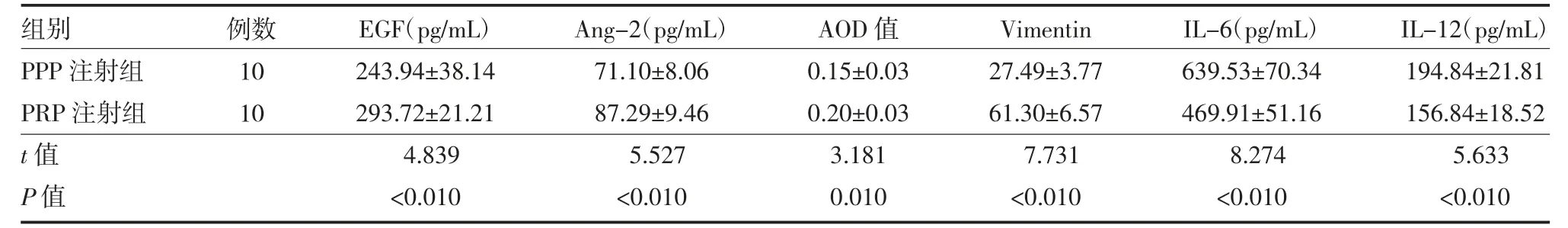
表1 两组创面中央组织EGF、Ang-2、CD34、Vimentin、IL-6 及IL-12 含量比较()
注:PPP 为乏血小板血浆;PRP 为富血小板血浆;EGF 为表皮生长因子,Ang-Ⅱ为促血管生成素Ⅱ;AOD 为平均光密度值;Vimentin 为波形蛋白;IL-6 为白介素-6;IL-12 为白介素-12
3 讨论
肛瘘平均发病年龄为30~40 岁,平均发病率为1.69/10000,近年来逐步升高[9]。肛瘘难以自愈,手术是主要治疗方式,但术后切口愈合缓慢,住院时间长,医疗费用高,且术后易出现假性愈合及复发,目前对于复杂性肛瘘的治疗,仍较为困难。PRP 是从自体血中提取出来的血小板浓缩物,包含的各生长因子,其浓度比例与体内相似,且生长因子之间有最佳协同作用,具有促进创面修复、减少出血和渗出、抗感染等作用。PRP 近年来在难愈合性创面,如糖尿病足、压疮及慢性下肢静脉性溃疡等疾病的临床应用中取得良好的治疗效果[10-12]。
本研究采用挂线法对巴拿马猪进行肛瘘造模,瘘管造影显示,所有瘘管均造模成功,组织病理检查进一步明确瘘管形成。血常规检查提示,PRP 组血小板水平明显高于PPP 组及外周静脉血。瘘管切除后将PRP 注射到创面,术后12 d 取创面组织进行分析。ELISA 法检测结果提示,PRP 注射可以抑制炎症反应介质IL-6 及IL-12 水平,提高创面组织中Ang-2 及EGF 水平;免疫组化提示,PRP 组新生血管标记物CD34 明显高于PPP 组;免疫荧光检测显示,PRP组波形蛋白水平明显高于PPP 组。观察结果显示,PRP 组瘘管愈合时间明显少于PPP 组,表明PRP 能够促进肛瘘术后创面的愈合。
PRP 促进创面愈合可能与PRP 促进细胞增殖、新生血管形成及组织重塑有关。当上皮组织损伤时,血小板形成止血血栓,分泌凝血因子促进纤维蛋白凝固,血栓和凝固的纤维蛋白可作为细胞增殖和迁移的基质[13-17]。PRP 可以上调细胞周期蛋白A(cyclin A)以及细胞周期蛋白依赖性蛋白激酶4(cyclin dependent kinase 4,CDK4)表达,可以促进细胞增殖及迁移[15]。Koulikovska 等[16]研究发现,PRP 可以显著抑制角膜基质细胞凋亡。PRP 在用于鼠皮肤伤口实验中发现,实验组小鼠创面动脉血管密度显著高于对照组,并且实验组小鼠创面愈合速率明显高于对照组,与本研究结果相似,并且本研究进一步发现,PRP可以提高促Ang-2 水平,表明PRP 可以促进创面血管再生促进伤口愈合[17]。此外,PRP 还可以通过加速上皮细胞分化,促进组织形成结构紧密、排列有序的胶原蛋白束加快伤口愈合[18]。本研究发现,PRP 注射后创面EGF 升高,可以进一步提高成纤维细胞水平,波形蛋白水平增高,可以促进伤口愈合。Kakudo等[19]对使用PRP 的植皮供区进行HE 染色及胶原纤维染色也发现,上皮组织厚度明显高于对照组。本研究中,PRP 注射组炎症反应水平较PPP 组低,PRP 可能通过促进单核细胞分化为树突状细胞建立抗感染的微环境,为感染性伤口的愈合起到抑制炎症反应的作用[20]。
本研究发现,采用挂线法进行肛瘘造模简便易行,造模成功率高。对于肛瘘切除术后创面,自体PRP 局部注射可以显著促进愈合,其促进愈合的机制可能与PRP 可以提高创面组织中EGF 及Ang-2含量,促进上皮生长及新生血管形成有关。此外,PPR还可以减轻组织炎症反应,这些作用共同作用于创面,加速创面愈合。对于PRP 促进肛瘘术后伤口愈合的作用机制尚需要进一步深入研究。
