血管活性肠多肽对老龄勃起功能障碍大鼠的作用及机制研究
2023-06-29张存明王军卫吴忠标叶海波
张存明 王军卫 陈 松 吴忠标 叶海波
勃起功能障碍(erectile dysfunction,ED)是指持续或反复出现的无法达到和/或维持阴茎勃起完成性活动,而年龄是ED 最为重要的发病原因之一,ED发病率随着年龄增长而升高[1]。ED 是最常见的男性性功能障碍,40~69 岁的男性患病率为61%,而70岁以上男性患病率则高达77%[2]。血管活性肠多肽(vasoactive intestinal polypeptide,VIP)是非肾上腺素能非胆碱能抑制性神经的重要递质,具有扩张血管、松弛平滑肌、抗炎等作用。前期研究表明,VIP 可以改善性腺功能障碍大鼠的勃起功能[3]。本研究通过延长饲养时间并进行勃起功能测试,构建老龄模型ED 大鼠,探讨VIP 对老龄模型ED 大鼠的治疗作用及其机制。
1 实验材料
1.1 动 物 SPF 级雄性SD 大鼠40 只,6 月龄,体质量300~320 g。购自上海斯莱克实验动物有限责任公司,动物生产许可证号:SCXK(沪)2019-0005,饲养于浙江中医药大学动物实验中心,实验动物使用许可证SYXK(浙)2019-0098。本实验经浙江中医药大学动物管理与伦理委员会审核通过。动物饲养:温度(20±2)℃,湿度55%,照明/黑夜:12 h/12 h,自由饮食、饮水的环境。
1.2 药品和试剂 阿扑吗啡(B6936,批号ZJK-0921)购自ApexBio Technology;BCA 蛋白浓度测定试剂盒(P0012S,批号198273)、极超敏ECL 化学发光试剂盒(P0018FS,批号238924)、RIPA 裂解液(P0013K,批号938475)购自上海碧云天生物公司;环磷酸腺苷(cyclic adenosine monophosphate,cAMP)(H164,批号KD-3944)、一氧化氮(NO)酶联免疫吸附试验(ELISA)检测试剂盒(A012-1-2,批号20219434),均购自南京建成生物有限公司;VIP 购自Sigma 公司(V0131,批号SE-62344);蛋白激酶A(protein kinase A,PKA)(ab75991,批号D-1892)、内皮源性一氧化氮合酶(endothelial nitric oxide synthase,eNOS)(ab300071,批号D-8823)、血管性血友病因子(von willebrand factor,vWF)(ab6994,批号D90287)、血管内皮生长因子(VEGF)(ab214424,批号D0938),均购自英国Abcam 公司;HRP 羊抗鼠二抗(RS0002,批号R2903-2)、β-actin 兔抗大鼠单克隆抗体(YM3028,批号KL20384-8),购自北京Immunoway 公司。
1.3 仪 器 信息化生物信号采集与处理仪器(泰盟BL-420N),Olympus 正置图文采集系统显微镜(BX53M),微量高速冷冻离心机(M1324R),蛋白垂直电泳仪及转膜仪(美国Bio-Rad 公司),Fluor chem R 成像仪(Protein Simple 公司),脱水机、组织蜡块切片机(美国Thermo Scientific 公司,HM340E)。
2 实验方法
2.1 模型建立及分组处理 将40 只SD 大鼠饲养至18 个月龄,使用阿扑吗啡进行勃起诱导实验,阴茎头充血及末端阴茎出现记为1 次勃起,勃起次数≥1 次为阳性,勃起次数为0 分为ED 大鼠[4]。将筛选出的21 只大鼠按照随机数字表法分为老龄勃起功能正常大鼠组(正常组)、老龄ED 大鼠组(ED 组)和老龄ED 大鼠药物干预组(干预组),干预组大鼠使用VIP 25 ng/kg 隔日腹腔注射,治疗28 d[5]。
2.2 海绵体内压及平均动脉压(mean arterial pressure,MAP)测定 所有大鼠用戊巴比妥钠(40 mg/kg)麻醉后沿腹正中线切口切开,使用显微器械暴露走形往阴茎方向的腹侧海绵体神经进行电刺激,电刺激参数设定为:频率20 Hz,宽度5 ms,电压5 v,持续60 s,间隔休息时间5 min。同时将连接生理信号采集处理系统的22 号紫色输液针置入阴茎海绵体内,暴露同侧颈动脉置入PE-50 管以监测MAP[6]。
2.3 组织免疫荧光染色法检测大鼠阴茎海绵体vWF 表达 机能实验结束后获取的阴茎海绵体组织用4%多聚甲醛固定过夜,石蜡包埋后切成5 μm 切片,脱蜡及乙醇脱水,枸橼酸钠进行抗原修复后使用10%山羊血清37%湿盒内封闭30 min,一抗4 ℃孵育过夜,二抗在37 ℃避光孵育1 h,加入DAPI 染色液室温避光孵育10 min。防荧光淬灭封片剂封片后使用荧光显微镜观察并记录。
2.4 ELISA 法检测海绵体组织cAMP 和NO 含量大鼠阴茎组织获取后置于-80 ℃冰箱备用,临用时在组织中加入9 倍体积的磷酸盐缓冲溶液,匀浆后5000 r/min 离心15 min,获取的上清液按试剂盒说明书操作,测定cAMP 和NO 含量。
2.5 蛋白印迹法检测阴茎海绵体组织PKA、eNOS、vWF 及VEGF 蛋白表达 大鼠阴茎海绵体组织粉碎后加入蛋白裂解试剂提取组织总蛋白,使用BCA 试剂进行蛋白定量后将样品与5×蛋白上样缓冲液按4∶1 在冰上配置混合液体混匀后于100 ℃水浴锅中煮沸10 min,冷却后置于-20 ℃冰箱保存备用。后续实验室时将等量蛋白加入聚丙烯酰胺凝胶上样孔内,以110 V 的恒压电泳,当溴酚蓝进入底部后进行转膜操作,以300 mA 电流转膜80 min 至聚偏二氟乙烯(PVDF)印迹膜。PVDF 膜5%脱脂牛奶封闭1 h,一抗(PKA、eNOS、vWF、VEGF、β-actin 1∶1000)4 ℃孵育过夜,相应二抗室温下摇床孵育2 h 后使用ECL发光液,使用Image J 分析条带灰度值,以β-actin作为内参,分析各目的蛋白相对表达水平。
2.6 统计学方法 应用SPSS 22.0 软件分析所得数据,符合正态分布的计量资料以均数±标准差()表示,方差齐的数据使用单因素方差分析(one-way ANVOVA),P<0.05 为差异有统计学意义。
3 结果
3.1 各组老龄大鼠勃起功能比较 正常组、ED 组及干预组大鼠各组间基础ICP、MAP 比较,差异无统计学意义(P>0.05)。与正常组比较,ED 组Max ICP 与Max ICP/MAP 明显降低(P<0.01);与ED 组比较,干预组Max ICP、Max ICP/MAP 增高(P<0.05 或P<0.01)。见表1。
表1 各组老龄大鼠勃起功能比较()
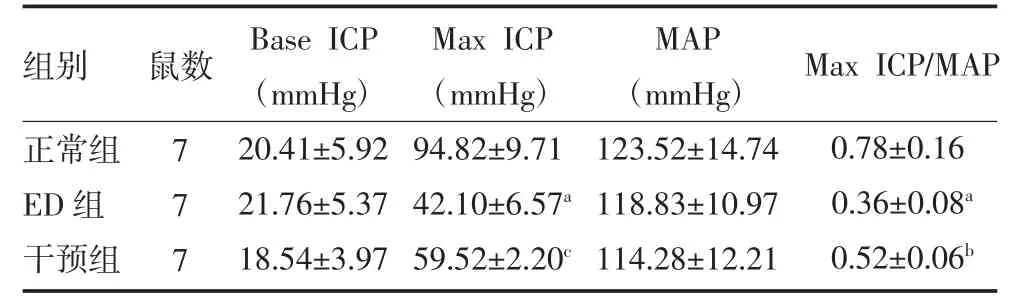
表1 各组老龄大鼠勃起功能比较()
注:正常组为老龄勃起功能正常大鼠;ED 组为老龄勃起功能障碍大鼠;干预组为老龄勃起功能障碍大鼠使用血管活性肠多肽腹腔注射;Base ICP 为基础阴茎海绵体内压;Max ICP 为阴茎海绵体内压最大值;MAP 为平均动脉压;1 mmHg=0.133 kPa;与正常组比较,aP<0.01;与ED 组比较,bP<0.05,cP<0.01
3.2 各组小鼠阴茎海绵体组织vWF 表达比较 免疫荧光结果显示,正常组红色荧光表达明亮,ED 组与正常组比较,红色荧光明显减弱。干预组与ED 组比较,红色荧光明显增加。同时ED 组中,海绵窦充血间隙空间减少,而VIP 治疗后间隙增加,见图1。

图1 荧光显微镜观察各组大鼠阴茎海绵体组织vWF 蛋白荧光强度表达(×100)
3.3 各组大鼠阴茎海绵体组织cAMP 和NO 表达量比较 与正常组比较,ED 组大鼠阴茎海绵体组织上清液cAMP 与NO 含量降低(P 均<0.05)。与ED 组比较,干预组cAMP 明显升高(P<0.01),同时NO 升高(P<0.05)。见表2。
表2 各组大鼠阴茎海绵体cAMP 和NO 表达水平比较()
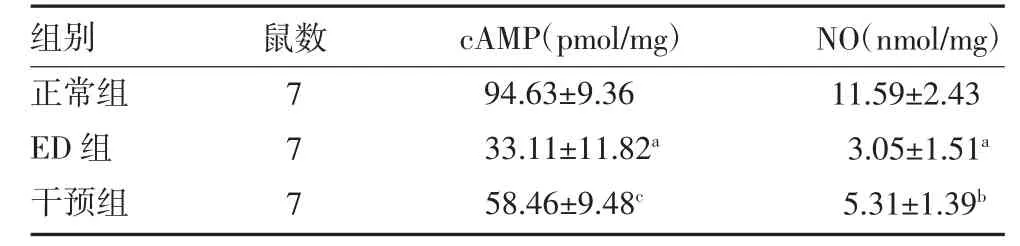
表2 各组大鼠阴茎海绵体cAMP 和NO 表达水平比较()
注:正常组为老龄勃起功能正常大鼠;ED 组为老龄ED 大鼠;干预组为老龄ED 大鼠使用血管活性肠多肽腹腔注射;cAMP 为环磷酸腺苷;NO 为一氧化氮;ED 为勃起功能障碍;与正常组比较,aP<0.01;与ED 组比较,bP<0.05,cP<0.01
3.4 各组大鼠阴茎海绵体组织PKA、eNOS、vWF 及VEGF 蛋白表达比较 与正常组比较,ED 组PKA、vWF 及VEGF 蛋白表达量显著降低(P<0.01);eNOS蛋白表达降低(P<0.05)。与ED 组比较,干预组PKA、eNOS、VEGF 蛋白表达增加(P<0.05);vWF 蛋白表达显著升高(P<0.01)。见图2 和表3。
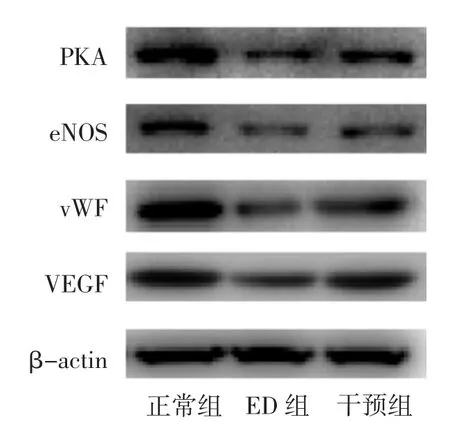
图2 各组大鼠阴茎海绵体组织PKA、eNOS、vWF、VEGF 表达注:正常组为老龄勃起功能正常;ED 组为老龄ED 大鼠;干预组为老龄ED 大鼠使用血管活性肠多肽腹腔注射
表3 各组大鼠阴茎海绵体PKA、eNOS、vWF、VEGF 蛋白表达水平比较()

表3 各组大鼠阴茎海绵体PKA、eNOS、vWF、VEGF 蛋白表达水平比较()
注:正常组为老龄勃起功能正常大鼠;ED 组为老龄ED 大鼠;干预组为老龄ED 大鼠使用血管活性肠多肽腹腔注射;PKA 为蛋白激酶A;eNOS 为内皮源性一氧化氮合酶;vWF 为血管性血友病因子;VEGF 为血管内皮生长因子;β-actin 为β-肌动蛋白;ED 为勃起功能障碍;与正常组比较,aP<0.05,bP<0.01;与ED 组比较,cP<0.05,dP<0.01
4 讨论
衰老所致的阴茎海绵体内皮细胞损伤是导致ED 的主要病因之一,血管新生能力减弱伴随者内皮细胞的功能及数量降低,导致eNOS 表达减弱,从而导致NO 生成不足,平滑肌舒张能力减弱诱发ED[7-8]。VIP 勃起神经递质通过与阴茎海绵体平滑肌细胞膜上的G-蛋白偶联受体结合,活化腺苷酸环化酶后使三磷酸腺苷转化为cAMP,特异性激活PKA 后阴茎充血勃起。近年来研究表明,VIP 在大鼠阴茎海绵体的表达与大鼠年龄差异无关[9],并且能够通过非雄激素依赖的通路参与海绵体平滑肌松弛与勃起[3],男性ED 患者阴茎海绵体注射VIP 联合酚妥拉明能够显著改善ED[10],但是其治疗机制尚未明确。
ICP 检测结果表明,对老龄ED 大鼠腹腔注射VIP 后大鼠阴茎海绵体内压增高,表明血管扩张后流入阴茎海绵体内的充血量及压力增加,侧面反映出大鼠勃起功能障碍得到改善。阴茎内皮细胞功能减退影响血管张力,vWF 主要来源于内皮细胞,是其重要的生物标志物。本研究结果表明,VIP 干预后vWF的荧光强度及海绵窦间隙明显增加,表明VIP 干预后阴茎海绵体内皮细胞数量显著增加。阴茎海绵体内VEGF 蛋白表达随着机体衰老而减少,而VEGF作为一种强效血管生成因子与通透因子,其与血管的生成密切相关。此外动物研究证据表明,VEGF 不仅可以促进内皮细胞的生成,同时能够激活eNOS 生成NO[11],因此VEGF 调控的血管生成是改善老龄ED 的重要机制。VIP 腹腔注射能够促进老年ED 阴茎海绵体内VEGF 的表达,荧光结果显示vWF 增加,提示应用VIP 后阴茎海绵体内血管再生的同时伴随着内皮细胞的增生。
老年ED 大鼠海绵体内皮细胞减少后eNOS 蛋白表达量亦明显降低,当VIP 治疗后eNOS 蛋白表达量增加,同时cAMP 与NO 的表达增加。因此,VIP可能通过VEGF 促进大鼠阴茎海绵体血管以及内皮细胞的生成,而内皮细胞来源的eNOS 生成的NO 增加是导致阴茎海绵体内灌注及海绵体内压恢复的重要机制。VIP 能够激活cAMP/PKA 信号通路促进VEGF 介导的内皮细胞增殖,从而促进局灶性脑缺血的血管生成[12]。本研究中老龄ED 大鼠阴茎海绵体低表达的cAMP 与PKA 被VIP 逆转,因此VIP 能调节大鼠阴茎海绵体cAMP/PKA 信号通路从而促进VEGF 表达以及海绵体内血管增生,促进eNOS 表达释放NO 进而修复勃起功能。
综上所述,VIP 能够有效改善老龄大鼠的勃起功能,其作用机制可能通过调控cAMP/PKA 通路以及改善阴茎海绵体内皮功能有关。
