Box-Benhnken响应曲面法优化大花紫薇中科罗索酸的提取工艺
2023-06-27林艾和朱培芳李蓉夏宗霄龙小妹郭爽范源
林艾和 朱培芳 李蓉 夏宗霄 龙小妹 郭爽 范源
【摘 要】 目的:优选大花紫薇中三萜类化合物科罗索酸的最佳提取工艺。方法:采用 HPLC 建立大花紫薇中CA含量测定方法,以CA含量为评价指标,通过响应曲面法优化工艺,考察乙醇体积分数、料液比、提取时间、提取次数对CA提取效果的影响。结果:CA分离度良好,在0.480~2.880 μg (r=0.9999)范围内呈良好的线性关系,平均加样回收率为 99.97%(RSD=0.58%)。最佳提取工艺条件为采用 95%乙醇、料液比为1∶20 g/mL、回流提取 60 min,提取 2 次。结论:本研究建立的方法结果准确、重复性好,可用于合理优化大花紫薇中CA的提取工艺。
【关键词】 大花紫薇;Box-Benhnken;提取工艺;科罗索酸
【中图分类号】R284.2 【文献标志码】 A 【文章编号】1007-8517(2023)01-0037-06
Box-Behnken Response Surface Methodology for Optimization of Extraction Process of Corosolic Acid from Lagerstroemia speciosa
LIN Aihe1 ZHU Peifang1 LI Rong1 XIA Zongxiao1 LONG Xiaomei1 GUO Shuang1 FAN Yuan1,2*
1. Yunnan University of Chinese Medicine, Kunming 650500, China;
2.Yunnan University of Chinese Medicine/Second Affiliated Hospital of Yunnan College of
Traditional Chinese Medicine, Kunming 650216, China
Abstract:Objective To optimize the extraction process of Corosoic acid from Crape Myrcus macrophylla. Methods HPLC was used to establish a method for the determination of Ca content in Cryptophylla grandiflorum. With Ca content as the evaluation index, response surface methodology was used to optimize the process. The effects of ethanol volume fraction, liquid-solid ratio, extraction time and extraction times on the extraction efficiency of Ca were investigated. Results The Ca separation was linear in the range of 0.480-2.880 μg (r=0.9999).The average recovery was 99.97% (RSD = 0.58%). The optimal extraction conditions were as follows: 95% ethanol, liquid to solid ratio of 1∶20 g/mL, reflux extraction for 60 min, extraction twice.Conclusion The method established in this study was accurate and reproducible, and could be used to optimize the extraction process of CA from Crape Myrrh macrophylla.
Keywords:Lagerstroemia speciosa; Box-Behnken; Extraction Process; Corosolic Acid
大花紫薇(Lagerstroemia specious L.),又名大葉紫薇(Lagerstroemia flos-reginae Retz),是千屈菜科(Lythraceae)紫薇属(Lagerstroemia)的落叶乔木[1]。其原产于亚洲热带,分布于斯里兰卡、印度、马来西亚、菲律宾等地区[2],在我国广东、广西地区有较丰富的资源。
上世纪90年代起,日本、美国以及菲律宾学者开始系统研究大花紫薇化学成分及功能[3],其广泛用于治疗糖尿病及肾病[4],在多个国家已经被开发为茶饮料,广泛用于治疗和预防糖尿病,被誉为“天然植物胰岛素”[5],此外,其还具有减脂、抗氧化、抗菌和抗肿瘤等作用[6]。近年来,随着对大花紫薇的研究深入,发现其降血糖的活性成分主要是鞣质类[5,7-8]和三萜类成分[9-10],其中三萜类主要活性成为科罗索酸[11],其具有胰岛素样作用且可抑制α-淀粉酶和α-糖苷酶活性[12-14]。
科罗索酸(corosolic acid,CA),又名 2α-羟基熊果酸[15],具有降血糖、改善糖尿病性肾损伤、抗肿瘤、抗炎、降血压、抗菌等药理作用[16-19]。其主要存在于大花紫薇、枇杷、北五味子等植物中[20],现关于在大花紫薇中提取CA相关报道较少,本实验研究建立大花紫薇中CA HPLC 定量分析方法,同时采用响应曲面法优化其提取工艺,为在大花紫薇中提取CA的工艺研究和对大花紫薇的后续开发利用提供科学依据。
1 仪器与试药
1.1 仪器 YL-040S 语路超声波清洗机,深圳市即洁超声科技有限公司;Agilent 1200 高效液相色谱仪,DAD检测器,AcclaimC30色谱柱(2.1 mm×150 mm,3 μm),美国 Agilent 公司;DFY-600 摇摆式高速万能粉碎机,永康式速锋工贸有限公司;D2KW-D 电热恒温水浴锅,上海量壹科学仪器有限公司;T-1000 型电子天平,上海浦春计量仪器有限公司;AB265-S 十万分之一分析天平,Mettler-Tolido International Trade(Shanghai)Co.LTD;旋转蒸发仪,上海爱朗仪器有限公司。
试剂:科罗索酸(CA 批号:wkq20042404,纯度≥98%,四川省维克奇生物科技有限公司)。甲醇、乙腈为色谱纯,其余试剂为分析纯。
药材:大花紫薇Lagerstroemia specious L.(批号:P20200819,安国市旭芳中药材经营有限公司)经云南中医药大学李国栋副教授鉴定为千屈菜科Lythraceae紫薇属Lagerstroemia植物大花紫薇的干燥全草。
2 方法与结果
2.1 样品测定方法
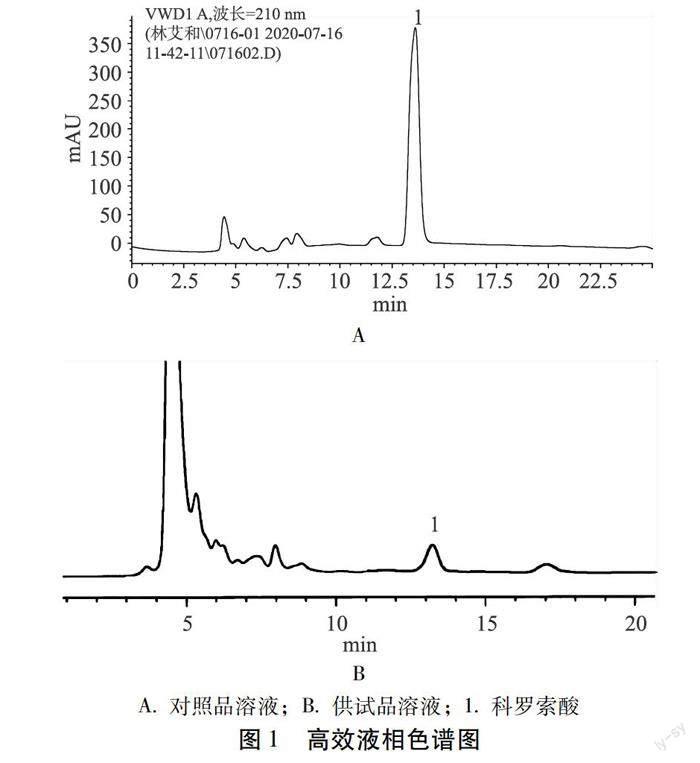
2.1.1 色谱条件 色谱柱:AcclaimC30色谱柱(2.1 mm×150 mm,3 μm);流动相:甲醇(B)-乙腈(C)-0.1%磷酸水溶液(D);梯度洗脱:0 ~10 min 75% B,12.5% C,12.5% D;10~20 min 70% B,15% C,15% D;流速:0.1 mL/min;检测波长:210 nm;柱温:20 ℃;进样量:10 μL。理论塔板数按科罗索酸计算应不低于 5000,分离度大于1.5。色谱图如图1所示。
2.1.2 混合对照品溶液制备 分别精密称取CA对照品2.40 mg,置 10 mL 量瓶中,用甲醇配制成CA浓度分别为0.240 mg/mL 的混合对照品溶液,低温避光保存。
2.1.3 供试品溶液制备 取干燥的大花紫薇,粉碎,过 40 目筛,精密称定约 2.0 g,置于圆底烧瓶中,加热回流,提取温度90℃,设置不同料液比、加热回流时间、回流次数及乙醇体积分数,合并提取液,过滤。滤液于 60 ℃减压回收溶剂至干,残渣加甲醇溶解后移至 10 mL 量瓶中,加甲醇稀释至刻度,摇匀,用 0.45 μm 微孔濾膜过滤,取续滤液,即得。
2.1.4 线性关系考察 取“2.1.2”项下混合对照品溶液,0.45 μm 微孔滤膜膜过滤,依次精密吸取2 μL、4 μL、6 μL、8 μL、10 μL、12 μL, 按“2.1.1”项下色谱条件进样,记录色谱图。以对照品进样量(μg)为横坐标,峰面积为纵坐标,进行线性回归。 CA的回归方程为y=604.24x+1.1333(R2=0.9999),线性范围为 0.480~2.880 μg。
2.1.5 精密度考察 精密吸取同一混合对照品溶液 10 μL,按“2.1.1”项下色谱条件连续进样 6 次,结果CA的峰面积RSD 为1.13% ,表明仪器精密度良好。
2.1.6 稳定性试验 按“2.1.3”项下方法制备供试品溶液,于室温放置 0 h、2 h、4 h、6 h、8 h、10 h,按“2.1.1”项下色谱条件,以峰面积为指标进样分析,结果CA面积 RSD 为1.44%,表明供试品溶液在10 h 内稳定。
2.1.7 重复性试验 取同一批样品 6 份,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样分析,结果显示CA平均含量为2.3246 mg/g, RSD 为 1.28%,表明该方法重复性良好。
2.1.8 加样回收率试验 精密称取已知含量的同一批样品(每 1.0 g 大花紫薇含CA 2.3246mg)粉末 6份,每份精密称取 1.0 g,按“2.1.3”项下方法制备供试品溶液,加入CA对照品适量(约相当于 1.0 g 样品中所含CA的量),再按“2.1.1”项下色谱条件进样测定,计算平均回收率。结果见表 1。
2.2 单因素实验 采用加热回流法提取大花紫薇中的科罗索酸,将料液比、加热回流时间、回流次数及乙醇体积分数作为影响因素,固定其中3个因素,以提取率为评价指标,对另一个因素进行单一因素实验。固定提取时间为60 min,提取次数为1次,料液比为1∶10 g/mL,考察乙醇体积分数(75%、80%、85%、95%、100%)对提取率的影响,优选最佳乙醇体积分数,按所优选条件依次向下考察料液比(1∶10 g/mL、1∶15g/mL、1∶20 g/mL、1∶25 g/mL),提取时间(40 min、60 min、80 min、100 min、120 min),提取次数(1次、2次、3次)对醇提的影响。
结果图2表明,CA含量随乙醇体积分数升高而增加,由于CA是脂溶性物质,不溶于水,随着乙醇体积分数的增加其含量增加,当乙醇体积分数为95%和100%时,CA含量相差不明显,考虑实验成本,故选择乙醇体积分数为 95%[21];CA含量随料液比从1∶10 g/mL到1∶25 g/mL先增加后减少,可能因为为溶剂体积过小,CA无法彻底溶解,但溶剂体积过大,更易溶出其他的杂质达到饱和[22],继续增大料液比不会增加溶出率,故选择料液比 1∶20 g/mL;CA含量随提取时间从40~120 min先增加后减少,CA溶出率一定时间内随着提取时间增加增加,但提取时间过长,料液长时间处于受热状态,更容易造成CA损失,固选择提取时间60 min[23];CA含量在提取次数2次时最大,故选择提取次数两次。最佳条件为乙醇体积分数95%,料液比1∶20 g/mL,提取时间60 min,提取次数2次。
活性物质含量(mg/g)计算公式:
含量=M供×C标/M对
式中M供为供试品峰面积;
C标为标准品的浓度(mg/mL)
M对为标准品峰面积
2.3 Box-Behnken响应面法优化醇提工艺
2.3.1 响应曲面试验设计及结果 依据Box-Behnken响应面试验设计原理,结合上述醇提单因素试验结果,进行因素水平设计与试验。因素水平见表2,结果见表3。
2.3.2 醇提模型拟合及方差分析 采用Design-expert 8.0.6软件对表2中的试验结果进行分析,得到回归方程为
Y=-51.15554+0.94402A+0.40383B+0.13185C+0.72244D-6.7×10-4AB-1.17133×10-3AC+4×10-3AD-3.17333×10-4BC-0.0197BD+2.25917×10-4CD-4.58348×10-3A2-6.60648×10-3B2-1.2384×10-4C2-0.15528D2 R2=0.9158。由表3可知,模型F=10.87(P<0.0001),表明回归模型极显著,失拟项F=2.03,P=0.2584>0.05,表明模型失拟项不显著,可用于分析试验数据。以Y为响应值时,模型的一次项影响顺序是D>B>C>A,和二次项B2、D2有极显著影响(P<0.001),一次项D和二次项A2、C2有高度显著影响(P<0.01),一次项B、C有顯著影响(P<0.05)表明所得回归方程能较好地预测Y随各影响因子的变化。见表4。
2.3.3 醇提响应面优化及预测 经Design-expert 8.0.6软件分析得响应面图(如图3所示),由图可见提取次数对Y值影响较大,交互项对Y值无显著影响,忽略交互作用,以Y值的回归模型的极值分析得到最优提取条件为:乙醇体积分数94.77%,提取时间60 min,提取次数2.27次,料液比1∶20.93 g/mL,Y预测值为2.5783 μg/g,综合实际情况考虑,调整最优提取条件为乙醇体积分数95%,提取时间60 min,提取次数2次,料液比1∶20 g/mL。如图3所示。
2.4 醇提优化工艺验证试验 平行称取大花紫薇3份,每份2.0 g,按所优化条件进行验证试验。结果显示Y平均值为2.5613 mg/g(RSD=1.33%,n=3),与预测值2.5783 mg/g相比较,相对误差为1.20%,说明该模型预测性拟合度良好,所得数据有效可靠。见表5。
3 讨论
3.1 色谱条件 本实验经反复试验,调整甲醇-乙腈-0.1%磷酸水溶液三者的比例,最终选用流动相甲醇(B)-乙腈(C)-0.1%磷酸水溶液(D),梯度洗脱,分离度>1.5,达到了检测要求。大花紫薇中科罗索酸的加热回流提取最佳提取工艺为:乙醇体积分数95%,提取时间60 min,提取次数2次,料液比1∶20 g/mL。实验结果表明,最佳提取方法所得科罗索酸含量为2.5613 mg/g,拟合的模型能较为准确地预测总含量,同时也说明响应面分析法精确度高、模型预测性好。
3.2 结果分析 本试验以科罗索酸为指标成分,用Box-Benhnken响应曲面法优化大花紫薇中CA的提取工艺,经工艺验证实验证明,该提取工艺操作简单,CA的提取率高,节省溶剂且稳定性好,是应用前景较好的提取方法之一,可为后续CA的应用提供参考。
3.2 展望 科罗索酸具有显著的降血糖作用,且对身体毒副作用较小,是一种较为理想的降糖化合物,数据表明大花紫薇是一种科罗索酸的含量较高的天然药用植物,寻找在其中有效提取CA的方法是很有必要的,后续的研究可以在此文章的基础上,从药效、作用机制的角度来探讨中药资源的合理开发。
参考文献
[1]王燕, 孙连娜, 楼永明.大花紫薇化学成分与药理作用研究进展[J]. 福建分析测试, 2014, 23(5): 20-24.
[2] 方文培, 张泽荣.中国植物志[M]. 第五十二卷. 北京: 科学出版社, 1983: 97.
[3] 纵伟. 大叶紫薇叶降血糖作用及机理的研究[D]. 无锡:江南大学, 2005.
[4] MURAKAMI C, MYOGA K, KASAI R. Screening of Plant Constitu-ents for Effect on Glucose Transport Activity in Ehrlich Ascites Tumour Cells[J]. Chem Pharm Bull,1993, 41(12): 2129.
[5] 詹勤. 大花紫薇叶降血糖活性成分研究[D]. 上海: 第二军医大学, 2008.
[6] 冯卫军, 李海兰, 朴光春, 等.大叶紫薇化学成分及药理作用研究进展[J].国际药学研究杂志,2017,44(10):941-946.
[7] KLEIN G, KIM J, HIMMELDIRK K, et al. Antidiabetes and Antiobesity Activity of Lagerstroemia speciosa.Evidencebased Complementary and Alternative Medicine,2007,4(4):401-407.
[8] BAI N, HE K, ROLLER M, et al. Active compounds from Lager-stroemia speciosa, insulin-like glucose uptake- stimulato-ry/ inhibitory and adipocyte differentiation-inhibitory activi-ties in 3T3-L1 cells[J]. J Agric Food Chem, 2008, 56(24): 11668-11674.
[9]HOU W, LI Y, ZHANG Q, et al. Triterpene acids isolated fromLagerstroemia speciosa leaves as α- glucosidase inhibitors[J]. Phytother Res, 2008, 23(5): 614-618.
[10]RAGASA C Y, NGO H T, RIDEOUT J A. Terpenoids and sterols Lagerstroemia speciosa[J]. J Asian Nat Prod Res, 2005, 7(1): 7-12.
[11] 娄旭, 张荣平, 赵昱, 等.大叶紫薇叶的化学成分研究[J].天然产物研究与开发,2006(6):962-963.
[12] LIU F, KIM J K, LI Y, et al. An extract of Lagerstroemia speciosa L. has insulin- like glucose uptake- stimulatory and adipocyte differentiation-inhibitory activities in 3T3-L1 cells[J]. Journal of Nutrition, 2001, 131(9): 2242-2247.
[13] HATTORI K, SUKENOBU N, SASAKI T, et al. Activation of insulin receptors by Lagerstroemin[J].Journal of Pharmacological Sciences, 2003, 93(1): 69-73.
[14] SUZUKI Y, HAYASHI K, KAKUDA T, et al. Effect and mode of action of banaba(Lagerstroemia speciosa L.)leaf extracts on postprandial blood glucose in rats[J].Nippon Eiyo Shokuryo Gakkaishi,2001, 54(3): 131-137.
[15] 馮旭, 李代萍, 陈虹, 等. 科罗索酸研究进展[J]. 解放军药学学报, 2016, 32(5):451-454.
[16] LI X Q, TIAN W, LIU X X, et al. Corosolic acid inhibits the proliferation of glomerular mesangial cells and protects against diabetic renal damage[J]. Sci Rep,2016(6):26854.
[17] LUNA-VZQUEZ F J,IBARRA-ALVARADO C,CAMACHO-CORONA M D R,et al. Vasodilator activity of compounds isolated from plants used in Mexican traditional medicine[J]. Molecules, 2018,23(6):1474.
[18] PENG M Z, LEI Q, XU Y, et al. Inhibition of JNK and activation of the AMPK-Nrf2 axis by corosolic acid suppress osteolysis and oxidative stress[J]. Nitric Oxide, 2018(82):12-24.
[19] 肖旭坤, 王翰华, 阮洪生. 枇杷叶化学成分和药理活性研究进展[J]. 中医药导报, 2019,25(21):60-66.
[20] 张建秀, 柳慧哲, 朴光春, 等. 科罗索酸药理作用研究进展[J]. 国际药学研究杂志, 2019,46(1):22-26.
[21] 王欢, 黄嫣, 李希, 等.响应面法优化白花蛇舌草中齐墩果酸和熊果酸的提取工艺[J]. 中国实验方剂学杂志, 2015,21(20):34-37.
[22]孙宏莱, 时得友, 李丽丽, 等. 响应面法优化软枣猕猴桃枝条总三萜提取工艺及其体外抗炎活性分析[J]. 食品工业科技, 2021,42(15):189-197.
[23]植奇明. 山楂中三萜类化合物提取及成分研究[J]. 化工管理,2016(32):88.
(收稿日期:2022-05-07 编辑:陶希睿)
