机器人辅助腹腔镜手术与开腹手术治疗早期宫颈癌术后生存影响因素的对比分析
2023-06-22周潇妮,张琦玲,蔡丽萍,涂春华,张智,唐旭秀,肖子文,赵娜
周潇妮,张琦玲,蔡丽萍,涂春华,张智,唐旭秀,肖子文,赵娜


摘 要 目的:分析早期宫颈癌患者行机器人辅助腹腔镜手术与开腹手术对其术后生存质量的影响及其相关因素,并进行对比。方法:回顾性分析2016年1月—2021年6月于南昌大学第一附属医院妇科接受治疗的904例早期宫颈癌患者的临床资料。其中研究组为机器人手术组,共413例,患者全部行機器人辅助子宫切除术及盆腔淋巴结清扫术,并对部分患者行腹主动脉旁淋巴结取样;对照组为开腹手术组,共491例,行开腹子宫切除术及盆腔淋巴结清扫术,并对部分患者行腹主动脉旁淋巴结取样。结果:研究组与对照组的一般临床特征相比,差异无统计学意义(P>0.05),但两组术后多项手术质量评价指标(如并发症等)比较,差异有统计学意义(P<0.05)。两组在病理预后因素以及总生存期、无病生存期的对比中并无明显统计学差异(P>0.05)。结论:与开腹手术相比,机器人辅助手术治疗早期宫颈癌患者的手术质量评价较好,但在患者病理预后因素及术后生存期上无明显改善。
关键词 早期宫颈癌;机器人辅助手术;开腹手术;总生存期;无病生存期
中图分类号 R608 R713 文献标识码 A 文章编号 2096-7721(2023)05-0431-10
Comparative analysis on the influencing factors of postoperative survival between robot-assisted
laparoscopic surgery and laparotomy in the
treatment of early cervical cancer
ZHOU Xiaoni1, ZHANG Qiling2, CAI Liping2, TU Chunhua2, ZHANG Zhi2, TANG Xuxiu3, XIAO Ziwen3, ZHAO Na4
(1. Department of Gynecology, the Second Peoples Hospital of Jingdezhen, Jingdezhen 333000, China; 2. Department of Obstetrics and Gynecology, the First Affiliated Hospital of Nanchang University, Nanchang 330000, China; 3. The First
Clinical Medical College of Nanchang University, Nanchang 330000, China; 4. Department of Clinical Laboratory,
the Second Peoples Hospital of Laboratory Jingdezhen, Jingdezhen 333000, China)
Abstract Objective: To compare and analyze the quality of life of patients underwent robot-assisted laparoscopic surgery and laparotomy for early cervical cancer and and its related factors. Methods: A retrospective study was performed on 904 patients with early cervical cancer who were treated in the Department of Gynecology, the First Affiliated Hospital of Nanchang University from January 2016 to June 2021. The study group (robotic surgery group) had a total of 413 cases, all patients underwent robot-assisted hysterectomy and pelvic lymph node dissection, and some patients underwent abdominal aortic lymph node sampling. The control group (laparotomy group) had a total of 491 cases, laparotomy for hysterectomy and pelvic lymph node dissection was performed, and para-aortic lymph node sampling was performed in some patients. Results: There was no significant difference in general clinical characteristics between the study group and the control group (P>0.05), but several postoperative surgical quality evaluation indicators (such as complications) in the study group were significantly different from those in the control group (P<0.05). In addition, there was no significant difference in the comparison of pathological prognostic factors, overall survival and disease-free survival between the two groups (P>0.05). Conclusion: For patients with early cervical cancer, compared with the laparotomy, robotic surgery has better surgical quality evaluation, but there is no significant improvement in terms of pathological prognostic factors and postoperative survival.
Key words Early cervical cancer; Robot-assisted surgery; Laparotomy; Overall survival; Disease-free survival
据相关资料显示,世界范围内每年有50多万宫颈癌新发病例,是全球面临的较为严重的公共卫生问题[1]。随着宫颈癌预防筛查的广泛开展、HPV疫苗的上市以及治疗技术的改进,宫颈癌的发病率和死亡率均呈下降趋势,但每年仍有近30万女性死于这一疾病[2]。因此,对于宫颈癌的预防和治疗刻不容缓。
自2005年美国食品药品监督管理局批准达芬奇机器人手术系统应用于妇科以来,达芬奇手术机器人已成功应用于诸多临床外科手术中[3-4]。它是一种新型的机器人平台,可通过微创的手段实施复杂的外科手术。随着腹腔镜技术在临床治疗中的进一步推广,机器人辅助腹腔镜下子宫切除术为宫颈癌的微创治疗提供了新的选择。诸多临床实践结果表明,机器人手术具有更高的精确性及更好的临床操控性[5],且机器人辅助子宫切除术能够达到较为理想的手术治疗效果[6]。
根据2018年LACC研究显示,与微创手术相比,早期(ⅠA1~ⅠB1)伴或不伴(LSVI+)宫颈癌患者采用开腹手术具有更高的总体生存期(Overall Survival,OS)及无病生存率(Disease-free Survival,DFS),以及更低的复发率和死亡率[7]。同期另一项大数据研究结果显示,微创手术组的OS比开腹手术组更低,证实了LACC研究中微创手术与更差的肿瘤结局有关的结论[8]。
但是对于ⅠA1(LVSI+)~ⅡA1期宫颈癌患者行机器人辅助腹腔镜手术与开腹手术的肿瘤学结局如何,目前未见多中心大样本研究。为此,本回顾性研究通过比较机器人辅助腹腔镜下子宫切除术与开腹子宫切除术的临床预后指标、患者术后的复发率、死亡率以及生存率等情况,探讨机器人辅助腹腔镜手术在宫颈癌手术治疗中的优势,分层分析宫颈癌患者行机器人辅助腹腔镜手术与开腹手术的长期肿瘤学结局,并对影响癌症生存期的可能因素进行分析。
1 资料与方法
1.1 一般资料
本研究为单中心回顾性临床研究,经南昌大学第一附属医院伦理委员会审查批准,向被纳入研究的所有患者告知相关事宜并取得知情同意。选取2016年1月1日—2021年6月30日在南昌大学第一附属医院妇科接受治疗的部分早期宫颈癌患者904例为本研究对象,其中研究组为机器人手术组,共413例,患者全部行机器人辅助子宫切除术及盆腔淋巴结清扫术,并对部分患者行腹主动脉旁淋巴结取样;对照组为开腹手术组,共491例,行开腹子宫切除术及盆腔淋巴结清扫术,并对部分患者行腹主动脉旁淋巴结取样。对患者相关数据进行收集,内容包括:一般临床资料、实验室检验结果、术前病理活检结果、手术相关资料、辅助治疗相关资料(术前和术后)以及长期随访结果。其中,随访内容包括患者生存情况、复发情况等信息,并经2名受训的妇科医生对同一份病例进行整理和输入,对存疑的参数核对后重新录入并建立统一的研究数据库。
纳入标准:①患者经阴道镜下宫颈活检病理确诊为宫颈癌;②由2位妇科肿瘤专家依据2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准诊断患者疾病分期,其中选定患者的临床分期为ⅠA1(LVSI+)、ⅠA2、ⅠB1以及ⅡA1期[9];③患者接受机器人辅助腹腔镜手术以及开腹手术;④依靠B超、CT、MRI来评估肿瘤病灶的大小;⑤患者无严重合并症,无化疗及手术禁忌证;⑥患者术后的病理报告全面;⑦患者随访资料齐全,有生存结局。
1.2 手术方式、术后管理及辅助治疗
本研究选定患者的临床分期为ⅠA1(LVSI+)、ⅠA2、ⅠB1以及ⅡA1期,其中ⅠA1(LVSI+)及ⅠA2期患者行改良根治性子宫切除术及双侧盆腔淋巴结切除术,IB1及IIA1期患者行根治性子宫切除术及双侧盆腔淋巴结切除。研究组均行机器人辅助腹腔镜下子宫切除术,而对照組为传统开腹子宫切除术,两组部分患者行腹主动脉旁淋巴结取样。手术过程中,传统腹腔镜手术需采用举宫杯固定子宫,而在研究组中则使用薇乔线缝合两侧宫角对子宫进行牵引,继而避免使用举宫杯。在CO2充盈腹腔过程中,研究组与传统腹腔镜手术过程相同,而对照组则无此过程。此外,在阴道残端的处理过程中,研究组于手术开始时先行阴道封闭术(于阴道上段四周注射生理盐水,在宫颈病灶外缘3~4 cm处将注水区的阴道壁环形切开,向上分离阴道壁,游离后连续缝合阴道壁,将宫颈癌组织包埋于其中)。完成手术后,彻底止血,冲洗盆腔,留置盆腔引流管及尿管,鼓励患者尽早下床活动,术后6 h开始进食少量流质。患者是否行术后辅助治疗取决于术中发现及术后病理判断。若患者具备淋巴结转移阳性、宫旁浸润阳性、宫颈浸润阳性其中任何一个“高危因素”,则补充盆腔外照射+含铂同期化疗+近距离放疗。若具备“Sedlis标准”的中危因素(肿瘤大小、间质浸润、淋巴脉管间隙阳性)中的任一项,则补充盆腔外照射+含铂同期化疗。
1.3 观察指标
主要的观察和随访指标包括患者术后B超、CT及MRI效果、OS及DFS,并以术后第5年为肿瘤学长期结局观察的截点。通过2名资深影像学诊断医生评估患者B超、CT及MRI结果,OS定义为接受治疗日期起至任何原因导致的死亡或最后1次有效随访的时间间隔,DFS定义为接受治疗日期起至死亡/复发或最后1次有效随访的时间间隔。
1.4 统计学方法
所有数据采用SPSS 26.0统计学软件进行分析处理。计量资料用均数±标准差(x±s)表示并采用独立样本t检验进行分析,计数资料使用 χ2检验或者Fisher精确检验,采用Kaplan-Meier法进行生存分析统计并通过双侧对数秩检验进行分析,所有假设检验均以α=0.05为临界值评估数据间有无统计学差异。
2 结果
2.1 一般临床特征
早期宫颈癌患者共904例,其中研究组413例,对照组491例。研究组平均年龄(51.9±7.8) 岁,对照组平均年龄(51.5±7.3)岁。研究组肿瘤大小(11.33±10.91)mm,对照组肿瘤大小(11.20±10.77)mm。FIGO分期研究组ⅠA1期118例、ⅠA2期90例、ⅠB1期100例,ⅡA1期105例,对照组ⅠA1期123例、ⅠA2期121例、ⅠB1期121例、ⅡA1期126例。病理类型分析结果显示,鳞癌724例,其中研究组334例,对照组390例;腺癌161例,其中研究组70例,对照组91例;腺鳞癌19例,其中研究组9例,对照组10例。肿瘤分化程度比较,研究组57例G1,对照组60例G1;研究组86例G2,对照组105例G2;研究组270例G3,对照组326例G3(见表1)。
2.2 手术质量评价
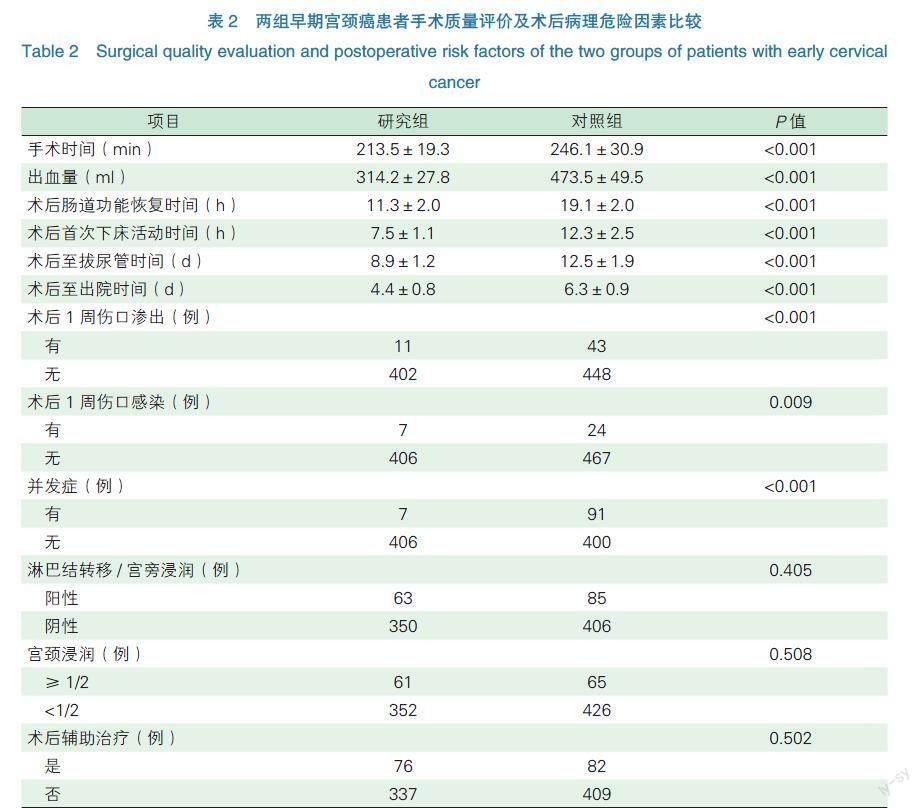
两组手术质量评价相比,研究组与对照组在手术时间、术中出血量、术后肠道功能恢复时间、术后首次下床活动时间、术后至拔尿管时间、术后至出院时间、术后1周伤口渗出以及术后1周伤口感染方面在统计学上均存在明显差异(P<0.05);在并发症的对比中,研究组与对照组之间同样存在统计学差异(P<0.05)。据术后病理结果显示,在淋巴结转移/宫旁浸润、宫颈浸润的统计中,两组比较差异无统计学意义(P>0.05)。在术后辅助治疗方面,研究组有58例因“高危因素”和18例因“中危因素”而采取术后辅助治疗,对照组有60例因“高危因素”及22例因“中危因素”而采取术后辅助治疗,两组结果比较无统计学差异(P>0.05),见表2。
2.3 影像学预后及长期随访
对纳入本研究的所有早期宫颈癌患者术后进行长期随访,并通过患者术后的CT、MRI结果对术后手术治疗效果进行评价,同时统计患者的复发时间、OS以及DFS。其中比较,研究组与对照组术后CT和MRI结果发现两组患者间预后效果相当,复发率也无明显差异。本研究总体随访时间为7~72个月。OS研究组平均为33.6个月,对照组平均为35.3个月。DFS研究组平均为32.8个月,对照组平均为34.3个月。两组OS和DFS比较,差异无统计学意义(Log-rank P>0.05),如图1。
为探究不同FIGO分期中两组患者OS以及DFS有无差异,对纳入研究的患者采用Kaplan-Meier法进行亚组分析,在对ⅠA1、ⅠA2、ⅠB1和ⅡA1期亚组患者进行分析时发现患者OS和DFS均无明显差异(Log-rank P>0.05),如图2。
此外,为比较两组患者3年生存期和5年生存期有无差异,统计2016—2018年纳入研究的全部患者,结果显示研究组患者术后3年生存率为94.57%(174/184),对照组患者术后3年生存率为94.44%(221/234)。统计2016年纳入研究的全部患者,发现研究组患者术后5年生存率为84.21%(32/38),对照组患者术后5年生存率为85.00%(51/60),如图3。
3 讨论
本研究对904例早期宫颈癌患者进行回顾性研究,其中研究组(机器人手术组,n=413)行机器人辅助子宫切除术及盆腔淋巴结清扫术,对照组(开腹手术组,n=491)行开腹子宫切除术及盆腔淋巴结清扫术。最终结果表明,研究组与对照组的一般临床特征相比,差异无统计学意义(P>0.05)。在手术质量评价的对比中,研究组的多项结果(如手术时间、出血量、术后肠道功能恢复时间、术后首次下床活动时间、术后至拔尿管时间、术后至出院时间、术后1周伤口渗出和感染以及并发症发生率等)均优于对照组。在患者术后影像学的随访中,发现研究组和对照组的CT与MRI预后效果相当,复发率也无明显差异。对纳入研究的患者进行长期随访后发现,两组总体的OS以及DFS无明显差异。对所有患者FIGO分期进行的亚组分析中,其OS及DFS亦无明显差异。此外,研究组的3年生存率及5年生存率分别为94.56%、84.21%,对照组分别为94.44%、85.00%。
在过去的几十年间,早期宫颈癌的手术方式相对没有改变,包括本研究在内的诸多文献大多参照2009年FIGO分期标准。除了沒有淋巴血管空间受累的IA1期(LVSI+)和符合保留生育能力手术的I期患者,包含盆腔淋巴结清扫术的根治性子宫切除术仍然是金标准[10-12]。而这期间最大的改变在于手术方法的转变,即微创手术被不断提倡,因此出现了许多关于腹腔镜和机器人辅助根治性子宫切除术的前瞻性/回顾性研究和Meta分析研究。与开腹根治性子宫切除术相比,微创手术的诸多术中指标如失血量、住院时间和术后并发症风险等均有减少[13-15]。
直至LACC研究及同期另一项大数据研究的结论揭开了以往手术方式的不同对预后结局影响的神秘面纱[7-8]。然而,在早期宫颈癌患者以及FIGO分期亚组生存结局的比较中,本研究的结论与上述研究的结论不同,后者的研究提示ⅠA1(LVSI+)~ⅠB1期宫颈癌患者在OS和DFS方面,腹腔镜手术均低于开腹手术。在一项国内多中心回顾性临床研究中,其研究结果与LACC研究在DFS方面的结论相似,腹腔镜手术的DFS低于开腹手术,但5年腹腔镜手术OS与开腹手术无明显差异。有文献研究证实传统腹腔镜手术是导致子宫颈癌患者复发的独立因素,深层次原因是术中未严格执行无瘤原则[16-18]。值得一提的是,本研究中针对FIGO亚组分析的结果提示,虽然两组间各亚型的OS与DFS均不存在明显统计学差异,但机器人手术组的ⅠA2期肿瘤学结局比开腹组好,这可能是由于机器人辅助手术中对肿瘤大小存在着放大效应,手术视野较好,利于肿瘤的切除。
大量研究结果表明,微创手术一直是早期宫颈癌手术治疗最受欢迎的选择,直到LACC试验结果公布[19]。根据美国的流行病学分析,与开腹根治性子宫切除术相比,微创根治性子宫切除术后的预后结果明显较差。因而欧洲妇科肿瘤学会(European Society of Gynecological Oncology,ESGO)不再推荐微创手术用于早期宫颈癌的治疗,且开腹手术是早期宫颈癌手术的金标准[20-21]。
事实上,如果患者接受微创根治性子宫切除术,临床医师需详细告知患者关于不同手术方式对预后结局影响的研究证据。然而,最新的证据和临床指南会影响临床医生做决策,但微创手术所带来的益处是不容忽视的。若一味地批判微创手术带来的预后结局的改变,而不思考和研究引起这一现象的深层原因,以至于无法确定何时应采用微创手术或微创手术时应注意哪些操作,这也是不可取的。基于此,国内也在开展诸多临床随机对照研究,以期明确两种手术方法造成生存结局存在差异的可能原因,进而用于改进微创手术操作中的细节。临床医生对腹腔镜手术造成的差异性结局有诸多思考。例如,在举宫器的使用过程中,可能会挤压肿瘤继而导致肿瘤细胞进入脉管造成播散;或由于肿瘤污染了腹腔,在CO2气腹环境刺激下导致肿瘤细胞生长能力增强。有研究显示,在腹腔镜手术中使用举宫器并不影响浸润深度、LVSI以及宫旁转移等术后病理指标,不会增加子宫内膜癌复发的风险或降低OS[22-24]。此前本团队已完成20例机器人免举宫器联合经阴道封闭肿瘤广泛性子宫切除术,并持续观察和记录该术式对患者预后结局的影响[25]。值得一提的是,Chiva L等人[26]的研究结果提示,微创手术中若不使用举宫器,患者的生存结局与开腹手术并无差异,即举宫器的使用会对微创手术的DFS产生负面影响。此外,有研究表明肿瘤体积与微创手术的预后结局之间存在关系。肿瘤尺寸越大,肿瘤传播的风险就越高,尤其是在不采用上述预防措施的情况下[27-28]。而且,在CO2气腹环境刺激下,宫颈癌细胞增殖能力在短暂抑制后会显著增强,气腹导致的腹膜特殊性损伤有利于肿瘤细胞在腹膜中特异性生长,其侵袭、迁移以及粘附能力会减弱,同时在CO2气腹环境下行机器人手术在体内切开阴道是导致阴道切缘阳性、腹腔内肿瘤细胞播散的高危因素[29-31]。此外,该研究还表明,阴道切开前使用保护措施可有效避免肿瘤暴露继而改善患者的DFS。在本研究中,研究组未使用举宫杯,从而避免了举宫杯对患者预后生存结局造成的影响,同时研究组对阴道残端的处理也严格遵循无瘤原則,避免了肿瘤细胞扩散至腹腔的可能。而对于CO2气腹环境对肿瘤生存结局的影响,本研究对该观点持保留态度。首先,体外实验证实宫颈癌HeLa细胞经过CO2气腹环境刺激后增殖能力在短暂抑制后增强,但相较于宫颈癌细胞的生长周期而言,在手术过程中几个小时的生长不足以对肿瘤宏观大小产生较大影响。其次,在气腹作用下的癌细胞侵袭、迁移能力会表现出一定程度的减弱,也利于术中对肿瘤组织的清除[32]。
因此,微创手术仍被认为是一种安全且有效的方法,适用于保留生育能力以及手术环境符合前哨淋巴结(Sentinel Lymph Node,SLN)映射的患者。对于已经接受宫颈锥切需要进行根治性子宫切除术的患者以及采用预防性手术操作时肿瘤大小< 2 cm的患者,可以考虑进行微创手术。在此期间,必须告知这些患者关于支持这种手术方式的相关研究结论,这也是本次研究所探求的意义。
我国自20世纪以来,经历了腹腔镜的使用热潮,这导致许多医院临床医生开腹手术技能的“荒废”,重新选择开腹手术有一定的现实难度,而且短期内完全放弃微创宫颈癌手术并不现实,因而在术中通过改良术式避免使用举宫器以及闭合离断阴道等措施可为患者带来生存益处。在腹腔镜技术上应用达芬奇机器人手术系统,有利于患者术后盆底功能的恢复和盆腔淋巴结的清扫[33-34]。值得注意的是,随着患者对手术微创化的重视,机器人手术系统的出现为微创手术带来了新的选择,但仍需开展更多前瞻性、大样本、临床多中心的随机对照实验进一步证实其在宫颈癌手术中的应用价值。
参考文献
[1] Pimple S A, Mishra G A. Global strategies for cervical cancer prevention and screening [J]. Minerva Ginecol, 2019, 71(4): 313-320.
[2] Buskwofie A, David-West G, Clare C A. A review of cervical cancer: incidence and disparities [J]. J Natl Med Assoc, 2020, 112(2): 229-232.
[3] Hill E K. Updates in cervical cancer treatment [J]. Clin Obstet Gynecol, 2020, 63(1): 3-11.
[4] Gadducci A, Cosio S. Neoadjuvant chemotherapy in locally advanced cervical cancer: review of the literature and perspectives of clinical research [J]. Anticancer Res, 2020, 40(9): 4819-4828.
[5] 温晓春, 蔡丽萍, 涂春华, 等. 达芬奇机器人手术系统在妇科肿瘤手术中的应用 [J]. 南昌大学学报(医学版) , 2016, 56(6): 60-62.
[6] CAO L, XU H, CHEN Y, et al. A detailed analysis of the learning curve: da vinci robot-assisted radical hysterectomy in cervical cancer [J]. J Minim Invasive Gynecol, 2015, 22(6S): S228-S229.
[7] Ramirez P T, Frumovitz M, Pareja R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer [J]. N Engl J Med, 2018, 379(20): 1895-1904.
[8] Melamed A, Margul D J, Chen L, et al. Survival after minimally invasive radical hysterectomy for early-stage cervical cancer [J]. N Engl J Med, 2018, 379(20): 1905-1914.
[9] Pecorelli S, Zigliani L, Odicino F. Revised FIGO staging for carcinoma of the cervix[J]. Int J Gynaecol Obstet, 2009, 105(2): 107-108.
[10] Bhatla N, Aoki D, Sharma D N, et al. Cancer of the cervix uteri [J]. Int J Gynaecol Obstet, 2018, 143(Suppl 2): 22-36.
[11] Cibula D, P?tter R, Planchamp F, et al. The European society of gynaecological oncology/European society for radiotherapy and oncology/European society of pathology guidelines for the management of patients with cervical cancer [J]. Int J Gynecol Cancer, 2018, 28(4): 641-655.
[12] Koh W J, Abu-Rustum N R, Bean S, et al. Cervical Cancer, Version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(1): 64-84.
[13] Park D A, Yun J E, Kim S W, et al. Surgical and clinical safety and effectiveness of robot-assisted laparoscopic hysterectomy compared to conventional laparoscopy and laparotomy for cervical cancer: a systematic review and meta-analysis[J]. Eur J Surg Oncol, 2017, 43(6): 994-1002.
[14] Diver E, Hinchcliff E, Gockley A, et al. Minimally invasive radical hysterectomy for cervical cancer is associated with reduced morbidity and similar survival outcomes compared with laparotomy[J]. J Minim Invasive Gynecol, 2017, 24(3): 402-406.
[15] Corrado G, Vizza E, Legge F, et al. Comparison of different surgical approaches for stage IB1 cervical cancer patients: a multi-institution study and a review of the literature [J]. Int J Gynecol Cancer, 2018, 28(5): 1020-1028.
[16] 陳春林, 黎志强, 孙立新, 等. IA1(LVSI+)~IB2期子宫颈癌腹腔镜与开腹手术长期肿瘤学结局真实世界研究 [J]. 中国实用妇科与产科杂志, 2020, 36(6): 536-543.
[17] 刘开江, 赵绚璇. 腹腔镜恶性肿瘤手术中无瘤技术的应用[J]. 中华腔镜外科杂志(电子版), 2018, 11(1): 17-19.
[18] 陈春林, 郎景和. 中国专家“关于宫颈癌腹腔镜手术相关问题”的几点意见[J]. 中国实用妇科与产科杂志, 2019, 35(2): 188-193.
[19] Greggi S, Casella G, Scala F, et al. Surgical management of early cervical cancer: when is laparoscopic appropriate? [J]. Curr Oncol Rep, 2020, 22(1): 7.
[20] Querleu D, Cibula D, Concin N, et al. Laparoscopic radical hysterectomy: a european society of gynaecological oncology (ESGO) statement [J]. Int J Gynecol Cancer, 2020, 30(1): 15.
[21] FIGO Gynecologic Oncology Committee. FIGO statement on minimally invasive surgery in cervical cancer [J]. Int J Gynaecol Obstet, 2020, 149(3): 264.
[22] Rakowski J A, Tran T A, Ahmad S, et al. Does a uterine manipulator affect cervical cancer pathology or identification of lymphovascular space involvement? [J]. Gynecol Oncol, 2012, 127(1): 98-101.
[23] Uccella S, Bonzini M, Malzoni M, et al. The effect of a uterine manipulator on the recurrence and mortality of endometrial cancer: a multi-centric study by the Italian society of gynecological endoscopy [J]. Am J Obstet Gynecol, 2017, 216(6): 592.e1-592.e11.
[24] Tinelli R, Cicinelli E, Tinelli A, et al. Laparoscopic treatment of early-stage endometrial cancer with and without uterine manipulator: our experience and review of literature [J]. Surg Oncol, 2016, 25(2): 98-103.
[25] 付振华, 张智, 蔡丽萍, 等. 早期子宫颈癌行机器人手术系统免举宫器联合经阴道封闭肿瘤广泛性子宫切除术20例分析 [J]. 中国实用妇科与产科杂志, 2020, 36(9): 863-865.
[26] Chiva L, Zanagnolo V, Querleu D, et al. SUCCOR study: an international European cohort observational study comparing minimally invasive surgery versus open abdominal radical hysterectomy in patients with stage IB1 cervical cancer [J]. Int J Gynecol Cancer, 2020, 30(9): 1269-1277.
[27] Kohler C, Hertel H, Herrmann J, et al. Laparoscopic radical hysterectomy with transvaginal closure of vaginal cuff-a multicenter analysis [J]. Int J Gynecol Cancer, 2019, 29(5): 845-850.
[28] Kanao H, Matsuo K, Aoki Y, et al. Feasibility and outcome of total laparoscopic radical hysterectomy with no-look no-touch technique for FIGO IB1 cervical cancer [J]. J Gynecol Oncol, 2019, 30: e71.
[29] Kong T W, Chang S J, Piao X, et al. Patterns of recurrence and survival after abdominal versus laparoscopic/robotic radical hysterectomy in patients with early cervical cancer [J]. J Obstet Gynaecol Res, 2016, 42(1): 77-86.
[30] Volz J, K?ster S, Spacek Z, et al. The influence of pneumoperitoneum used in laparoscopic surgery on an intraabdominal tumor growth [J]. Cancer, 1999, 86(5): 770-774.
[31] Lin F, Pan L H, Li L, et al. Effects of a simulated CO2 pneumoperitoneum environment on the proliferation, apoptosis, and metastasis of cervical cancer cells in vitro [J]. Med Sci Monit, 2014. DOI: 10.12659/msm.891179.
[32] 向陽, 蒋芳. 宫颈癌腹腔镜手术的争议及策略[J]. 中国实用妇科与产科杂志, 2019, 35(10): 1112-1116.
[33] 齐金红, 袁勇, 冯文娟, 等. 达芬奇机器人在妇科手术应用中的安全性评价[J]. 机器人外科学杂志(中英文), 2021, 2(2): 111-122.
[34] 郎驿天, 吴斌, 王育. 达芬奇机器人用于妇科手术的技术评价 [J]. 机器人外科学杂志(中英文), 2021, 2(2): 100-110.
