单宁酸对丝素蛋白二级结构的影响作用研究
2023-06-19李炜祥凌静王详吕汪洋孔祥东
李炜祥 凌静 王详 吕汪洋 孔祥东


摘要: 蛋白质的二级结构是其发挥生物功能的重要基础结构,因此本文通过单宁酸和丝素蛋白反应,研究不同摩尔浓度的单宁酸对丝素蛋白二级结构的影响。使用紫外可见光吸收光谱(UV-Vis)、荧光发射光谱(FL)和傅里叶红外吸收光谱(FTIR)等表征技术对单宁酸与丝素蛋白的反应产物进行测试,结果表明单宁酸可以影响丝素蛋白的二级构象,并呈现一定的变化趋势。单宁酸摩尔浓度逐渐增加到20 μmol/L时,α螺旋和无规卷曲结构逐渐增多,β折叠结构逐渐减少。单宁酸摩尔浓度继续上升,α螺旋和无规卷曲结构逐渐减少,β折叠结构逐渐增多。
关键词: 丝素蛋白;单宁酸;二级结构;氨基酸残基;紫外可见光吸收光谱;荧光发射光谱;傅里叶红外吸收光谱
中图分类号: TS102.33
文献标志码: A
家蚕丝的主要成分是丝素蛋白和丝胶蛋白,其中丝素蛋白由甘氨酸、丙氨酸、丝氨酸等18种氨基酸组成,约占蚕丝质量的70%~80%。丝素蛋白具有良好的生物相容性,在仿生纤维、外科缝合线、生物组织工程支架、药物输送等领域有广泛的应用前景。研究证实,丝素蛋白的二级结构可受到金属离子[4]、盐类、溶液pH及有机醇[6]等理化因子的影响[7]。董文秀等[8]使用Ca2+与丝素蛋白溶液反应,通过光谱法研究钙离子对丝素蛋白溶解过程中结构的影响,结果表明在丝素蛋白溶解过程中,Ca2+可与丝素蛋白分子中的氨基酸侧链羟基进行配位从而形成螯合物并影响丝素的分子构象。
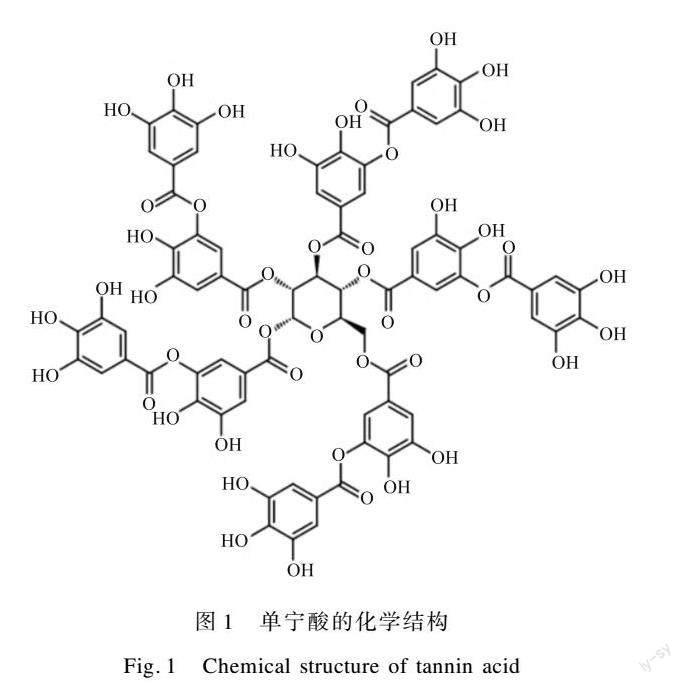
单宁酸是从中药五倍子中提取的天然植物多酚,对蛋白质有特殊的亲和力,可将动物皮“鞣制”成皮革,具有独特的生物化学性质。如图1[9]所示,单宁酸富含羟基,而羟基与蛋白质具有较强的结合能力,导致单宁酸可影响蛋白质构象[10]。Yang等[11]利用单宁酸形成的膜成功调控抗血小板黏附性,表明单宁酸可与特定蛋白发生反应,并改变其结构。Wang等[12]使用单宁酸对蒙脱土进行表面改性,改善了蒙脱土纳米片和大豆分离蛋白基体的界面结合力,结果证明单宁酸可于蛋白表面影响其界面结合力。马祥英等[13]研究表明单宁酸可与尿素分子结合形成网络结构,且单宁酸的摩尔浓度对其和有机分子的反应十分重要。Ali等[14]研究了单宁酸与α-2巨球蛋白的相互作用,结果表明单宁酸可诱导α-2巨球蛋白的二级结构发生变化,导致其蛋白酶抑制活性的丧失,这一结果进而表明单宁酸与蛋白质的反应能够改变蛋白质的二级结构。以上研究证明,单宁酸在与蛋白质反应和影响蛋白质结构调控方面有一定优势,对本文研究具有理论借鉴意义。
本文使用UV-Vis、FL、FTIR等表征手段,研究了不同摩尔浓度的单宁酸与丝素蛋白的反应过程,通过紫外光谱、荧光光谱和红外光谱等表征蛋白吸收峰(或发射峰)强度及位置变化,分析总结单宁酸对丝素蛋白二级结构变化的影响作用。
1 试 验
1.1 试 剂
无水氯化钙、氢氧化钠、单宁酸、碳酸钠均为分析纯(美国Sigma公司),试验用水为去离子水(市售)。
1.2 方 法
1.2.1 蚕丝脱胶和丝素蛋白的提取
生丝的来源会影响丝素的质量[15],本试验选取人工养殖的桑蚕丝。将家蚕蚕茧放入0.5%的Na2CO3溶液中煮沸30 min用以脱去丝胶;将脱胶后得到的丝素用去离子水清洗,之后80 ℃烘干;然后在质量分数为42%的沸腾CaCl2溶液中溶解10 min;将所得溶液在4 ℃的去离子水中透析3 d,去除盐分;最后将得到的溶液浓缩、离心,4 ℃保存。
1.2.2 單宁酸与丝素蛋白溶液的反应
取一定体积丝素蛋白溶液并将其稀释至2 mg/mL,体积10 mL,保证溶质稀释前后不变,均为20 mg。取出一部分80 μmol/L单宁酸溶液,稀释至60、40、20 μmol/L,体积均为10 mL。向丝素蛋白溶液内缓慢滴加单宁酸溶液,以500 r/min的速度搅拌30 min。此时丝素蛋白质量浓度为1 mg/mL,单宁酸摩尔浓度分别为40、30、20、10 μmol/L。此外,向10 mL的2 mg/mL丝素蛋白溶液加入10 mL去离子水,作为空白对照。反应完成后将反应溶液置于50 mL离心管内,进行冷冻干燥后备用。
1.2.3 紫外可见吸收光谱分析(UV-Vis)
通过UV-2450紫外可见分光光度计(日本岛津公司)进行测试,依次准确移取1.500、1.125、0.750、0.375 mL的80 μmol/L单宁酸溶液和1.500 mL的1 mg/mL丝素蛋白溶液,并加入3 mL比色皿中。使用移液枪吹匀后静置4 min,然后立即进行UV-Vis测试。测量环境恒温恒湿,温度为25 ℃,相对湿度为60%,测试紫外线光波长范围为200~300 nm。
1.2.4 荧光发射光谱分析(FL)
使用F-4500型荧光光度计(日本日立公司)测试样品的荧光光谱,依次准确移取1.500、1.125、0.750、0.375 mL的60 μmol/L的4组单宁酸溶液和1.500的1 mg/mL丝素蛋白溶液至3 mL比色皿。剩余体积用去离子水补充,吹匀后静置4 min,以295 nm为激发波长,激发和发射狭缝均为5 nm,扫描体系在325~400 nm处的荧光光谱。测量环境恒温恒湿,温度为25 ℃,相对湿度为60%。
1.2.5 红外吸收光谱分析(FTIR)
采用iS50傅里叶红外光谱仪(广州尼高力科学仪器有限公司)测试样品的红外光谱,分辨率为4 cm-1,波数为4 000~400 cm-1,扫描次数为64次。将样品研磨成粉末,并与KBr粉末混合压片后进行扫描。测量环境恒温恒湿,温度为25 ℃,相对湿度为60%。
2 结果与分析
2.1 单宁酸与丝素蛋白反应的紫外可见吸收光谱结果
图2为不同含量单宁酸改性的丝素蛋白反应溶液及10 μmol/L单宁酸溶液的紫外吸收光谱图。如图2(a)所示,所有样品均在230 nm处出现强吸收峰,代表丝素蛋白多肽碳骨架中CO的n-Π*位移。此外,峰强度随着单宁酸摩尔浓度的增加而逐渐降低,这是因为单宁酸含有的羟基和丝素蛋白互相结合,影响了多肽碳骨架对紫外光的吸收。样品在276 nm处的弱吸收峰代表色氨酸对紫外光的吸收,是丝素蛋白分子中芳杂环的Π-Π*和n-Π*跃迁引起的[16],其吸收峰的强度随着单宁酸摩尔浓度的上升而下降,这是因为色氨酸与单宁酸的结合削弱了色氨酸对紫外光的吸收。吸收峰出现红移现象,这是由于溶液内单宁酸摩尔浓度的上升使丝素蛋白色氨酸周围微环境的极性增强[17]。皋玉婷等[18]采用UV-2450紫外可见分光光度计对不同摩尔浓度的单宁酸进行表征,结果表明不同摩尔浓度单宁酸的吸光度变化局限在很小的范围内。图2(b)表明,在10 μmol/L摩尔浓度下,单宁酸对紫外光的吸光度几乎没有变化。
2.2 单宁酸与丝素蛋白反应的荧光发射光谱结果
丝素蛋白分子内能发射荧光的氨基酸主要是带有苯环的苯丙氨酸、色氨酸及酪氨酸,其中295 nm的激发光主要反映色氨酸残基对荧光的吸收情况,其发射波长为352 nm[19]。图3为不同含量单宁酸改性的丝素蛋白反应溶液及10 μmol/L单宁酸溶液的荧光发射光谱图。在未滴加单宁酸时的纯水环境中,丝素蛋白在352 nm处显示了色氨酸残基的发射峰。随单宁酸摩尔浓度的增加,发射峰强度逐渐下降。图3中两处发射峰位置红移,表明丝素蛋白所处微环境的极性随单宁酸摩尔浓度上升而逐渐增加,溶液中丝素蛋白分子的亲水性提高。图3(b)表明,10 μmol/L单宁酸荧光发射强度很低,且其变化幅度很小[20]。
2.3 单宁酸与丝素蛋白反应的红外吸收光谱结果
FTIR是表征蛋白质二级结构及其转变过程的重要手段。蛋白质的构象涉及α螺旋、β折叠及无规卷曲结构,其中α螺旋结构可诱导丝素蛋白分子链内氢键的生成,而β折叠结构能促进分子间氢键的生成。因此,可以认为丝素蛋白的二级结构与其分子内外不同氢键的数量紧密关联[21]。
图4为不同含量单宁酸改性丝素蛋白样品的红外光谱图。随着单宁酸摩尔浓度的上升,单宁酸丝素蛋白反应体系的吸收峰呈现一定的变化规律。单宁酸摩尔浓度从0 μmol/L增加到20 μmol/L时,吸收峰持续增强;单宁酸摩尔浓度继续升高,吸收峰逐渐減弱,表明在反应溶液中,单宁酸对1 mg/mL丝素蛋白红外吸收的影响明显,并在单宁酸摩尔浓度为20 μmol/L时影响最大,此时丝素蛋白的红外吸收峰强度达到极大值。3 421 cm-1处的吸收峰来自产物的—OH、N—H振动和—OH伸缩振动。单宁酸摩尔浓度从0 μmol/L上升到20 μmol/L,溶液内—OH增多,之后单宁酸摩尔浓度继续上升,形成分子间氢键消耗—OH的数量多于加入单宁酸含有—OH的数量,β折叠结构增多,所以在红外光谱图中相应位置呈现出吸收峰减弱的趋势。2 983 cm-1处的峰逐渐增强,2 923、2 853 cm-1处的峰逐渐减弱是因为丝素蛋白C—H伸缩振动受到了单宁酸的影响[22]。
图5为0~30 μmol/L单宁酸和1 mg/mL丝素蛋白反应样品在1 800~400 cm-1的红外吸收光谱图。表1是蛋白质不同二级结构在红外光谱酰胺Ⅰ区、酰胺Ⅱ区、酰胺Ⅲ区的经验值。在酰胺Ⅰ区,1 654 cm-1处的吸收峰代表α螺旋结构。当单宁酸摩尔浓度为0~20 μmol/L,溶液中离子的摩尔浓度持续增大,该峰的强度持续增加;随着单宁酸摩尔浓度继续上升,酰胺Ⅰ区吸收峰强度减弱。这表明反应溶液中,加入单宁酸使溶液中丝素蛋白分子间氢键发生断裂,溶液内离子摩尔浓度增大,α螺旋结构的变化趋势为先增加后减少,吸收峰强度明显受到单宁酸加入量的影响。在酰胺Ⅱ区,1 535 cm-1处出现的宽峰代表无规卷曲结构,该结构随单宁酸的加入呈现出先小幅度的增强后略微减弱的趋势。在酰胺Ⅲ区,1 242 cm-1位置出现的峰代表α螺旋结构。从上述分析可知,受单宁酸加入量的影响,溶液内α螺旋和无规卷曲构象的摩尔浓度都是先增多后减少。878 cm-1处的吸收峰来自溶液内丝素蛋白氨基酸残基的苯环结构,单宁酸摩尔浓度在0~20 μmol/L内,878 cm-1处的吸收峰逐渐增强,α螺旋结构增多。这是因为氨基酸残基的苯环空间位阻大,较难整合到α螺旋结构内,因而暴露在丝素蛋白分子外侧。
综上分析可知,随着单宁酸摩尔浓度的提高,丝素蛋白的α螺旋结构的摩尔浓度随单宁酸加入量的增多,呈现先增多后减少的规律;丝素蛋白无规卷曲结构的变化趋势与α螺旋类似,但幅度较小。据此推测,20 μmol/L的单宁酸对丝素蛋白溶液的二级结构影响最为显著,此时丝素蛋白几乎不含β折叠结构,丝素蛋白溶液的二级结构转变最为明显。
3 结 论
本文通过单宁酸与丝素蛋白溶液反应,研究不同摩尔浓度的单宁酸对丝素蛋白二级结构的影响。通过UV-Vis、FL和FTIR等光谱表征手段,研究单宁酸与丝素蛋白反应后丝素蛋白二级结构的变化。研究表明,单宁酸可影响丝素蛋白的二级结构,并呈现一定的变化趋势。单宁酸的加入破坏了丝素分子的分子间氢键,单宁酸自身会电离出部分H+,使溶液中离子摩尔浓度增大。随着丝素蛋白溶液中单宁酸摩尔浓度的增大,其与丝素蛋白多肽碳骨架和色氨酸残基结合形成氢键,削弱了反应溶液在230 nm和276 nm处的紫外吸收和在352 nm处的荧光发射,并出现紫外吸收峰和荧光射峰位置的轻微红移现象,表明反应溶液中丝素蛋白所处微环境的极性逐渐增强。根据红外光谱分析结果,单宁酸摩尔浓度增大到20 μmol/L时,α螺旋和无规卷曲结构摩尔浓度逐渐增多,β折叠结构摩尔浓度逐渐减少。单宁酸摩尔浓度继续增大,α螺旋和无规卷曲结构摩尔浓度逐渐减少,β折叠结构摩尔浓度逐渐增多。本试验对扩展丝素蛋白二级结构的研究和单宁酸处理对丝素蛋白结构的影响作用具有一定的借鉴意义。
《丝绸》官网下载
中国知网下载
参考文献:
[1]QIU Z Y, CUI Y, TAO C S, et al. Mineralized collagen: Rationale, current status, and clinical applications[J]. Materials (Basel), 2015, 8(8): 4733-4750.
[2]ZHANG H J, YOU R, YAN K, et al. Silk as templates for hydroxyapatite biomineralization: A comparative study of bombyx mori and antheraea pernyi silkworm silks[J]. International Journal of Biology Macromolecules, 2020, 164: 2842-2850.
[3]赵新飞, 宋立新, 熊杰. 丝素蛋白/聚己内酯共混复合纳米纤维拉伸性能研究[J]. 现代纺织技术, 2017, 25(2): 1-5.
ZHAO Xinfei, SONG Lixin, XIONG Jie. Study on tensile property of silk fibroin/polyca prolactone blend composite nanofibers[J]. Advanced Textile Technology, 2017, 25(2): 1-5.
[4]DING H C, PAN H H, XU X R, et al. Toward a detailed understanding of magnesium ions on hydroxyapatite crystallization inhibition[J]. Crystal Growth & Design, 2014, 14(2): 763-769.
[5]DAI L, QI Y P, NIU L N, et al. Inorganic-organic nanocomposite assembly using collagen as a template and sodium tripolyphosphate as a biomimetic analog of matrix phosphoprotein[J]. Crystal Growth & Design, 2011, 11(8): 3504-3511.
[6]PUERTA M, ARANGO M C, JARAMILLO-QUICENO N, et al. Influence of ethanol post-treatments on the properties of silk protein materials[J]. SN Applied Sciences, 2019, 1(11): 1443-1449.
[7]WU L P, SHAO H, ZHAO Y C, et al. Mechanism and effects of polyphenol derivatives for modifying collagen[J]. ACS Biomateerials Science & Engineering, 2019, 5(9): 4272-4284.
[8]董文秀, 李軍生, 李秋杰, 等. 光谱法研究钙离子对丝素蛋白溶解过程中结构的影响[J]. 分析测试学报, 2014, 33(12): 1410-1415.
DONG Wenxiu, LI Junsheng, LI Qiujie, et al. Influence of Ca2+ on silk fibroin structure in the process of dissolution by optical spectroscopy[J]. Journal of Instrumental Analysis, 2014, 33(12): 1410-1415.
[9]LABIENIEC M, GABRYELAK T. Interactions of tannic acid and its derivatives (ellagic and gallic acid) with calf thymus DNA and bovine serum albumin using spectroscopic method[J]. Journal of Photochemistry and Photobiology B-Biology, 2006, 82(1): 72-78.
[10]周秋华, 王彦卿, 张红梅, 等. 单宁酸与牛血红蛋白相互作用的光谱研究[J]. 化学研究与应用, 2008, 20(7): 816-820.
ZHOU Qiuhua, WANG Yanqing, ZHANG Hongmei, et al. Spectroscopic studies of interaction between tannic acid and bovine hemoglobin[J]. Chemical Research and Application, 2008, 20(7): 816-820.
[11]YANG L W, HAN L L, LIU Q, et al. Galloyl groups-regulated fibrinogen conformation: Understanding antiplatelet adhesion on tannic acid coating[J]. Acta Biomaterialia, 2017, 64: 187-199.
[12]WANG Z, KANG H J, ZHANG W, et al. Improvement of interfacial interactions using natural polyphenol-inspired tannic acid-coated nanoclay enhancement of soy protein isolate biofilms[J]. Applied Surface Science, 2017, 401: 271-282.
[13]馬祥英, 廖艳娟, 覃方红, 等. 碳自掺杂g-C3N4光催化性能的原位光微量热荧光光谱研究[J]. 高等学校化学学报, 2020, 41(11): 2526-2537.
MA Xiangying, LIAO Yanjuan, QIN Fanghong, et al. Study on the photocatalytic performance of carbon doped g-C3N4 based on in situ photomicrocarimeter-flurescence spectrometry[J]. Chemical Journal of Chinese Universities, 2020, 41(11): 2526-2537.
[14]ALI S S, ZIA M K, SIDDIQUI T, et al. Binding interaction of sheep alpha-2-macroglobulin and tannic acid: A spectroscopic and thermodynamic study[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 204: 748-753.
[15]姚国萍, 郑今欢. 生丝浸泡工艺对蚕丝脱胶及染色匀染性的影响[J]. 现代纺织技术, 2011, 19(2): 4-7.
YAO Guoping, ZHENG Jinhuan. Effect of raw silk soaking process on degumming and dye uniformity of the silk[J]. Advanced Textile Technology, 2011, 19(2): 4-7.
[16]张方圆, 倪永年. 日落黄和β-胡萝卜素与牛血清白蛋白相互作用的对比研究[J]. 化学学报, 2012, 70(12): 1379-1384.
ZHANG Fangyuan, NI Yongnian. A comparison study on the interaction of Sunset Yellow and β-Carotene with bovine serum albumin[J]. Acta Chimica Sinica, 2012, 70(12): 1379-1384.
[17]皋玉婷, 陈芮, 陈燕. 纳米金的合成与表征[J]. 云南师范大学学报(自然科学版), 2016, 36(6): 46-49.
GAO Yuting, CHEN Rui, CHEN Yan. Synthesis and characterization of gold naso-sol[J]. Journal of Yunnan Normal University (Natural Sciences Edition), 2016, 36(6): 46-49.
[18]马林, 何维仁, 黄爱民, 等. 丝素蛋白在甲醇水混合溶剂中构象变化的光谱学研究[J]. 光谱学与光谱分析, 2010, 30(11): 3047-3051.
MA Lin, HE Weiren, HUANG Aimin, et al. Spectroscopic study on the conformational change of silk fibroin in methanol-water mixtures[J]. Spectroscopy and Spectral Analysis, 2010, 30(11): 3047-3051.
[19]姚林锋, 何强. 单宁酸与胰 α-淀粉酶作用特性研究[J]. 食品工业科技, 2014, 35(3): 63-66.
YAO Linfeng, HE Qiang. Interaction between tannic acid and pancreatic α-amylase[J]. Science and Technology of Food Industry, 2014, 35(3): 63-66.
[20]范金波, 周素珍, 闫泳, 等. 分子对接结合荧光光谱法探究单宁酸与血清蛋白结合的pH依赖性[J]. 中国食品学报, 2021, 21(10): 23-33.
FAN Jinbo, ZHOU Suzhen, YAN Yong, et al. PH dependence of building of tannic acid to serum protein by molecular docking and fluorescence spectroscopy[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(10): 23-33.
[21]MCGILL M, HOLLAND P G, HOLLAND L D. Experimental methods for characterizing the secondary structure and thermal properties of silk proteins[J]. Macromolecular Rapid Communications, 2019, 40(1): 1-14.
[22]PRECUPAS A, LEONTIES A R, NEACSU A, et al. Gallic acid influence on bovine serum albumin thermal stability[J]. New Journal of Chemistry, 2019(9): 1-9.
Abstract: The secondary structure of proteins is an important basic structure for their biological functions. Studies have shown that the changes of secondary structure in proteins affect their biological reactions to the outside environment, and the spectrum of proteins can reflect their secondary structure changes to a certain extent.
Silk fibroin, widely used in scientific research and social life, is an ideal research object. To study the cause and process of secondary structure transformation of silk fibroin, we carried out experiments to explore the effect of tannic acid on the secondary structure of silk fibroin through the reaction between different concentrations of tannic acid and silk fibroin. The reaction of tannic acid and silk fibroin was studied by UV-visible absorption spectrum (UV-Vis), fluorescence emission spectroscopy (FL) and fourier infrared absorption spectroscopy (FTIR), showing that the tannic acid and silk fibroin could be chemically bonded.
The UV absorption spectra of the reaction solution of 0-40 μmol/L tannic acid and 1 mg/mL silk fibroin solution, and of the 10 μmol/L tannic acid solution show that the n-Π* displacement of carbon skeleton CO of silk fibroin polypeptide leads to a strong absorption peak at 230 nm whose intensity decreases gradually with the combination of tannic acid hydroxyl group and silk fibroin. The weak absorption peak at 276 nm represents that the Π-Π* and n-Π* transitions of aromatic heterocyclic rings in the silk fibroin molecule are weakened by the binding between tryptophan and tannic acid. The redshifts of the two absorption peaks indicate that the polarity of the microenvironment around tryptophan in silk fibroin is strengthened with the increase of tannic acid concentration in the solution.
It is found from the fluorescence emission spectra of the reaction solution of 0-40 μmol/L tannic acid and 1 mg/mL silk fibroin, and of the 10 μmol/L tannic acid solution that the emission peak intensity of tryptophan residues at 352 nm gradually decreases with the increase of tannic acid concentration. Because of chemical bonding reaction between tannic acid and silk fibroin, the polarity of the microenvironment in which silk fibroin is located gradually strengthens with the increase of tannic acid concentration, and the hydrophilicity of silk fibroin molecules increases, causing the redshift of the emission peak position.
According to the infrared spectra of the reaction solution of 0-30 μmol/L tannic acid and 1 mg/mL silk fibroin, it is found that the absorption peak of tannic acid-silk fibroin reaction system heightens first and then lowers with the increase of tannic acid concentration. Based on the empirical values of different secondary structures in the amide Ⅰ, amide Ⅱ and amide Ⅲ regions of the infrared spectra, it is inferred that the α helix structure of silk fibroin protein first increases and then decreases with the increase of tannic acid concentration. The random coil structure changes in a similar way, but its amplitude is small. We can speculate that 20 μmol/L tannic acid reacts with silk fibroin completely, and there is almost no β folding structure in silk fibroin solution, indicating that the secondary structure in silk fibroin solution is almost totally transformed.
This study shows that tannic acid has significant chemical bonding reaction with silk fibroin. With the increase of tannic acid concentration, the polarity of the microenvironment of silk fibroin in the reaction solution gradually strengthens. The binding of silk fibroin polypeptide carbon skeleton and tryptophan residue weakens the UV absorption at 230 nm and 276 nm and the fluorescence emission at 352 nm. When tannic acid concentration increases from 0 μmol/L to 20 μmol/L, the α helix and random coil structure gradually increase, while the β folding structure gradually decreases. And then, with the increase of tannic acid concentration, the amount of α helix and random coil structure gradually decreases, and that of β fold structure gradually increases.
In this experiment, tannic acid is used to react with silk fibroin protein in a pioneering way to study the changes of UV-visible absorption spectra, fluorescence emission spectra and Fourier infrared absorption spectra of the reaction solution. Innovative conclusions are obtained, which have certain reference significance for the future expansion of the study of the structure of silk fibroin protein and the in-depth exploration of tannic acid treated protein.
Key words: silk fibroin protein; tannic acid; secondary structure; amino acid residue; UV-visible absorption spectrum; fluorescence emission spectroscopy; fourier infrared absorption spectroscopy
