扎那米韦粉雾剂的研制
2023-06-18黄乐冉杨建龙张成龙吴恒坤岳勇铭王志城常芷健李剑男
薛 涛,黄乐冉,杨建龙,张成龙,吴恒坤,岳勇铭,王志城,常芷健,李剑男*
(1.神威药业(四川)有限公司品质部,四川邛崃 611530;2.长春中医药大学药学院,吉林长春 130117;3.长春市食品药品检验中心,吉林长春 130000)
0 引言
流感病毒表面的神经氨酸酶是一种拥有酶活性的表面蛋白,又称为唾液酸酶,是存在于流感病毒复制中的关键酶.神经氨酸酶作用于唾液酸,唾液酸末端、N-乙酰基神经氨酸和相邻糖基间的酮苷连接桥被神经氨酸酶催化裂解,使新生成的病毒与已经感染的细胞分离,促进了生成的病毒颗粒的释放和传播.
扎那米韦(Zanamivir)是一种有效的流感病毒唾液酸抑制剂,与唾液酸相似,可以和神经氨酸酶的活性部位进行结合,抑制其活性,阻止病毒颗粒的复制和释放.因而其可以有效减轻或缓解流感的症状,可用于流感的预防和治疗[1-3].扎那米韦分子的极性强,水溶性好,组织渗透能力差,口服生物利用度低,只有2%.因而目前多采用肺部给药途径.
扎那米韦吸入粉雾剂(商品名:Relenza)由葛兰素史克公司于1999年在澳大利亚上市,是一种内容物为白色或类白色粉末的硬胶囊,活性成分为扎那米韦,用于流感的预防和治疗,规格为5 mg,粉雾剂的载体为一水乳糖,用量为20 mg/泡囊.包装药品的容器密封系统为置于纸盒中的铝塑泡罩包装(聚氯乙烯固体药用硬片/药品包装用铝箔),铝塑板外面罩一层复合袋[1‾3].目前,国内上市的扎那米韦粉雾剂是由葛兰素史克公司生产的原研进口产品和先声药业生产的仿制药.
本项目以原研制剂作为参比,对Relenza进行仿制研究,以期扩大患者的用药选择,并拟进一步降低该产品的市场价格.
1 材料
1.1 仪器
STP-10AVP高效液相色谱仪(浙江大学N2000色谱工作站,日本岛津),KQ2200超声提取器(佛山市超声仪器有限公司),GZX-9000数显鼓风干燥箱(常州市星干干燥设备有限公司),DK-S26电热恒温水浴锅(上海化工机械制造总厂),MQP-100扁平气流粉碎机(无锡新而立机械设备有限公司),AR11401C万分之一天平(奥豪斯公司),α1860紫外可见分光光度计(上海谱元仪器有限公司),BTX-IIX射线衍射仪(苏州巴斯德仪器有限公司).
1.2 药材与试剂
扎那米韦(自制,20210701);乳糖(德国美剂乐公司,20210606);乙腈,甲醇(Sigma公司);市售娃哈哈纯净水(娃哈哈公司).
2 实验研究
2.1 处方筛选
2.1.1 原料药基本信息
扎那米韦化学名是5-乙酰氨基-4-[(氨基亚氨基甲基)-氨基]-2,6-脱水-3,4,5-三去氧-D-丙三醇基-D-半乳糖-2-烯醇酸,结构式见图1,分子式为C12H20N4O7,分子量为332.3,本品为白色或类白色结晶性粉末,在水中略溶,在甲醇或丙酮中几乎不溶.
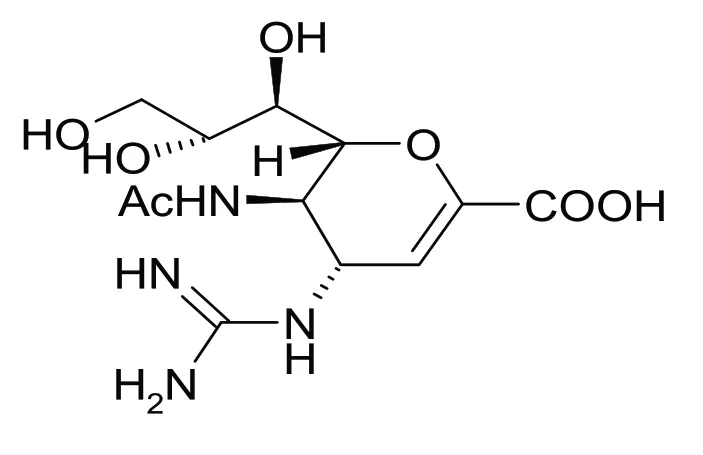
图1 扎那米韦结构式

图2 扎那米韦吸入粉雾剂上市品

图3 吸入装置—Dwaskhaler

图4 扎那米韦吸入粉雾剂上市品显微镜照片(100倍)(比例尺:100 μm)
图5 扎那米韦吸入粉雾剂上市品显微镜照片(400倍)(比例尺:5 μm)
2.1.2 原研品研究
取上市品适量,平铺于载玻片上,用光学显微镜在相应放大倍数下观察,用高清照相机拍下照片:
2.1.3 粉雾剂载药方式和干粉吸入装置的确定
扎那米韦粉雾剂的上市品为泡囊型吸入粉雾剂,每个泡囊的填充量较小,需要特定的“微量填充设备”才能满足药物的装量均匀性;同时上市品为碟式泡囊型吸入粉雾剂,在满足微量填充的情况下,还需要提供与之相对应的干粉吸入装置.
根据国内微量填充设备和粉雾剂干粉吸入装置的市场应用情况,拟采用胶囊型微量填充机将扎那米韦含药粉末装入胶囊制成胶囊型吸入粉雾剂;同时采用适用于胶囊型粉雾剂的吸入装置Aerolizer作为本品的给药装置[4,5](见图6).

图6 自制扎那米韦粉雾剂(胶囊型)吸入装置——Aerolizer
2.1.4 辅料
乳糖为白色或类白色结晶性颗粒或粉末,目前上市的粉雾剂绝大多数采用乳糖作为载体,乳糖也是现阶段FDA唯一批准使用的粉雾剂载体[6,7].
乳糖作为粉雾剂的载体,其粒径、表面光滑程度等均会影响其与药物在气道内的分离程度,进而影响药物在体内的沉积部位和沉积量.不同粒度的载体对微粉化药物的吸附力不同,太细的载体辅料与微粉化的药物吸附力过强,并且可能进入肺部,导致安全性隐患.
乳糖是药物制剂中常用的辅料之一,其生产商众多,不同的生产商提供的乳糖的品质和特性有所不同.参照原研上市品的乳糖粒径分布特点可知,上市品中乳糖粒径大部分在100 μm以下.
本品采用德国美剂乐公司生产的乳糖作为粉雾剂的载体,其粒径分布特征见表1.

表1 自研制剂乳糖粒径分布特征(参照进口药品注册标准JX20200301)

表2 扎那米韦粉雾剂的处方组成
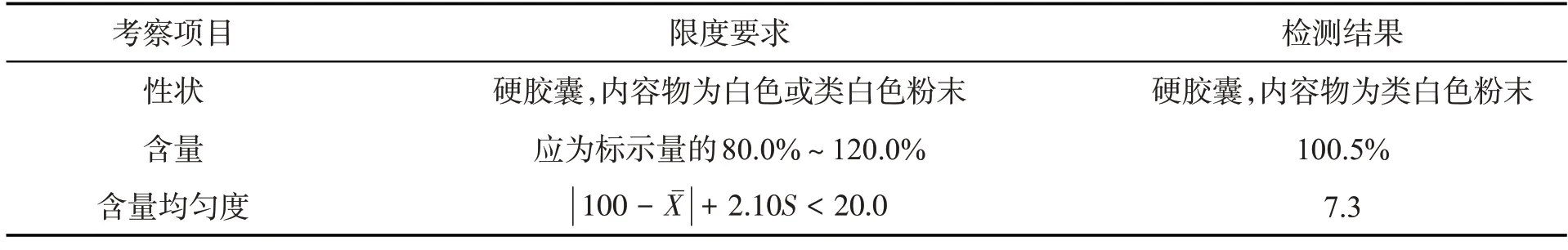
表3 扎那米韦粉雾剂自研制剂检测结果汇总表

表4 扎那米韦吸入粉雾剂原研上市品雾滴分布测定结果
2.1.5 原料药粒径的选择
根据呼吸道生理结构,为使经呼吸道吸入的药物有效地分布或沉积在治疗部位,药物的粒度要严格控制,通常在7 μm以下,粒度过大(>10 μm)或过小(<0.5 μm),可能会使药物不能有效沉积,疗效降低.对于吸入型粉雾剂,首先要进行药物微粉化处理[4].
常用的微粉化工艺有研磨法(球磨机、气流粉碎)、喷雾干燥法以及结晶法.其中气流粉碎机为低温无介质粉碎,粉碎过程主要依靠物料自身之间的碰撞来完成,有别于机械粉碎依靠刀片或锤头等对物料的冲击粉碎,因而设备耐磨损,产品纯度高.因此本品采用气流粉碎机对原料进行微粉化处理.
设计本品原料的粒径控制指标为:5 μm以下的占95%以上,不得有大于10 μm的微粒.
2.1.6 样品制备
根据原研处方组成设计本品处方,根据《吸入制剂质量控制研究技术指导原则》设计本品的制备工艺,具体如下:
取扎那米韦原料药置于气流粉碎机中,按操作规程进行操作,按规定参数对原料药进行微粉化,采用等量递增法与乳糖混合均匀,灌装胶囊,即得.
2.1.7 质量标准
取扎那米韦粉雾剂自研制剂,按自拟质量标准进行检测,结果如下:
从上述实验结果中可以看出,自研制剂的各项指标均符合要求,同时自研制剂与原研产品的雾滴分布也很接近.因此,将该处方和制备工艺作为最终处方.
2.1.8 微粉化原料药和粉雾剂内容物的吸湿性
药物在进行微粉化处理后,由于粉末比表面积急剧增大,原料药的吸湿性可能会发生明显变化,而水分又是影响粉雾剂雾滴分布等项目的关键因素,需要严格控制.
因此,本品实验考察了微粉化后原料药及粉雾剂内容物的吸湿性,并绘制了曲线,进而为控制生产环境的湿度提供依据[8-17].扎那米韦微粉化原料药及粉雾剂内容物不同湿度下的吸湿百分率数据见表5,吸湿曲线见图7.
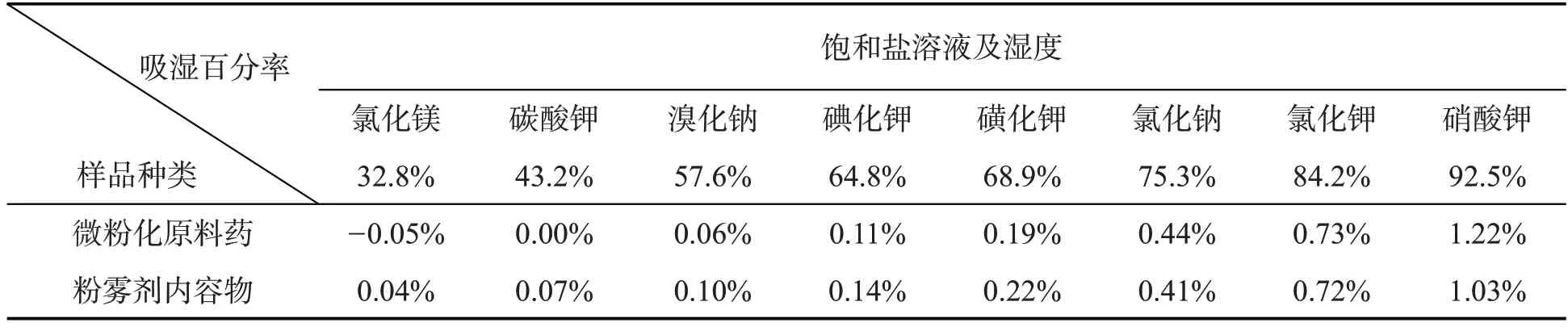
表5 扎那米韦微粉化原料药及粉雾剂内容物不同湿度下吸湿百分率结果汇总表
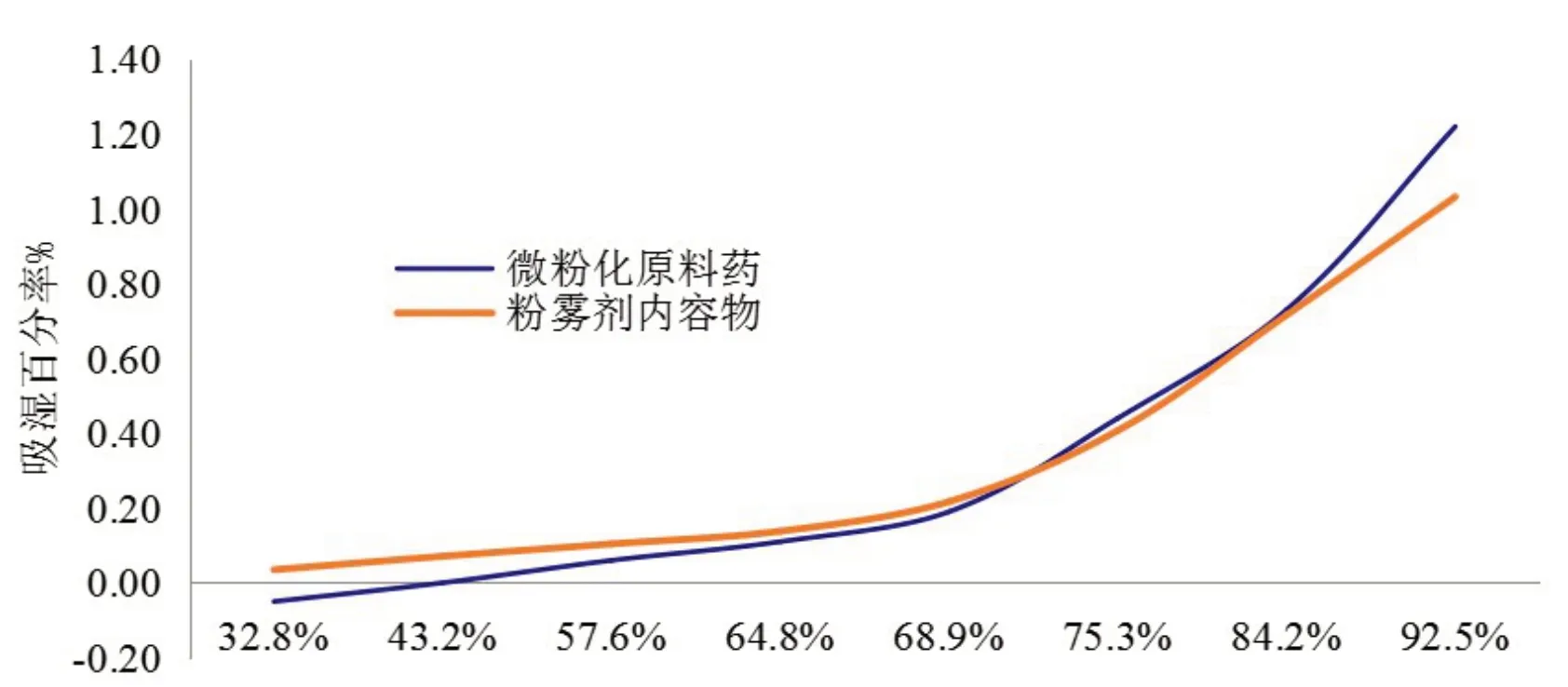
图7 扎那米韦微粉化原料药及内容物吸湿曲线
由表5和图7可知,在环境湿度64.8%(药用固体制剂GMP车间的温湿度控制范围:温度18~26 ℃,湿度45%~65%)时,扎那米韦微粉化原料药和粉雾剂内容物在48 h内吸湿百分率很小(<0.2%),即扎那米韦原料微粉化、灌装胶囊和内包装过程可以在GMP车间内直接进行,不需要特别控制环境湿度.
2.1.9 微粉化前后扎那米韦和粉雾剂内容物的堆密度
药物经微粉化处理后,其堆密度可能发生较大的变化,使药物与载体辅料混合难度增大,严重时会导致混合均匀性不合格,并可能在填充过程中出现分层现象.所以微粉化的药物、粉雾剂载体以及混合后的药物粉末均应该进行堆密度的测定,为制剂工艺的研究提供依据.
按表6称取一定量各样品,分别加入到量筒中使其体积接近5 mL,计算堆密度,测定结果见表6.
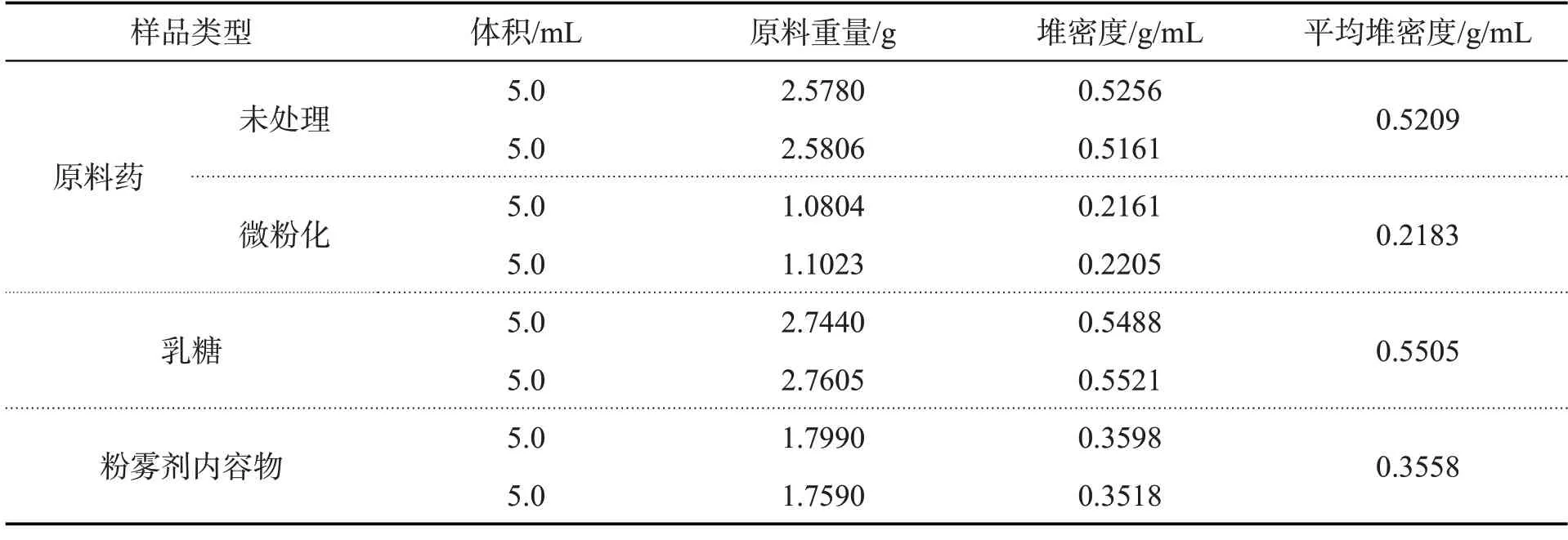
表6 微粉化前后扎那米韦原料药和粉雾剂内容物堆密度汇总表
由表6可知,药物微粉化后堆密度明显减小,但通过与粉雾剂载体乳糖混合后,能够在一定程度上改善粉末的性质,进而能满足胶囊充填过程中对装量均匀性的要求.
2.1.10 晶型对比
扎那米韦原料药有2个晶型,分别为I型(一水合物)和Ⅱ型(二水合物).本研究采用的扎那米韦原料药为一水合物,晶型为I型.粉雾剂在制剂过程中原料药要经过气流粉碎将药物微粉化,这个过程十分剧烈,可能对原料药的晶型产生影响.
分别对未处理的原料药、微粉化后的原料药和自研制剂进行晶型测定,与文献报道值进行对比,结果如下:
由表7可知,本品工艺验证三批原料微粉化前后及实验室确认三批制剂晶型一致,同时与参考文献的一水物X-衍射数据很好地吻合,说明本品是一水合物,晶型为I型,即微粉化工艺、制剂工艺对本品的晶型无影响.
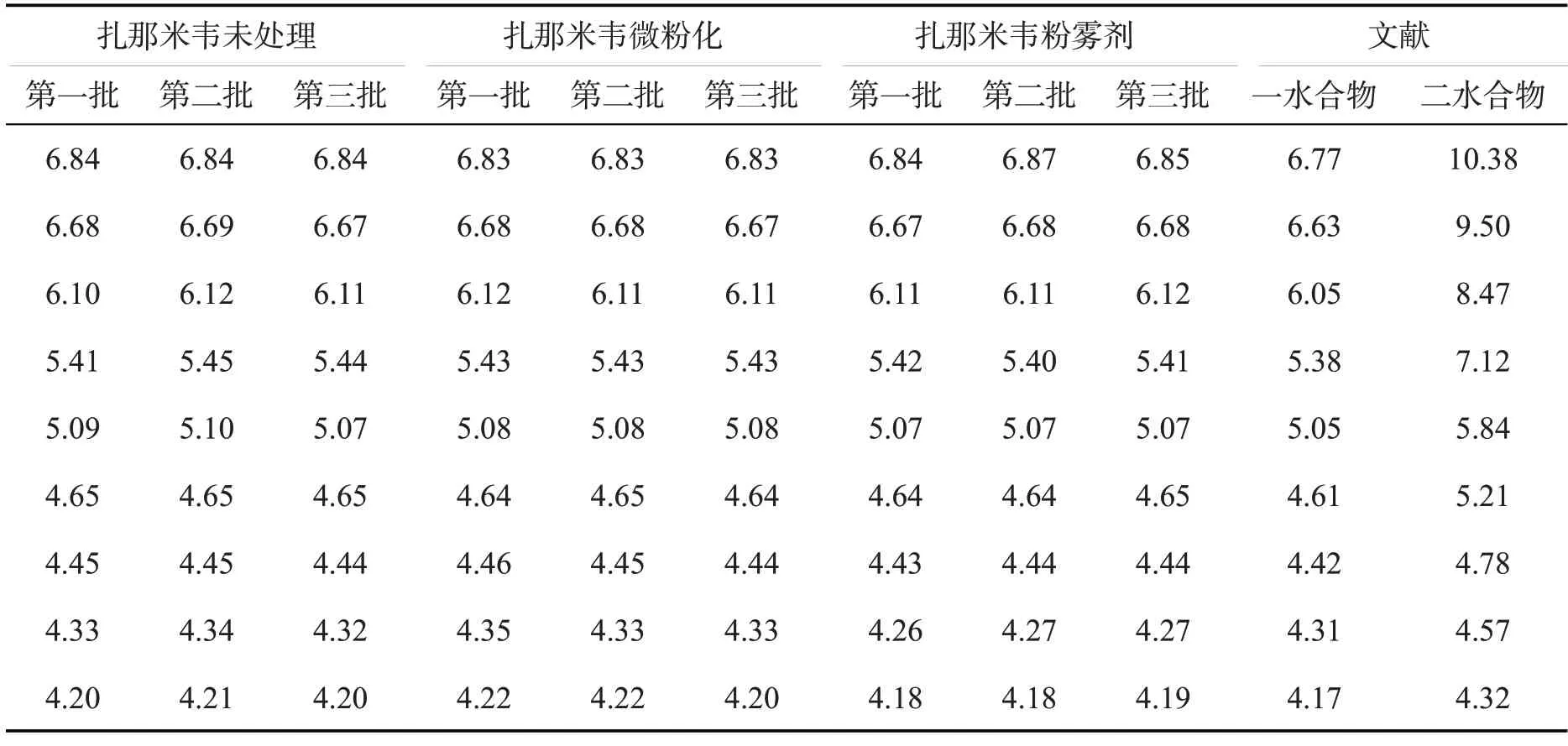
表7 扎那米韦三批原料及制剂供试品X-衍射衍射角测定主要结果
2.1.11 扎那米韦微粉化前后与乳糖混合后的流动性变化
粉雾剂内容物的流动性是影响胶囊充填均匀性的重要指标之一,可通过测定休止角的方法来判断各组分的流动性以及两者混合后流动性的变化.
休止角可通过测定粉体层的高度(堆高H)和圆盘半径(堆底的半径r)后计算而得到,公式:
本实验采用“固定漏斗法”进行休止角的测定:将漏斗固定在自制坐标纸的适宜高度H处,将原料药倒入漏斗并由其下口流出,直至漏斗下形成的圆锥体的顶与漏斗下口相平,圆锥高度H已知,通过坐标纸读出圆锥的半径,即可求出休止角,休止角的测定结果见表8.
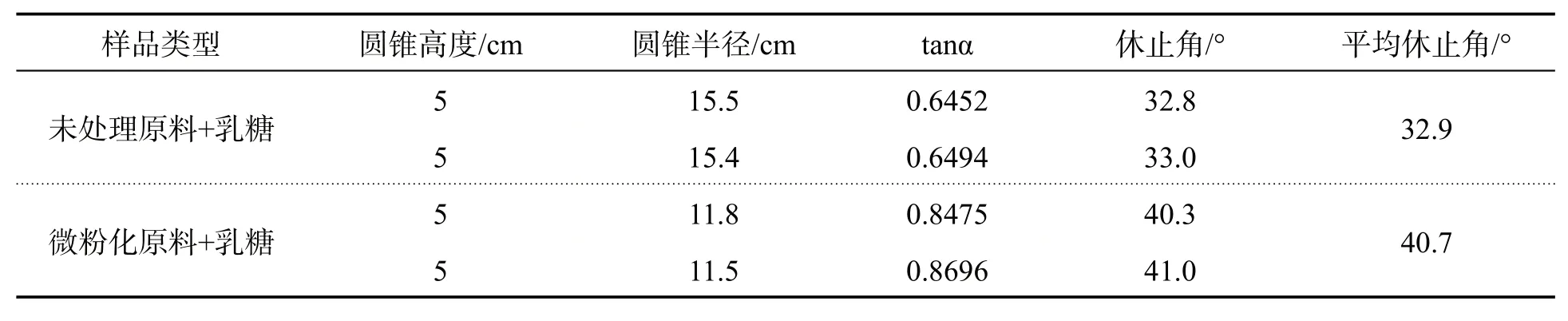
表8 扎那米韦原料药微粉化前后与乳糖混合后的休止角结果汇总表
由表8可知,微粉化原料与乳糖混合粉末的休止角大于未处理原料药与乳糖的混合粉末,原因是微粉化后药物粒径变小,在重力、范德华力、静电作用的影响下使粉末的流动性变差.微粉化原料与乳糖混合粉末(即粉雾剂内容物)的休止角为40.7°,流动性稍差;但在我们选择的胶囊填充设备下能保证胶囊充填的均匀性.
2.1.12 胶囊种类的选择
明胶空心胶囊一般是用食用级/药用级的明胶,经过精制处理与辅助材料制造而成的用于盛装固体粉末、颗粒的卵状空心外壳,应用于医药、制药行业.
羟丙甲纤维素空心胶囊是一种具备天然概念的产品,其材质及生产工艺接受度较高.
明胶空心胶囊与羟丙甲纤维素空心胶囊的性质比较见表9.

表9 两种胶囊的性质比较表

表10 影响因素试验结果
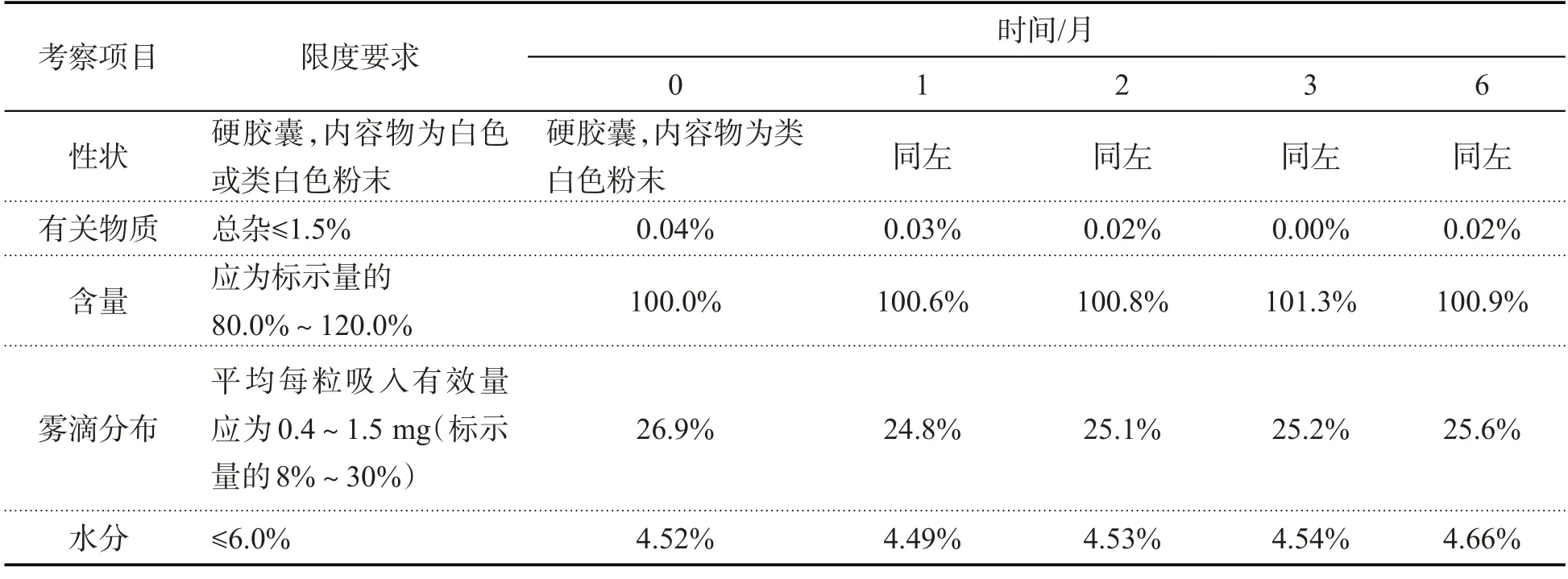
表11 加速试验结果(GX1101)
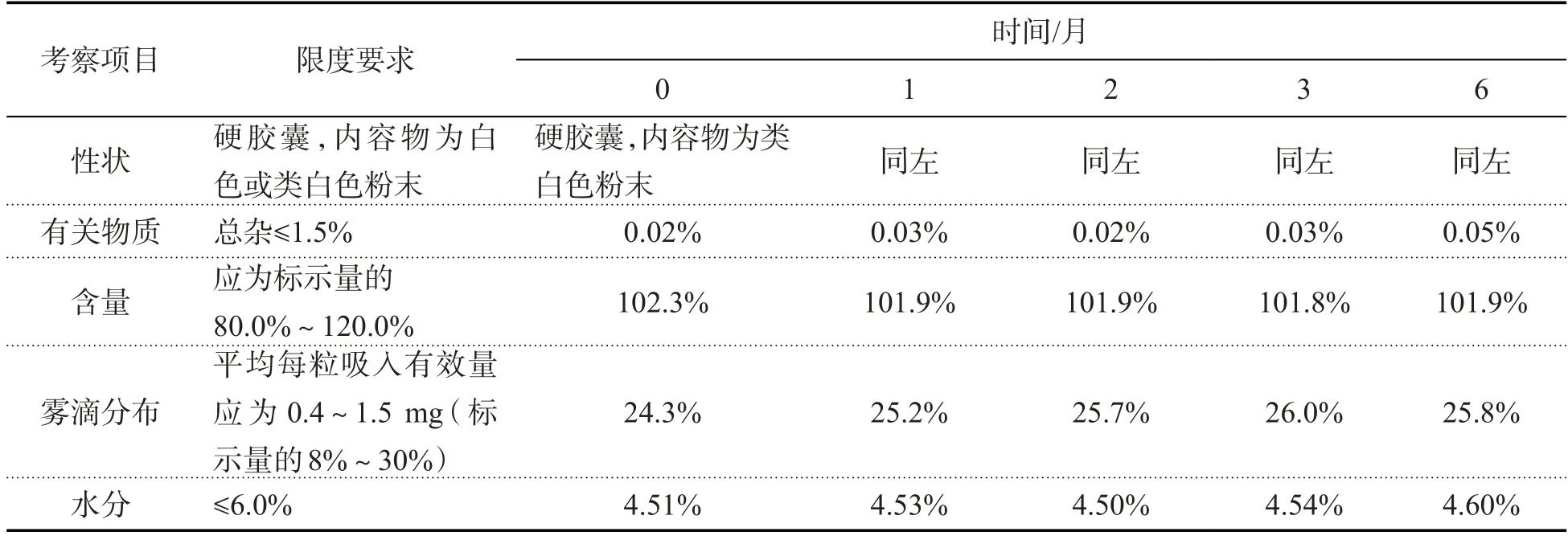
表12 加速试验结果(GX1102)
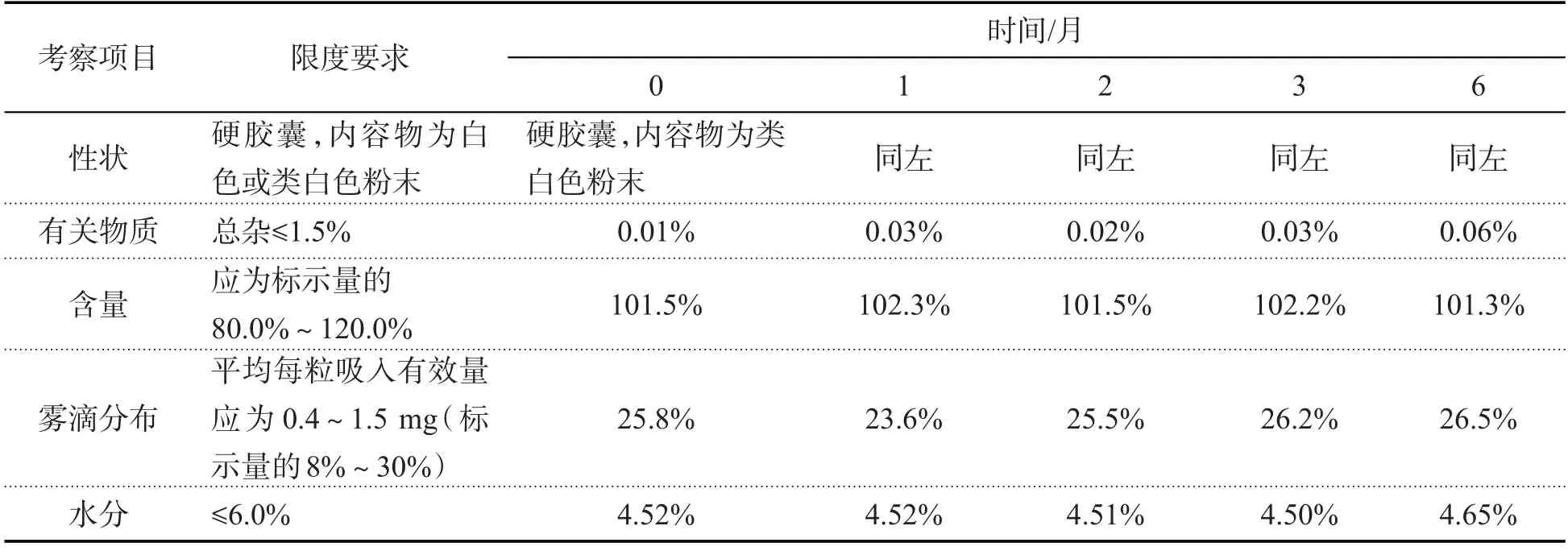
表13 加速试验结果(GX1103)
由表9可知,羟丙甲纤维素空心胶囊比明胶空心胶囊的含水量低,含水量低的特点使得羟丙甲纤维素空心胶囊适合于吸湿性或水分敏感性内容物的填充,吸入性制剂由于其给药特点,对水分的要求较严格,羟丙甲纤维素空心胶囊与普通的胶囊相比,可以很好地满足吸入剂对于水分的要求.
另外,羟丙甲纤维素空心胶囊的韧性较好,在环境湿度较低或较高时,也可保持较好的形态和性能.本品为胶囊型吸入粉雾剂,患者需要通过吸入装置Aerolizer将胶囊两端刺破,再吸入药物粉末.如果胶囊壳对湿度较敏感,湿度大时,胶囊壳变软,装置无法有效刺破胶囊,使胶囊排空率变低,患者不能吸入有效剂量;湿度小时,胶囊壳变脆,装置刺破胶囊时使整个胶囊破碎,患者吸入药物时,难免吸入胶囊碎屑,刺激咽喉,给患者造成一定的身体危害,患者顺应性变差.
综上,本品选用了韧性较好,对湿度敏感性较低的羟丙甲纤维素空心胶囊作为本品的给药载体.
2.2 中试放大
2.2.1 样品制备
①粉碎:调节压缩空气压力≥0.6 Mpa,将扎那米韦加入气流粉碎机粉碎,调加料速度约20 g/min,粉碎后原料取样进行粒度检测,要求粒度5 μm以下的占95%以上,不得有>10 μm的微粒.
②配料:称取处方量的扎那米韦和乳糖,备用.
③混合:将处方量的扎那米韦与乳糖用等量递增法混合,混合时间30 min/次.混合后检测半成品的含量,备用.
④胶囊充填:取混合药粉和3#羟丙甲纤维素胶囊,分别加入胶囊填充机的加料斗中,调节胶囊填充量至理论装量范围内,灌装胶囊.
⑤铝塑包装:将扎那米韦吸入粉雾剂胶囊置铝塑泡罩包装机中铝塑包装.
⑥外包装:将铝塑板装入复合袋、装盒、装箱.
将中试放大样品进行全检,结果三批样品均符合质量标准要求.
2.2.2 影响因素试验
取自制扎那米韦粉雾剂(GX1101批),除去外包装置于玻璃平皿中,称重,分别于光照(光照强度:12 000 Lx),高温(40 ℃、60 ℃),高湿(相对湿度RH75%、RH92.5%)条件下放置,于第10天和30天取样检查(光照于第5天和第12天取样),结果见下表.
结果表明,本品经影响因素试验,在光照、高温条件下有减失重量,在高湿度条件下有吸湿增重,其余条件下各项指标均无明显变化,表明本品稳定性较好,可将本品的储存条件暂定为遮光、密封保存.
2.2.3 加速试验
取上述中试放大样品共3 批(批号:GX1101、GX1102、GX1103),分别在40 ℃/RH75%恒温恒湿培养箱中放置,在第1、2、3、6月取样,照质量标准操作,测定中试样品稳定性,结果如下:
结果表明,本品以模拟上市包装在加速试验条件下放置6个月,各项指标均无明显变化,可将有效期暂定为24个月.
3 小结与讨论
3.1 市场上乳糖的型号以及制备方法较多,包括普通乳糖、喷雾干燥法制备的乳糖以及重结晶法制备的乳糖等,质量存在差异.乳糖表面的粗糙度是影响雾化性能的关键因素,不同工艺制得的乳糖表面粗糙度存在较大差异.因此市售乳糖存在不同的用途和级别.自研制剂采用的乳糖为德国美剂乐公司生产的专用于吸入的乳糖—Inhalac 230.
3.2 吸入粉雾剂是将微粉化的药物单独或与载体混合后,经特殊的给药装置,通过患者的主动吸入,使药物分散成雾状进入呼吸道,发挥局部或全身作用的一种给药体系,按类型分为胶囊型吸入粉雾剂、泡囊型吸入粉雾剂、贮库型吸入粉雾剂.本课题原研制剂为泡囊型,自研制剂根据厂家生产特点选择了胶囊型.
3.3 本品原辅料比例为1∶4,粒径差异较大(主药粒径小于5 μm,乳糖粒径约为100 μm);另外,药物微粉化后容易产生静电团结.因此必须保证混合的均匀性,混合工艺采用等量递加法进行操作.
3.4 本品工艺验证3批原料微粉前后及工艺验证3批制剂晶型一致,均为一水合物,晶型为I型,即微粉化工艺、制剂工艺对本品的晶型无影响.同时,工艺验证样品影响因素和加速6个月样品相关检测指标没有明显变化,初步证明自研制剂性质稳定.因此,可将自研制剂有效期暂定为24个月.
