基于NLRP3炎性小体探讨清心开窍方对APP/PS1双转基因小鼠神经炎症的影响
2023-06-15王柳莺赖晓晓刘硕徐露婷沈燕胡海燕
王柳莺,赖晓晓,刘硕,徐露婷,沈燕,胡海燕
1.温州医科大学附属第二医院 中医科,浙江 温州 325027;2.温州医科大学 第二临床医学院,浙江 温州 325035
阿尔茨海默病(Alzheimer’s disease, AD)是一种进行性晚期痴呆性疾病,渐进性认知能力下降和生活障碍,目前尚无有效的治疗手段[1-2]。在β-淀粉样蛋白(β-amyloid, Aβ)沉积的刺激下,核苷酸结合寡聚域样受体蛋白3(Nod-like receptor protein 3, NLRP3)在AD大脑内组装和激活,进一步引起天冬氨酸特异性半胱氨酸蛋白(cysteinecontaining aspartate-specific proteases-1,Caspase-1)的激活以及下游白细胞介素(interleukin,IL)-1β分泌,引发炎症反应[3]。目前越来越多研究表明,抑制NLRP3相关通路可以影响AD的发生发 展[3-4]。清心开窍方是在经方剂服蛮煎的基础上去木通加苦参而成,课题组以往的研究表明,清心开窍方可以多靶点抑制Aβ的生成并且能改善AD小鼠的学习记忆能力[5]。临床观察表明,经辨证选用服蛮煎及其他名方合并西药治疗AD,对恢复AD患者的认知功能优于单独使用西药[6]。APP/PS1小鼠是公认的研究AD防治策略的转基因动物模型。盐酸多奈哌齐片(安理申)是目前临床运用最多的治疗AD的药物,常用于治疗轻度、中度AD,故将多奈哌齐设为西药对照组[7]。本研究旨在以APP/PS1小鼠为实验对象,从NLRP3相关通路来探讨清心开窍方对AD的神经保护作用及其机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:从上海集团医药生物有限公司购入3月龄的10只雄性C57BL/6J小鼠[动物许可证号:SCXK(苏)2018-0008]。从智新(北京)健康医学研究院有限公司购入同龄雄性SPF级的50只APP/PS1双转基因小鼠[动物许可证号:SCXK(苏)2018-0002]。小鼠均饲养在温州医科大学SPF级别的动物房里。小鼠被安置在独立的笼子里,在室温(23± 2)℃和相对湿度40%~50%的条件下,保持12 h的光-暗周期,并提供充足的食物,小鼠可自由饮水饮食。实验前先适应性饲养7 d,本研究经温州医科大学实验动物伦理委员会批准(wydw2020-0814)。
1.1.2 主要试剂和仪器:清心开窍方水煎剂组 成:鲜地黄6 g、苦参6 g、白芍药6 g、陈橘皮4 g、石斛6 g、伏神6 g、知母5 g、牡丹皮6 g、石菖蒲6 g、麦门冬6 g,由温州医科大学附属第二医院中药房提供。盐酸多奈哌齐药片(安理申)购自辽宁卫材制药有限公司(批号:100223A)。苏木精-伊红(HE)染色试剂盒购自北京索莱宝公司,甲苯胺蓝染液购自北京雷根生物技术有限公司,SYBR Green I和反转录试剂盒购自日本Takara公司。山羊抗兔NLRP3(ab263899)、IL-6(ab7737)和Aβ(ab110888)抗体购自英国Abcam公司,山羊抗小鼠Caspase-1(14F468)抗体购自美国Santa公司,山羊抗兔IL-1β(D4T2D)购自美国Cell Signaling Technology公司,山羊抗兔Tublin购自美国Affinity公司。Morris水迷宫(Morris water maze, MWM)(北京硕林苑公司),化学发光凝胶成像仪系统、CFX 96touch荧光定量PCR(美国伯乐公司),石蜡切片机(英国Shandon公司),病理扫描仪(日本KEYENCE公司)。
1.2 方法
1.2.1 实验动物分组及给药方法:将实验小鼠按随机数字表法分为清心开窍方高剂量(H-QKF)组 [19 mg/(kg·d)]、清心开窍方中剂量(M-QKF)组 [9.5 mg/(kg·d)]、清心开窍方低剂量(L-QKF)组 [4.75 mg/(kg·d)]、多奈哌齐(Aricept)组 [1.67 mg/(kg·d)]和APP/PS1双转基因模型(Model) 组,每组10只。同时选取相同数量的C57BL/6J小鼠作为对照(Control)组,向胃内灌注同体积的0.9%氯化钠溶液。所有动物于每日上午9时进行灌胃给药,连续进行90 d。
1.2.2 MWM实验:定向导航测试和空间探索测试是MWM实验的两个主要部分。MWM由一个圆形水池(直径160 cm,高度50 cm)组成,水温为(25±2)℃,在第四象限不透明水面下2~3 cm处放置一个隐藏的平台(直径10 cm)。在水池正上方约2.5 m处设置一个与系统相连的摄像头,用于记录小鼠的游泳轨迹和相关数据。定向导航测试是每天上午9点进行连续5 d的训练,一天4次,每个象限为入水处1次, 训练间隙需超过20 min。逃避潜伏期是指老鼠进入水中并找到平台所需的时间。小鼠到达隐藏平台的时间限制被设定为60 s。小鼠在时限内找到平台,并在平台上停留3 s,就被认为是成功的,记录对应逃避时间。如果小鼠未能在时限内到达平台,则逃避时间被记录为60 s,并指引小鼠在平台上停留10 s 以加强记忆。每日4次训练成绩的平均值记录为其逃避时间,用来评估其学习记忆能力。空间探索测试是在实验的第6天,将水池中的平台取出,让小鼠自由游泳60 s,记录其穿越平台的次数和在目标象限的时间百分比来评估其空间位置记忆能力。
1.2.3 脑组织取材:在进行脑组织取材前,需要对小鼠进行安乐死。行为学测试结束后,将每组小鼠随机抽样,分为A组(36只)和B组(24只)。A组小鼠通过3%戊巴比妥钠进行麻醉,夹住小鼠爪子测试无明显反应后迅速处死,用镊子将大脑剥离出来,放入标记后的无酶Ep管中,并在-80 ℃的冰箱中冰冻保存,用于后续实验。将B组小鼠心脏灌注并取出脑组织,石蜡包埋组织,用于后期病理染色实验。
1.2.4 HE染色:将石蜡切片(5 μm)放入烘箱2 h彻底融化组织表面残余石蜡,接着放入二甲苯脱蜡和梯度乙醇水化,随后使用苏木素染色3 min,超纯水洗去多余染色液。显微镜下分化液分化5 s,用自来水冲洗5 min。然后将样本置于伊红染色液中 1 min,并倾倒掉多余的染色液,超纯水冲洗2~3 s,后进行快速乙醇上行脱水和二甲苯透明处理,中性树脂封片,扫描仪进行图像采集,观察小鼠海马区神经元染色效果。
1.2.5 尼氏(Nissl)染色:切片常规脱蜡后,使用甲苯胺蓝染色剂在60 ℃下染色30 min,然后在蒸馏水和70%乙醇中进行洗涤(各5 min)。使用95%乙醇快速分化,如果分化不成功可以重复染色步骤。随后,使用无水乙醇快速脱水,再用二甲苯透明,中性树脂封片,观察小鼠海马CA1区的尼氏体数量。
1.2.6 蛋白质印迹(Western blot):将脑海马组织(50~80 μg)用裂解液、磷酸酶抑制剂和蛋白酶抑制剂的混合物匀浆裂解。收集上清液后,用BCA法测定蛋白质的浓度并制备蛋白质样品。蛋白质样品通过电泳分离并转移到PVDF膜上。将膜在5%的脱脂牛奶中封闭2 h,并与各种抗体(1:1 000)在4 ℃冰箱摇床上孵育过夜。第2天,用TBST清洗膜,并在室温下与对应的二抗孵育90 min。洗掉二抗用超灵敏的ECL化学发光试剂盒对条带显影,用Image lab软件分析条带的灰度值,并以Tublin为内参计算相关条带的相对表达量。
1.2.7 实时荧光定量聚合酶链反应(RT-qPCR)检测:用TRIzol方法从海马组织中分离出总RNA,用分光光度计测定RNA的纯度和浓度。根据反转录试剂盒合成cDNA。20 μL RT-qPCR反应体系:10 μL TB Green Premix Ex Taq II,正向和反向引物 (10 μmol/L)各1 μL,6 μL不含RNase的H2O,2 μL cDNA模板;反应条件:95 ℃预变性(1个循环) 4 min,95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,35个反应循环,72 ℃延伸10 min。每个样本组重复实验3次,软件自动计算每个指标组中目标基因的Ct值,采用2-ΔΔCt法进行统计分析。引物序列见表1,由上海生工生物工程有限公司合成。
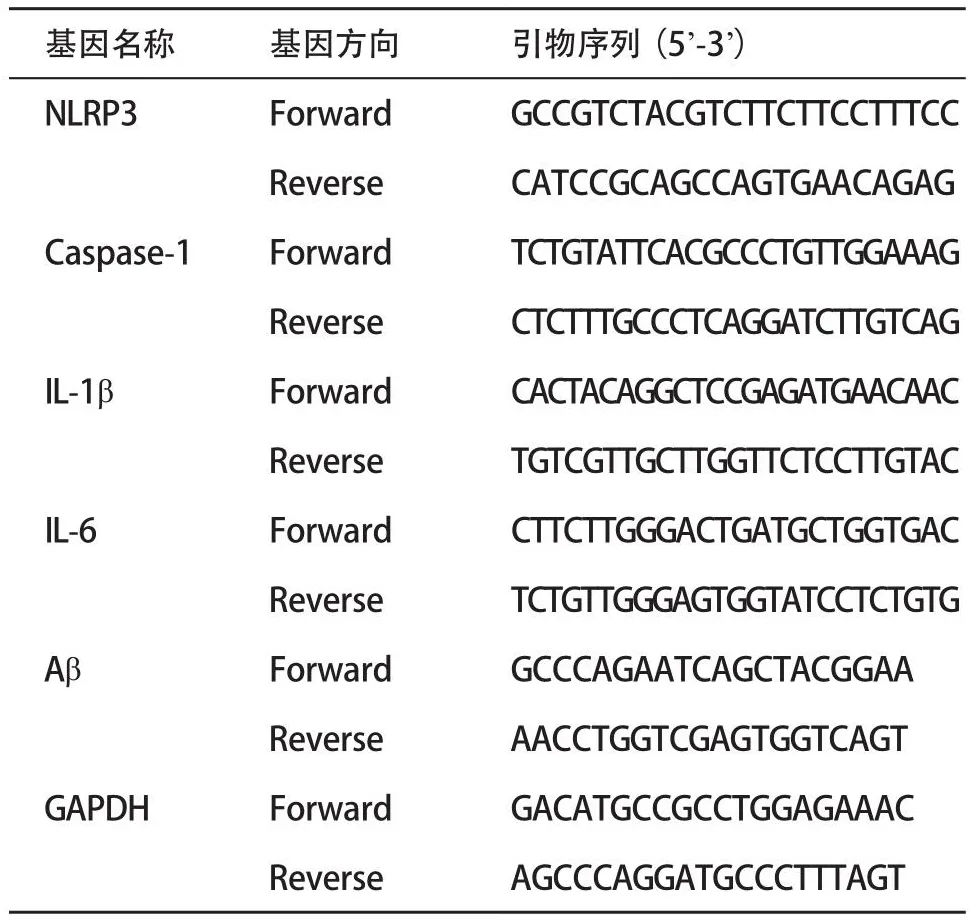
表1 目的基因引物序列
1.3 统计学处理方法 采用SPSS25.0、Prism 9进行数据分析和图表绘制。计量资料采用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验或Dunnett’sT3(方差不齐)验证。P< 0.05为差异有统计学意义。
2 结果
2.1 清心开窍方对AD模型小鼠学习和记忆的影响 在5 d的MWM定位航行试验中,与Control组相比,Model组的运动轨迹明显是无方向性的,而各治疗组对平台则是进行选择性搜索,且搜索路径比Model组明显缩短(见图1A)。随着训练时间的增加,各组的逃避潜伏期逐渐下降。在训练的第1天,6个实验组之间的逃避潜伏期差异无统计学意义 (P>0.05);第2天,Model组的平均逃避潜伏期高于Control组,差异有统计学意义(P<0.05);在第3天,Model组的平均逃避潜伏期高于Control组(P< 0.01),且Aricept组、M-QKF组和H-QKF组的逃避潜伏期比Model组明显缩短(P<0.05)。在训练的第4天和第5天,Aricept组、M-QKF组和H-QKF组的逃避潜伏期都明显短于Model组(P<0.01),L-QKF组的逃避潜伏期也比Model组有一定程度的缩短(P<0.05)。与Aricept组相比,L-QKF组逃避潜伏期较长,差异有统计学意义(P<0.05),而M-QKF组和HQKF组差异无统计学意义(P>0.05)。在3个给药组中,M-QKF组的小鼠的逃避潜伏期比H-QKF组和L-QKF组要短。见图1B和图1C。各组训练后潜伏期缩短的程度不同,说明小鼠平台发现是一个学习和记忆的过程,治疗组小鼠的学习和记忆能力都有提高。

图1 清心开窍方对APP/PS1双转基因小鼠学习记忆能力的影响
在去除平台后的空间探索测试中,Model组的小鼠在水池中无方向游动,不能有效地定位隐藏的平台,而Control组的小鼠在训练后能够准确地定位平台的隐藏位置,并多次穿越隐藏的平台;各治疗组介于两者之间,与Model组相比能够更好地找到隐藏平台处,见图1D。与Control组相比,Model组跨越平台的次数和在平台目标象限所花费的时间明显减少(P<0.01);各药物干预组与Model组相比,其平台跨越次数和在平台像限滞留时间明显增加 (P<0.05,P<0.01);见图1E、图1F;表明治疗组小鼠对隐藏平台所在的位置有更强的记忆保留。
2.2 清心开窍方对AD模型小鼠海马区神经元的影响 Control组小鼠海马CA1区中的锥体细胞排列密集、结构完整,细胞形态正常,细胞核大且形状圆润,没有坏死退化的神经元,相比之下,Model组海马中神经元数量减少(P<0.05),结构变得紧凑无序,锥体细胞大量减少,细胞体积缩小,部分细胞出现形态学变化,细胞核固定、皱缩,细胞大量坏死,染色更深。与Model组相比,Aricept组和MQKF组细胞数量增加(P<0.05),细胞形态更加完整,排列更加整齐紧密。在3个清心开窍方药物剂量组中,H-QKF组和L-QKF组与Model组相比,也表现为异常细胞减少(P<0.05),形态较为完整。与Aricept组相比,M-QKF组细胞数目增加,而H-QKF组和L-QKF组有一定减少,说明M-QKF组效果最明显。见图2。
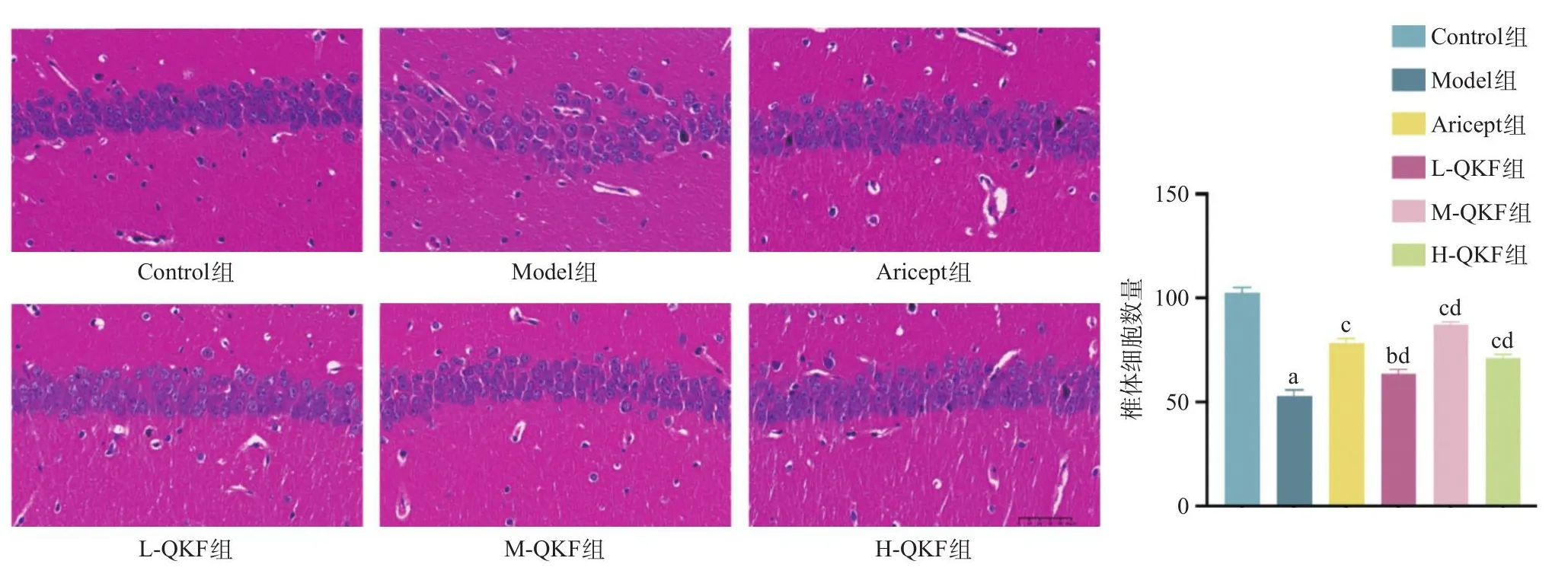
图2 小鼠海马CA1区HE染色以及细胞数目统计图(标尺总长=50 μm)
2.3 清心开窍方对AD模型小鼠海马区尼氏体的影响 尼氏体是一种嗜碱性颗粒,经甲苯胺蓝染色后呈深蓝色,是神经元细胞合成蛋白质的主要场所,在神经元兴奋传导过程中具有重要作用,可以评估神经元功能状态。本研究中小鼠海马的Nissl染色结果显示,在Control组小鼠的海马区,神经元呈多层密集排列,形态规则,胞核染色深蓝色,富含尼氏体。然而,Model组小鼠海马区神经元的排列明显散乱,间隙变大,尼氏体数量减少(P<0.05),胞核染色变浅。Aricept组、L-QKF组、M-QKF组和HQKF组神经元的排列与Model组相比有所改善,神经元排列整齐,尼氏体数量增多(P<0.01),染色加深。药物干预组之间比较,M-QKF组尼氏体数目与Aricept组差异无统计学意义(P>0.05),而L-QKF组略有降低(P<0.05)。见图3。
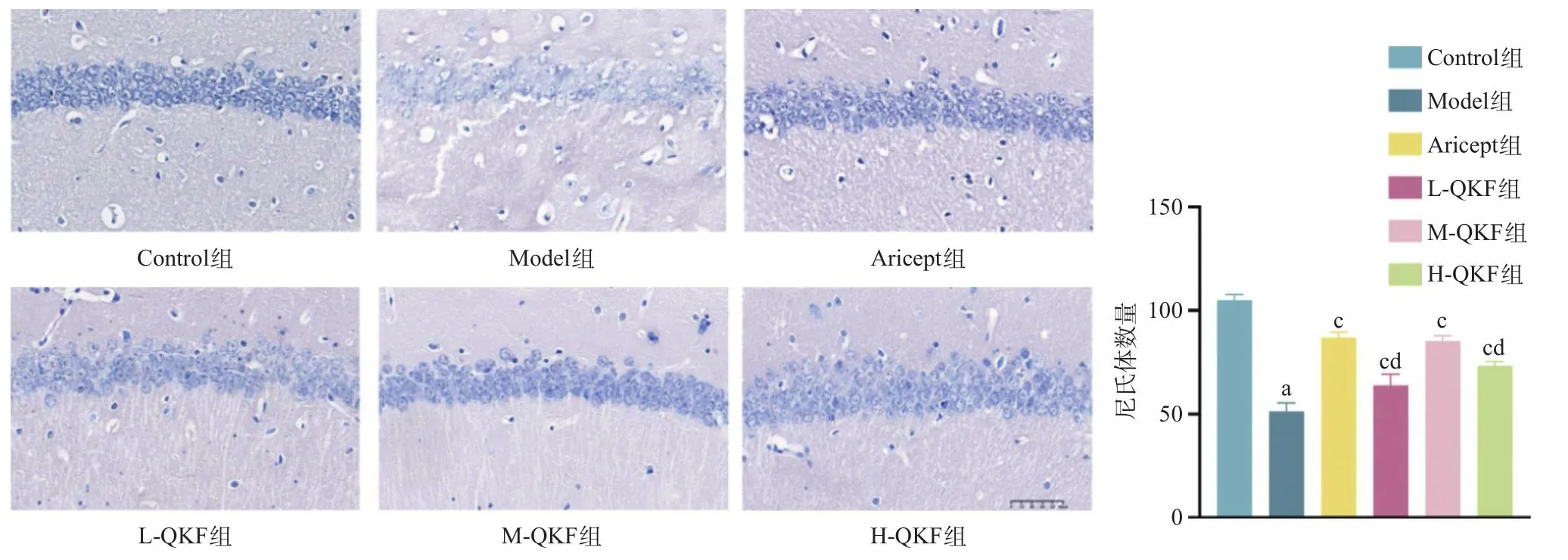
图3 小鼠海马CA1区Nissl染色及尼氏体数目统计图(标尺总长=50 μm)
2.4 清心开窍方对AD模型小鼠海马区NLRP3、 Caspase-1、Aβ、IL-1β、IL-6蛋白表达的影响 NLRP3、 IL-1β、Aβ、Caspase-1和IL-6在各组小鼠的海马组织中均有表达。与Control组相比,Model组NLRP3、IL-1β、Aβ、Caspase-1和IL-6的蛋白相对表达量明显升高(P<0.01);与Model组相比,药物干预组蛋白NLRP3、Caspase-1、Aβ、IL-1β和IL-6的蛋白相对表达量均有不同程度的降低(P<0.05);与Aricept 组相比,M-QKF组Caspase-1、Aβ、IL-1β和IL-6的蛋白相对表达量差异无统计学意义(P>0.05),NLRP3蛋白表达量更低(P<0.05),而L-QKF组的Aβ、IL-1β、IL-6蛋白表达量有所升高(P<0.05)。见图4。以上结果表明药物干预对模型小鼠炎性反应有明显的抑制作用。

图4 各指标代表性Western blot条带以及各组小鼠Aβ、NLRP3、Caspase-1、IL-1β及IL-6蛋白表达水平
2.5 清心开窍方对AD模型小鼠海马区NLRP3、 Caspase-1、Aβ、IL-1β、IL-6 mRNA的表达影响 与Control组相比,Model组海马区组织NLRP3、IL-6、Aβ、Caspase-1、IL-1β的mRNA表达明显升高(P<0.01);与Model组相比,Aricept组和清心开方治疗组海马中Aβ、NLRP3、IL-6、Caspase-1、IL-1β的mRNA表达有不同程度的下降,差异有统计学意义(P<0.05)。与Aricept组相比,M-QKF组和H-QKF组NLRP3、Caspase-1、Aβ、IL-1β、IL-6 mRNA的表达量差异无统计学意义(P>0.05),而L-QKF组的Aβ、NLRP3、IL-1β、IL-6 mRNA表达有所升高(P<0.05)。见图5。

图5 各组小鼠Aβ、NLRP3、Caspase-1、IL-1β及IL-6 mRNA表达水平
3 讨论
AD是目前最常见的神经退行性疾病之一,它是一种复杂的、多因素的疾病。根据2020年的一项全国横断面研究,中国有983万60岁及以上的人患有AD[8]。全球AD患者约为5 000万人,预计到2050年将增加两倍[9]。在中国老龄化现象日益加剧的情况下,AD的患病人数也会增加,给国家医疗卫生带来巨大考验,也会给家庭经济带来巨大负担[10]。
尽管AD患者的医疗负担很重,但临床上还没有预防或逆转该疾病的方法。目前在中国被批准用于治疗AD的药物包括乙酰胆碱酯酶 (Acetylcholinesterase, AChE)抑制剂,其中主要是多奈哌齐、利瓦斯蒂明等[11]。这些药物对AD的症状改善作用十分轻微,而且有许多不良反应。中药是中国最伟大的财富之一,因为它具有系统性、多靶点、不良反应少等特点,在预防和治疗许多疾病方面发挥了良好的作用。明代名医张景岳在《景岳全书》首次提出“痴呆”这一病名,并对该病进行了系统性的论述。他也首创“服蛮煎”,指出此方对消除气滞、开郁结、扬正气、驯邪气都有很好 的效果[12]。本研究以清心开窍方作为中药干预组,通过加减《景岳全书》中的经方“服蛮煎”形成,去掉具有肾毒性的木通,加入具有清热解毒作用的苦参[13]。临床上常用于预防和治疗痴呆症的中药有生地黄、石菖蒲、苦参等,它们是清心开窍方的主要组成部分。鲜地黄中的活性分子醇(Catapol)具有跨越血脑屏障的能力,具有明显的神经保护、抗炎和抗衰老作用,不良反应少,可以治疗AD[14]。药理研究表明,β-细辛醚是石菖蒲的主要活性成分,β-细辛醚和淫羊藿苷的组合能有效地促进自噬,防止线粒体损伤,抑制Aβ的产生,在一定程度上治疗AD[15]。苦参碱能抑制Aβ诱导的小胶质细胞活化,减少神经炎症[16]。清心开窍方经过药理网络分析后发现,其所含的10种草药中共鉴定出295种活性化合物,关联1 368个目标蛋白质,并鉴定出与AD相关的1 218个靶基,研究结果表明,清心开窍方可通过抑制p38 MAPK和激活ERK1/2来抑制神经元的凋亡[17-18]。清心开窍方还可以通过PI3K/Akt途径改善AD小鼠的认知能力并抑制细胞凋亡,并对APP/PS1双转基因动物发挥神经保护作用[19]。清心开窍方水煎剂和活性提取物能抑制神经炎症,保护神经元细胞,从而改善AD小鼠的空间学习能力和记忆表现。
MWM实验是全世界公认的行为学研究的经典实验,成为学习和记忆研究的首选。本研究行为学结果显示,经过5 d的连续训练,小鼠的定位能力和空间探索能力得到了明显提高,表明清心开窍方可以提高小鼠的学习和记忆能力。海马是AD患者第一个受到影响和改变的脑区,它已被证明与AD患者的认知障碍密切相关[20]。有研究对AD大脑海马角四个区域(CA1-CA4)的神经元密度进行量化,结果表明与其他3个区域相比,在CA1区的神经元密度减少最显著[21]。有研究证明CA1区参与小鼠学习及空间记忆[22]。因此,在本研究中,我们把海马CA1区作为监测AD模型小鼠神经元病理变化的目标部位。HE染色和Nissl染色表明小鼠海马CA1区域的神经元在对照组明显排列紧密,细胞结构完整,尼氏体含量丰富;而模型组则排列散乱,出现细胞皱缩死亡,尼氏体大量消失,Nissl染色颜色很浅;药物治疗组对比模型组均有不同程度的改善,说明清心开窍方对小鼠海马区神经元具有保护作用,可以减少神经元的丢失。
神经炎症是AD的一个核心机制,也是一个潜在的治疗目标。Aβ在AD的神经变性中起着重要作 用[23]。在神经炎症期间,由Aβ引发星形胶质细胞和小胶质细胞的活化并产生炎症因子和神经毒素,促进AD大脑的神经变性[24]。本研究采用Western blot和RT-qPCR检测Aβ斑块的改变,表明清心开窍方可以降低Aβ的产生,从而缓解AD。NLRP3炎性小体是目前已知较特征性的炎性小体,它在小胶质细胞中表达丰富,同时有研究发现NLRP3炎性小体在引发胶质细胞反应和Aβ病理变化中发挥着重要作用[25]。NLRP3炎性小体的激活对脑组织造成重大损害,并在AD的发展中起重要作用[26]。有研究证明小鼠大脑内NLRP3敲除会明显减少脑内Caspase-1和IL-1β激活以及增强了Aβ的清除,并可以减缓小鼠空间记忆丧失和其他AD相关症状[27]。有研究表明,MCC950作为NLRP3靶向分子抑制剂可以减轻AD小鼠认知障碍,抑制小胶质细胞的激活和Aβ的沉积[28]。 Aβ、胶质细胞和NLRP3炎性小体不断相互作用,刺激神经炎症物质的分泌,导致神经炎症,最终导致AD的发生。以上研究表明抑制NLRP3相关通路可能是治疗AD的一个新手段。本研究表明清心开窍方可以降低AD模型的NLRP3、Caspase-1、IL-1β和IL-6的蛋白表达和NLPR3、Caspase-1、IL-1β、IL-6 mRNA的表达。清心开窍方可能可以通过抑制NLRP3炎性小体减轻AD小鼠的神经功能障碍,从而对AD产生神经保护作用。多奈哌齐被认为是治疗AD的一线药物,是第二代AChE抑制剂,可从胃肠道缓慢吸收[7]。有研究表明,多奈哌齐可抑制脂多糖诱导的AKT/MAPK信号的磷酸化、NLRP3炎性小体和转录因子NF-κB/STAT3,从而减少神经炎症反应[29]。因此,本研究通过与西药对照组的多奈哌齐的疗效比较,评价清心开窍方治疗AD的疗效。研究结果表明,多奈哌齐能很好地抑制转基因小鼠的病变,而清心开窍方中剂量与其效果无明显差异,有时甚至更好,说明清心开窍方能对AD发挥良好的治疗作用。因为多奈哌齐作为AChE抑制剂的作用机制是通过抑制与学习和记忆有关的神经递质AChE的分解来改善AD[30]。然而,AChE也存在于身体的其他地方,服用这类西药会导致一些不良反应,包括呕吐、腹泻、肌肉疼痛、头痛、失眠和心律失常等[31]。研究报告说明使用多奈哌齐治疗AD,随着剂量的增加,其疗效没有明显增强,但是会有更多更强烈的不良反应,这导致许多患者会停止治疗[32]。而清心开窍方作为中药复方对疾病可以多靶点地发挥治疗作用,更适合治疗病因与发病机制复杂的AD。同时各药物组成之间相互补充,调节全身机体,有更好的疗效,且不良反应很小,使患者能更专注于服药。
综上所述,清心开窍方能够改善APP/PS1小鼠学习记忆能力和病理损伤,对海马神经元起保护作用,缓解AD模型小鼠的病程进展,其机制可能是下调了NLRP3炎性小体相关的信号通路指标的表达水平,起到了抗炎的作用。清心开窍方有望在AD的临床治疗中发挥潜在的预防和治疗作用。
