荧光剂–示踪液体法检查滴眼剂包装密封完整性
2023-06-15江燕任锟冯霞兰张莞英郭宏伟赵代国
江燕,任锟,冯霞兰,张莞英,郭宏伟,赵代国
(1.四川省药品检验研究院(四川省医疗器械检测中心),成都 611731;2.成都市金鼓药用包装有限公司,成都 611530)
药品包装系统密封完整性是一项涉及药品质量的重要物理监测指标,良好的包装形式能够防止药品内容物的损失,阻止微生物和有害物质的进入,从而保证药品安全、稳定[1]。欧美国家很早就认识到包装密封完整性的重要性,制定了USP<1207>、PDANO.27、ASTM F 2391—05 等一系列标准指南,为药品包装系统密封完整性验证提供了指导[2-7]。我国药品监管部门在药品生产质量管理规范(2010 年修订)(卫生部令第79 号)中提及了包装系统密封完整性要求,并于2020 年正式发布了《化学药品注射剂包装系统密封性研究技术指南(试行)》,将药品包装系统密封完整性的要求提到了一个新的高度[8-9]。
包装系统密封完整性测试方法多种多样,包括色水法、微生物挑战法、质量提取法、示踪气体法、真空衰减法、高压放电法、激光法、压力衰减法等[10-20]。以上方法各有优劣,如色水法对硬件的要求较低,但通常灵敏度较低;微生物挑战法需要操作人员具备微生物相关的专业知识;其他方法诸如质量提取法、高压放电法等需要配备专用且昂贵的设备。此次试验根据《化学药品注射剂包装系统密封性研究技术指南(试行)》的研究原则和思路,开发了荧光剂–示踪液体法,以检查包装系统的密封完整性。以罗丹明B为示踪剂,采用高效液相色谱–荧光检测器法进行检测,评价利巴韦林滴眼液货架期密封性,模拟临床开启后的密封性。该方法无须专用的密封性测试设备,简单可靠,通用性强,能为滴眼剂产品的包装系统密封完整性检测提供有力的技术支持,目前国内尚无相关文献报道。
1 实验
1.1 材料与仪器
主要材料:罗丹明B(分析纯,批号C10788105,纯度100%),麦克林公司;甲醇(HPLC 级,批号201209),Fisher Chemical 公司;利巴韦林滴眼液(样品A、B、C 均为近效期产品),分别购自相关企业;实验用水为自制超纯水。
主要仪器:1100 型高效液相色谱仪(配荧光检测器),美国安捷伦公司;XS205DU 电子天平,德国梅特勒公司;Milli–Q Advantage A10 超纯水机,美国密理博公司。
1.2 方法
1.2.1 HPLC 色谱条件
以Waters Symmetry C18(250 mm×4.6 mm,5 μm)为色谱柱,流动相为甲醇–水溶液(V甲醇∶V水=65 ∶35 ),流速为1.0 mL/min,柱温为30 ℃,进样量为10 μL,激发波长为550 nm,发射波长为574 nm,PMT 增益为11。
1.2.2 对照品溶液的制备
取罗丹明B 约11 mg,精密称定,置于10 mL 容量瓶中,加超纯水稀释至刻度,摇匀,作为对照品贮备液(S0)。精密量取适量S0,用超纯水逐级稀释成系列浓度的对照品溶液(S1—S9):0.055、0.110、0.221、0.552、1.103、2.206、5.515、11.03、22.06 μg/mL。
1.2.3 供试品溶液的制备
1)阳性样品。取低密度聚乙烯滴眼液空瓶(样品C 包装),加入超纯水5 mL,在瓶塞及瓶盖处用快速透明万能胶(PP 胶)密封。在液面下方用外径0.45 mm的注射针垂直于表面扎孔,取内径为5 μm 的标准毛细管(已用扫描电子显微镜确认内径)穿过上述扎孔,用PP 胶密封毛细管与孔的空隙,待PP 胶凝滞不流动后,向外拔出部分毛细管,使滴眼剂瓶内露出的毛细管尽可能短,并确保毛细管不被堵塞,以此为标准阳性样。同法制备5、10、20 μm 3 种标准阳性样,各6 支。
2)阴性样品。取低密度聚乙烯滴眼液空瓶(样品C 包装),按照阳性样品的方法制备样品,堵塞毛细管,以此为阴性样品。
1.2.4 测试
将阳性样品和阴性样品置于装有罗丹明B 溶液的烧杯中(质量浓度约为1 mg/mL,已用0.45 μm 滤膜过滤),将液体浸没样品漏孔,置于正压箱中,加压至0.1 MPa,保持30 min,然后缓慢释压。取出样品,用超纯水洗涤样品表面,用滤纸吸干样品表面水分,振摇,使瓶内液体混匀。取瓶内液体,按1.2.1节色谱条件进样分析,记录色谱图。
2 结果与分析
2.1 加压测试方式的选择
为了使染料快速进入样品瓶内,通常采用抽负压或加正压的方式。在抽负压时,测试腔内压力降低,气体从瓶内转移至测试腔中,再将测试腔恢复常压,使样品瓶内的相对测试腔形成一定的真空度,从而促使测试腔中液体(如染料)进入样品瓶内。该方法通常耗时较长,尤其是当漏孔尺寸较小时,药品成分(如粉针剂、混悬制剂等)可能会在测试中堵塞漏孔,造成假阴性结果。文中采用加正压方式,将罗丹明溶液直接压入瓶内,有效避免了该风险。经验证,在加压时间为30 min 时能保证测试的有效性。
2.2 检测能力的验证
取空白溶剂(超纯水)、对照品溶液、阴性样品、不同孔径阳性样品分别进行测试。结果表明,空白溶剂、阴性样品在目标组的分出峰位置均无响应。在该条件下,5、10、20 μm 3 种阳性样品均能检测,检测限级别达到《化学药品注射剂包装系统密封性研究技术指南(试行)》中的3 级(见表1)。统计空白溶剂、阳性样品、阴性样品的峰面积,结果见表2,色谱图见图1。5 μm 阳性样品的照片见图2,可观察到明显的红色。

图1 样品色谱图Fig.1 Chromatogram of samples
图2 5 μm 孔径阳性样品照片Fig.2 Photograph of positive samples with 5 μm aperture

表1 气体泄漏率与泄漏孔径尺寸的关系Tab.1 Relationship between gas leakage rate and leakage aperture size
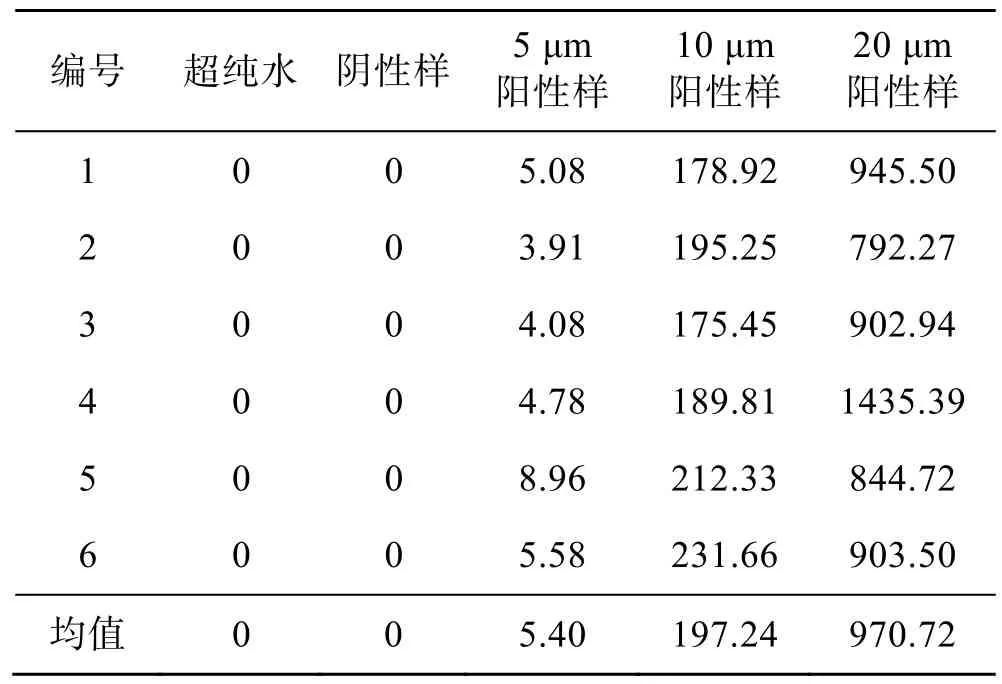
表2 样品测试峰面积Tab.2 Peak area of tested samples
2.3 线性范围和检测限
进样分析系列对照品溶液S1—S9,以主成分峰面积(Y)对浓度(X)进行线性回归,计算回归方程及相关系数。结果表明,罗丹明B 在测试浓度范围内线性关系良好,线性方程:Y=118.610 1X−2.432 0,相关系数为0.999 9。
将对照品溶液依次稀释,按照信噪比3 ∶1 计算检测限,按照信噪比10 ∶1 计算定量限,检测限为9.675 μg/L,定量限为32.249 μg/L。罗丹明B 的检测限浓度对应的峰面积为1.10,即峰面积大于该值视为检出,5、10、20 μm 3 种阳性样品均能被有效检出。
2.4 精密度
取对照品溶液S4,按照前述方法连续进样6 针,记录色谱图,计算待测组分的精密度。峰面积相对标准偏差为1.22%,该方法的精密度良好。
2.5 稳定性
取对照品溶液S4,按前述分析方法分别在0、81、99、207 h 时进样分析,考察溶液的稳定性,罗丹明B对照品溶液在207 h 内稳定,相对标准偏差为1.38%。
2.6 样品测试结果及分析
2.6.1 利巴韦林滴眼液阳性样品
由2.2 节的结果可知,以水为基质,测得5 μm阳性样的平均峰面积为5.40,测试样品时的实际基质为药液。采用3 种利巴韦林药液和水为溶剂,分别配制罗丹明B(质量浓度为500 ng/mL)样品。结果表明,此试验中罗丹明B 的响应在不同基质中无显著性差异,故以利巴韦林滴眼液(样品C)为溶剂,配制与以水为基质的5 μm 阳性样响应相当的溶液,作为利巴韦林滴眼液阳性样。6 份样品的峰面积均值为4.33,相对标准偏差为3.32%,此时罗丹明B 溶液的质量浓度为62.52 ng/mL。以利巴韦林滴眼液为溶剂时,对应的5 μm 阳性样的峰面积为4.33。通过测定供试品,如果对应峰面积小于该值,则视为样品无泄漏,包装系统密封性完整。
2.6.2 测定供试品
取3 批次样品各10 支,按1.2.4 节方法操作,考察货架期样品的密封完整性。另取3 批次样品各10支,模拟临床使用情况。反复开封5 次,每次挤出5滴后旋紧瓶盖,置于装有罗丹明B 的烧杯中(质量浓度约为1 mg/mL,已用0.45 μm 滤膜过滤)。采用相同方法制作样品,将其作为反复开封样品,考察多剂量滴眼液在实际使用过程中的密封完整性。
取货架期样品和反复开封样品,按1.2.1 节的色谱条件进样分析,并将所测结果与利巴韦林滴眼液5 μm阳性结果进行比较,见表3—4。以5 μm 漏孔为限度评价标准进行泄漏判定,结果表明,被测样品在有效期内的包装系统密封性良好,未检测到泄漏;反复开封后的样品出现了不同程度的泄漏。

表4 反复开封样品测试结果Tab.4 Test results of repeatedly opened samples
2.6.3 样品瓶设计对密封性的影响
各滴眼剂瓶样品具有不同的结构设计。此次实验考察了瓶身−瓶嘴一体式(样品A)、瓶身−瓶嘴分体式(瓶嘴管路直通型)(样品B)、瓶身−瓶嘴分体式(瓶嘴管路锥形)(样品C)3 种结构的样品。在开启前,由于瓶身−瓶嘴一体式样品(样品A)的瓶嘴和瓶身被完全密封(见图3),因此在理论上它具有最良好的密封性,但在具体使用过程中发现其开口尺寸受人为因素的影响较大,且瓶嘴以下药液流通管路内径迅速增大,样品开封后在加压过程中罗丹明B 溶液易进入瓶内。瓶身−瓶嘴分体式(瓶嘴管路直通型)样品(B)瓶内接近瓶嘴部分具有相同内径(见图4),相较于一体式设计降低了外界物质的侵入风险,但因采用分体式设计,瓶身与瓶嘴的配合性会影响其密封性。由于在瓶身−瓶嘴分体式(瓶嘴管路锥形)样品(C)的瓶口与瓶身衔接部位设计了一段锥形管路(见图4),孔径较小,在加压时罗丹明B 进入瓶内的阻力较大,因此未检测到泄漏,包装系统的密封性较好。此次测试的3 种不同设计结构样品,在未开封时均具有良好的密封完整性,但开启使用后的密封性显现出较大的差异:C>B>A。由此可见,药品生产企业在选择滴眼剂药包装材料时应关注结构设计对药液开启后密封性的影响。

图3 样品照片Fig.3 Photograph of samples

图4 瓶嘴照片Fig.4 Photographs of bottle mouth
3 结语
包装系统密封完整性检测最理想的情况是能进行全样品检测和样品全生命周期检测。根据《药品生产质量管理规范》(2010 版)和《化学药品注射剂包装系统密封性研究技术指南(试行)》的规定,熔融封口产品(如玻璃或塑料安瓿)应进行100%检漏试验,其他包装容器的密封性应根据操作规程进行抽样检查。玻璃或塑料安瓿等产品采用熔融封口工艺,不能精确控制其封口质量,在实践中通常需进行100%检漏试验。全样品密封性检查需要避免对样品引入污染和产生破坏,因此在选用检测方法时有较大的局限性,需要综合考虑。对于采用多剂量滴眼剂瓶等由多组件配合密封的产品,可通过模具和生产工艺精确控制组件尺寸及组件间的配合性,以保证包装系统的密封性,通过抽检即可保证密封性测试的有效性。
目前,针对包装系统密封性的检查多局限于出厂产品的包装密封性检测,对于需要反复开启的多剂量产品,其密封完整性能否得到保证,也应在产品设计时考虑,并进行验证。在采用文中方法进行反复开启密封性检查时,应保证样品在重新密封时的拧瓶盖圈数或扭矩保持一致,同时避免选用有磨损或变形的样品,避免产生假阳性结果。
阳性样品的制备是验证检测方法能力的关键,常用的方式为激光打孔。塑料橡胶材质包装材料具有一定弹性和收缩性,如果采用常规的激光打孔方式,则所制孔径大小不固定,与理论值的偏差较大。文中采用毛细管制备阳性样品,能够准确控制孔径尺寸,同时在实际操作中使毛细管的长度与样品瓶身的厚度基本保持一致。可供检查药品包装系统密封完整性的方法较多,但在具体推广中需要平衡考量检测灵敏度和使用成本。文中采用改进的色水法(荧光剂−示踪液体法),可准确检测低密度聚乙烯材质滴眼液包装系统中存在的5 μm 孔径泄漏,检测限级别达到相关技术指南的3 级,可有效评价利巴韦林滴眼液产品包装系统的密封完整性。该方法具有通用性强、灵敏度高等优点,对设备和人员的要求较低,为滴眼剂产品密封完整性检查和评估提供了新的检测方法参考。
