多光谱法探究壳聚糖与酪蛋白的结合作用
2023-06-15康柱闫焕周素珍范金波
康柱,闫焕,周素珍,2,3,范金波,2,3
(1.渤海大学 食品科学与工程学院,辽宁 锦州 121013;2.辽宁省食品安全重点实验室,辽宁 锦州121013;3.生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
壳聚糖(Chitosan,CS)作为天然生物大分子多糖,因具有特殊的氨基结构,故性质稳定[1]。CS 可作为食品保鲜剂应用在果蔬保鲜、肉制品保鲜以及水产保鲜[2-5];作为食品添加剂起到增稠、澄清的作用[6-7],还具有调节机体免疫力,改善胃肠道等功能[8-9];除此之外,在食品包装上也有所应用[10-11]。因此,CS在食品领域的研究与开发具有广阔的前景。
酪蛋白(Casein,CA)是牛乳中含量最丰富的蛋白质[12],其含有多种必需氨基酸,具有较高的营养价值[13]。因其具有良好的乳化性、保水性、溶解性和发泡性,已被成熟应用于肉制品、烘焙食品、人造奶油、干酪、饮料等食品的加工中[14]。除此之外,还可用作蛋白基载体来运输药物或多酚、黄酮类生物活性小分子[15]。
食品中添加多糖较为常见,多糖的添加不仅可以改善食品品质、风味,还可以延缓食品变质,延长货架期[16-19]。乳制品货架期一直是消费者关注的焦点,徐佳等[20]研究表明在乳饮料中添加少量黄原胶、β–葡聚糖等,可改善产品口感和外观,增强稳定性,延长货架期。Zielinska 等[21]研究表明将低聚果糖添加在发酵乳制品中,可提高该产品的感官黏度和质量,从而延长贮藏期。目前,在乳制品中多糖的应用较为广泛,但对研究CA–多糖相互作用机制及机理的报道较为少见,且CA–多糖的相互作用易受到pH、离子强度、电荷密度等因素影响[17]。因此,本文选用牛乳中含量最高的CA 与在食品领域应用广泛的CS 为研究对象,在3 种不同pH 值(7.4、5.2、3.0)条件下,探究CS 与CA 的结合作用,以及对CA 结构的影响,这对乳制品的贮藏和开发研究具有重要意义。
1 实验
1.1 材料与试剂
主要材料与试剂:酪蛋白(98 %),北京索莱宝科技有限公司;壳聚糖(分子质量≈30 000 u,纯度≥95%),酷尔化学科技(北京)有限公司;其他实验试剂均为分析纯。
1.2 仪器与设备
主要仪器与设备:F–7000 荧光分光光度计,日本日立高新技术公司;IRTracer–100 傅里叶变换红外光谱仪,岛津企业管理(中国)有限公司;PHS–25 pH计,仪电科学仪器(上海)股份有限公司。
1.3 方法
1.3.1 储备液的配制
称取一定量的酪蛋白和壳聚糖,配制2 mg/mL 的CA 储备液和8 mg/mL 的CS 储备液(溶于体积分数为1%的乙酸溶液),配制浓度为0.2 mol/L 的磷酸缓冲液。
1.3.2 荧光光谱
1.3.2.1 荧光光谱测定
向离心管中加入一定量的PBS 缓冲液,再加入30 μL CA 溶液,最后加入CS 溶液,使之充分反应30 min。最终离心管中体系的总体积为3 mL,CA 的质量浓度为0.02 mg/mL,CA 与CS 浓度比为1 ∶0、1 ∶9、1 ∶18 、1 ∶27 、1 ∶36 、1 ∶45 (6 个不同浓度比在图中分别以1—6 表示)。在298 K 和310 K 温度下,设置激发波长为280 nm,狭缝宽度为5.0 nm,扫描范围为290~500 nm 内的荧光发射光谱[22],并在3 种不同pH 值(7.4、5.2、3.0)条件下进行测量。
1.3.2.2 荧光猝灭机理和结合常数计算
本实验采用Stern–Volmer 方程(1)和Hill 方程(2)分析荧光猝灭机理[23]。
式中:F0和F为未加入和加入CS 时CS 的荧光强度峰值;[Q]为CS 在体系中浓度;τ0为荧光团的平均寿命(10−8s);Ksv为猝灭常数;Kq为生物分子猝灭速率常数;Ka为表观结合常数。
1.3.2.3 热力学性质分析
通过Van't Hoff 方程(3)和热力学方程(4)计算相关参数,分析其作用力类型[24]。
式中:R为气体常数,R=8.314 J/(mol·K);K1和K2为对应T1、T2的表观结合常数;ΔG为结合反应的吉布斯自由能变化;ΔS为熵变。
1.3.3 同步荧光光谱测定
样品配制方法同1.3.2.1 节,参考郝明皓[25]方法并做修改,在298 K 温度下,设置激发波长和发射波长间隔Δλ=60 nm 和Δλ=15 nm,测定样品在250~350 nm范围内同步荧光光谱。分别在3 种不同pH(7.4、5.2、3.0)条件下进行测量。
1.3.4 三维荧光光谱测定
固定CA 质量浓度为0.02 mg/mL,CS 质量浓度为0.36 mg/mL,设定激发波长为200~350 nm,发射波长为200~450 nm,在298 K 温度下,进行三维荧光光谱的测定[25]。分别在3 种不同pH(7.4、5.2、3.0)条件下进行测量。
1.3.5 傅里叶变换红外光谱测定
样品溶液配制方法同1.3.2 节,参考张超等[26]的方法,将反应完全的样品通过真空冷冻干燥制成粉末状固体,分别称取待测样品和KBr,使待测样品和KBr 质量比约为1 ∶100,混合均匀并进行充分研磨,制成待测薄片;放入傅里叶变换红外光谱仪中,设置扫描范围为400~4 000 cm−1,进行光谱扫描并记录。
1.4 数据处理
实验均重复3 次,实验数据表示为平均值±标准差;实验数据采用IBM SPSS Statistics 21 软件进行处理,使用Origin 2022 软件进行绘图。
2 结果与分析
2.1 荧光光谱分析
如图1 所示,在不同条件下,CS 对CA 均产生荧光猝灭效应,且在340 nm 附近出现荧光最大吸收峰。在298 K 时,3 种pH 条件下,CA 的荧光强度峰值分别降低了57.5%、61.9%和58.1%;当pH=7.4时,最大发射波长(λmax)发生微弱的红移;pH=5.2时,λmax红移6 nm(335~341);pH=3.0 时,λmax发生红移4 nm(336~340)。在310 K 时,CA 的荧光强度峰值分别降低了59%、61.7%和59.7%,且均发生红移;在相同pH 条件下,与298 K 相比较,λmax也发生轻微的变化。这说明pH 的变化,使二者相互作用的微环境发生改变,同时温度也改变了二者发生反应的微环境。由图1g、h 可知,随着CS 浓度的逐渐升高,猝灭率也随之增大,且pH=5.2 时猝灭率最高。

图1 pH 对CS 与CA 相互作用影响的荧光光谱Fig.1 Fluorescence spectra for the effect of pH on the interaction between chitosan on casein
2.2 荧光猝灭机理和结合常数
本文通过分析荧光猝灭机理,探究CS 与CA 之间的相互作用。荧光猝灭类型包括动态猝灭和静态猝灭,2 种方式均可以降低CA 的荧光强度[27-28]。本文采用方程(1)和方程(2)计算,并分析CS 与CA相互作用的荧光猝灭机理[29]。
由表1 可知,在同一pH 值条件下,在CA 中加入CS,Ksv与温度呈现负相关关系,但Kq均大于最大散射碰撞猝灭常数(2×1010M−1·s−1),说明CS 对CA 产生静态猝灭,且二者结合形成新的复合物。在pH=5.2 时,猝灭常数Ksv最大,与图1g、h 的结果一致。由Hill 方程计算出来的结合常数Ka都在103数量级,说明CS 与CA 的结合能力较强。在不同pH条件下,n均在1 左右,这表明CA 结构中至少有一个结合位点与CS 相结合[30],与前人的研究结果相一致[26]。R2的值越接近于1,说明数据越精确。
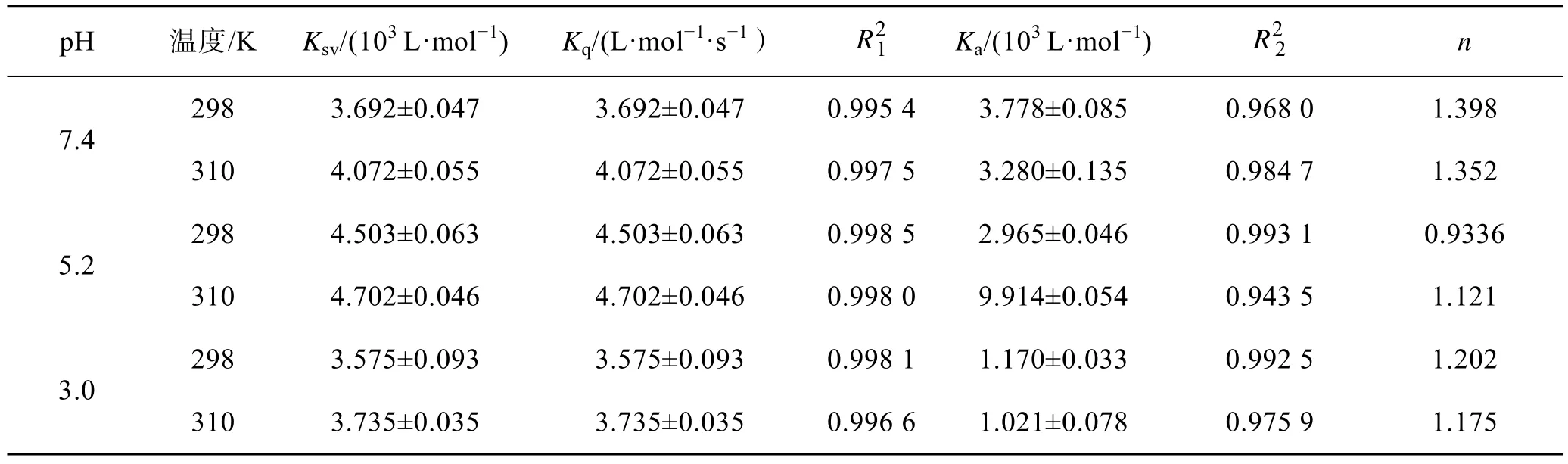
表1 CS 与 CA 相互作用的常数Tab.1 Constants for the interaction between chitosan and casein
2.3 热力学性质分析和作用力类型
当生物大分子与小分子相互作用时,主要通过氢键、范德华力、静电相互作用等作用力相连接[31-32]。本文通过Van't Hoff 方程(3)和热力学方程(4)来分析其反应的热力学性质和作用力类型[33-34]。
由表2、3 可知,ΔG<0,ΔS>0 说明CS 与CA 结合均为熵增加的自发反应。当pH=7.4 和pH=3.0 时,ΔH<0,说明在这2 个pH 条件下,该反应为放热反应,与表1 中随着温度升高Ka减小相呼应。由此可推断在此pH 条件下,静电相互作用为主要驱动力;在pH=5.2 时,ΔH>0,二者反应为吸热反应,可推断出二者通过疏水相互作用结合,与前人结果相一致[26]。在pH=5.2 时,热力学常数的方向发生变化,且pH=5.2更接近于CA 的等电点。由此可推断pH 值的变化影响了CA 与CS 结合的微环境。

表2 CS 与CA 相互作用的热力学参数Tab.2 Thermodynamic constants for interaction between chitosan and casein

表3 热力学常数与相互作用力的关系Tab.3 Relationship between thermodynamic constants and interaction forces
2.4 同步荧光光谱的分析
同步荧光光谱通过对荧光团氨基酸残基——酪氨酸(Tyr)和色氨酸(Trp)的微环境变化进行分析,判断蛋白质构象是否发生改变[35]。在同步荧光光谱中,Tyr 的微环境变化在Δλ=15 nm 处,Trp 的微环境变化在Δλ=60 nm 处[36]。本文通过同步荧光光谱中λmax的偏移情况,判断CA 构象是否发生改变。
如图2 所示,在pH=7.4 时,Tyr 和Trp 残基的λmax均发生轻微红移,说明对应氨基酸残基附近暴露的微环境的亲水性增强;当pH=5.2 时,λmax未发生明显变化;当pH=3.0 时,Trp 残基的λmax红移4 nm,这反映出Trp残基附近的微环境极性增强,更容易在环境中暴露;而Tyr 残基的λmax没有发生偏移。以上结果可推测出CS的存在和pH 值共同使CA 的构象发生了变化。

图2 温度为298 K 时,CS 与CA 相互作用的同步荧光光谱Fig.2 Synchronous fluorescence spectra of interaction between chitosan and casein at 298 K
2.5 三维荧光光谱分析
三维荧光光谱与荧光发射光谱相比,对CA 的荧光强度和峰的信息展示更全面、更直观。其中峰a 表示Trp 残基的光谱特征峰,峰b 反映的是CA 多肽骨架光谱变化[37]。
由图3 可观察出,当CS 加入后,峰a 和峰b 的荧光强度都发生了不同程度的降低。由表4 可知,加入CS 后,当pH=7.4 时,Trp 残基的光谱特征峰a 的λmax蓝移6 nm,荧光强度降低4.54%,峰b 的λmax红移3 nm,荧光强度降低了12.98%;当pH=5.2 时,峰a 的λmax蓝移5 nm,峰b 的λmax红移2 nm,荧光强度分别降低了17.72%和40.20%;当pH=3.0 时,峰a的λmax蓝移4 nm,峰b 的λmax红移4 nm,荧光强度分别降低6.75%和29.05%。pH=5.2 时猝灭效果最强,与前文发射荧光光谱中的结果相一致。以上结果表明在不同pH 条件下,与CA 三维荧光光谱相比,加入后CS,峰a 均发生明显蓝移,蛋白荧光基团残基微环境的非极性增强,且峰b 均发生不同程度红移,反映出蛋白荧光基团残基的微环境的亲水性增强。由此可推测,CS 的加入和pH 值的影响,使得CA 的构象发生改变。

表4 CA 和CA–CS 的三维荧光特征参数Tab.4 Three-dimensional fluorescence characteristic parameters of casein and casein-chitosan

图3 温度为298 K 时,CS 与CA 相互作用的三维荧光光谱Fig.3 Three-dimensional fluorescence spectra of interaction between chitosan and casein at 298 K
2.6 傅里叶变换红外光谱分析
傅里叶变换红外光谱可用来进一步研究蛋白质二级结构的变化。通常根据光谱中酰胺Ⅰ带(1 700~1 600 cm−1)和酰胺Ⅱ带(1 600~1 500 cm−1)的偏振情况,分析出蛋白质结构的变化,从而进一步说明蛋白质与配体发生了相互作用[38]。也可通过光谱中的酰胺A 带(3 400~3 300 cm−1)的改变来辅助说明[39]。
由图4 可知,CA 在酰胺Ⅰ带和酰胺A 带有较明显的特征吸收峰。在pH=7.4 的条件下,CA 与CS 发生作用后,酰胺Ⅰ带的峰位从1 688.94 cm–1偏移到1 653.49 cm–1;同时酰胺A 带的峰位从3 445.72 cm–1偏移到3 433.98 cm–1。pH=5.2 时,与pH=7.4 时相比,酰胺Ⅰ带的峰位从1 653.49 cm–1偏移到1 638.31 cm–1,且酰胺A 带也发生了偏移;当pH=3.0 时,酰胺Ⅰ带的峰位发生偏移,酰胺A 带未发生偏移。以上结果表明CA 的结构在与CS 结合后发生了变化,同时pH 值的变化也会影响CA 与CS 结合后的构象。
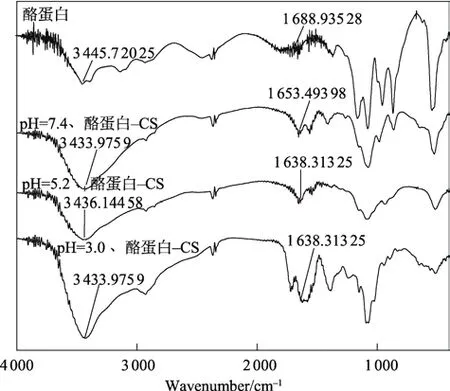
图4 温度为298 K 时,CS 与CA 相互作用的傅里叶变换红外光谱Fig.4 FTIR spectra of interaction between chitosan and casein at 298 K
3 结语
本文通过荧光光谱法、同步荧光光谱法、三维荧光光谱法以及傅里叶变换红外光谱法探究CA 与CS的相互作用,以及CS 的加入对CA 产生的影响。研究结果表明,在3 种pH 条件下,CS 的加入,使CA产生荧光猝灭现象。通过对荧光猝灭机理和热力学分析可知,该猝灭类型属于静态猝灭,二者通过静电相互作用结合。在pH=5.2 时,猝灭效果最为明显,这可能与CA 的等电点有关。同步荧光光谱和三维荧光光谱表明,CS 的加入和pH 值的影响改变了CA 的空间构象;傅里叶变换红外光谱中酰胺Ⅰ带和酰胺A 带的偏振情况表明CA 的结构发生了变化。实验结果表明,CS 的加入使得CA 的结构发生变化,同时,pH值的变化也影响到了二者的结合。这将为蛋白质–多糖的相互作用提供实验依据,对乳制品的贮藏及开发具有重要意义。
