重组牛碱性成纤维细胞生长因子对角膜内皮细胞密度低下患者白内障术后角膜内皮的保护作用△
2023-06-14刘忆南蔡宏媛陈晓勇
刘忆南 蔡宏媛 洪 晶 陈晓勇
白内障是一种严重影响视觉质量的眼科疾病,随着社会经济的发展,其手术率逐年上升[1]。白内障的手术方式分为囊外摘除、囊内摘除和超声乳化吸除等,后者以手术损伤小、操作时间短等优点,成为目前白内障手术的主流术式。但即便如此,超声乳化术仍难以避免对角膜内皮造成损伤。据报道,一次超声乳化所致角膜内皮细胞的丢失率为10.7%左右[2]。对于大部分患者,少量的角膜内皮细胞丢失并不影响术后的疗效,但对于角膜内皮细胞密度(ECD)低下的患者,存在术后角膜内皮失代偿导致不可逆角膜水肿的风险。
目前临床上并无确切有效的药物证实对角膜内皮细胞的修复有明确作用。而体外研究发现,重组牛碱性成纤维细胞生长因子(re-bFGF)能促进角膜内皮细胞的增殖[3]。我们将re-bFGF滴眼液应用于ECD低下的白内障患者,获得了较好的疗效,现报告如下。
1 资料与方法
1.1 一般资料前瞻性队列研究。选取2019年9月至2022年4月在北京大学第三医院眼科就诊、拟行超声乳化白内障吸除术且合并ECD低下的患者80例(90眼)为研究对象,本研究经北京大学第三医院伦理委员会批准[(2019)医伦审第(407-01)号],所有患者或代理人均已签署知情同意书。
1.2 纳入和排除标准纳入标准:(1)年龄60~80岁的白内障患者;(2)根据LOCS III晶状体混浊分类系统晶状体核分级为2~3级,拟行超声乳化白内障吸除术;(3) ECD为500~1500个·mm-2。排除标准:(1) 3个月内接受过内眼手术;(2)青光眼眼压控制不佳,非接触眼压>21 mmHg(1 kPa=7.5 mmHg);(3)角膜缘干细胞缺失;(4)有眼内植入物,如有晶状体眼人工晶状体、硅油等;(5)合并全身系统性免疫疾病,如类风湿等;(6)无法完成所有随访者。
1.3 分组方法采用随机数字表法将入组患者分为试验组41例 (45眼)和对照组39例(45眼)。试验组术后应用re-bFGF滴眼液(珠海亿胜生物制药有限公司),对照组术后应用1 g·L-1玻璃酸钠滴眼液(德国URSAPHARM Arzneimittel GmbH公司),均为每日4次滴术眼,均使用至术后6个月。此外,两组患者术后均接受常规抗炎治疗:10 g·L-1醋酸泼尼松龙滴眼液(爱力根爱尔兰制药公司)、5 g·L-1左氧氟沙星滴眼液(日本参天制药公司)、1 g·L-1双氯芬酸钠滴眼液(沈阳兴齐制药公司),均为每日4次滴术眼,每周递减1次至术后1个月停药。
1.4 手术方法所有手术均由同一位经验丰富的白内障专科手术医师操作,给予超声乳化白内障吸除联合人工晶状体植入术标准化治疗。手术应用Centurion超声乳化系统(美国爱尔康公司),参数设置如下:液流抽吸速度为40 mL·min-1,负压为400 mmHg,能量为50%,眼压85 cmH2O。采用正上方3.0 mm自闭性角巩膜缘切口,前房注入黏弹剂(DuoVisc黏弹剂,美国爱尔康公司)后连续环形撕囊,水分离晶状体皮质及核,超声乳化晶状体核,在注吸残余皮质后,植入TECNIS ZCB00 (美国强生全视公司)人工晶状体,水密切口。记录术中平均超声能量和有效超声时间。
1.5 检查指标所有患者均进行常规白内障术前及术后检查。术前和术后1个月、3个月、6个月分别使用前节OCT(Casia 2,Tomey,日本Nagoya公司)测量中央角膜厚度(CCT);使用共聚焦显微镜(Confoscan 4,意大利Nidek Technologies公司)观察角膜内皮细胞,同时记录角膜中央区及距离中心点 3 mm 的3点、6点、9点、12点钟位ECD,并对比分析。前节OCT和共聚焦显微镜检查均由同一位经验丰富的技术员完成。同时记录最佳矫正远视力(BCDVA)(转换为logMAR视力记录)和不良反应发生情况等。

2 结果
2.1 两组患者基线数据及术中数据比较试验组与对照组患者间年龄、性别、眼别、前房深度、晶状体核硬度分级、眼部合并症或病史相比,差异均无统计学意义(均为P>0.05)。试验组与对照组患者间术中平均超声能量和有效超声时间相比,差异均无统计学意义(均为P>0.05)(表1) 。
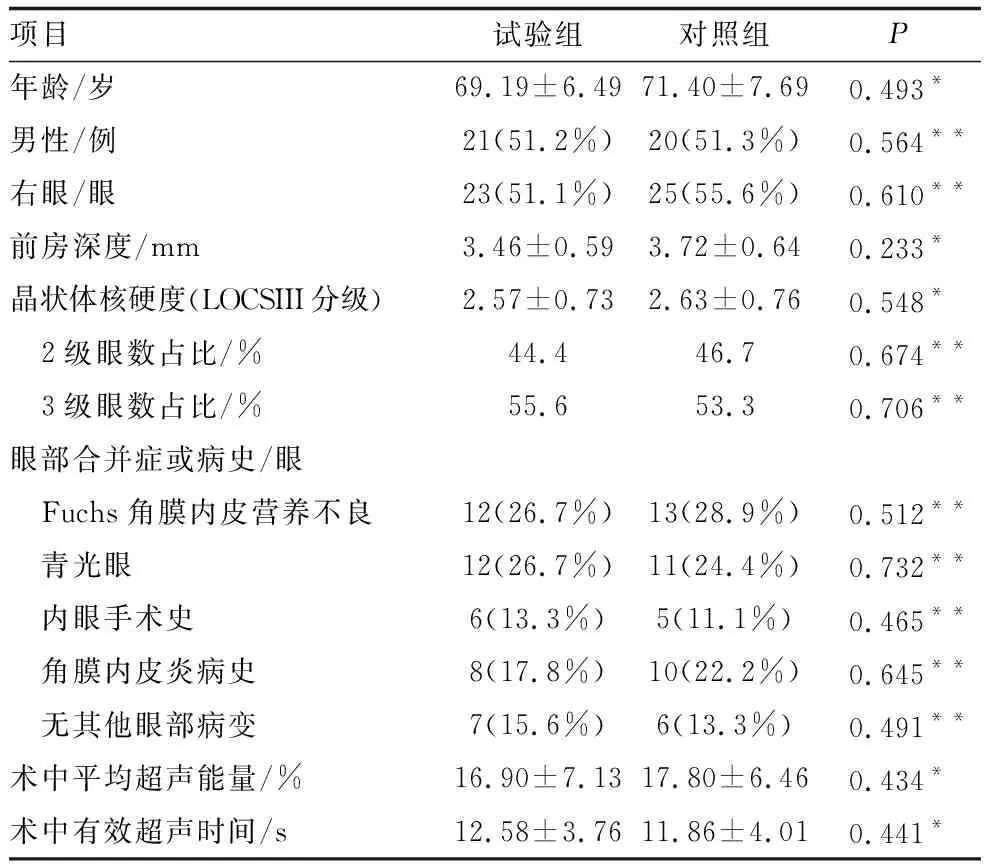
表1 试验组和对照组患者基线资料及术中参数比较
2.2 共聚焦显微镜检查结果共聚焦显微镜检查发现,试验组患眼术后不同时间角膜内皮细胞形态及密度均较术前变化不明显,对照组患眼术后角膜内皮细胞变大且大小不一,部分失去规则的正六边形形态(图1)。术后1个月、3个月、6个月试验组患眼的ECD均较术前变化不显著,差异均无统计学意义(均为P>0.05);对照组患眼术后各时间点ECD均较术前显著下降,差异均有统计学意义(均为P<0.05)。术后1个月、3个月、6个月试验组与对照组患眼的ECD相比,差异均有统计学意义(均为P<0.01)(表2)。

图1 试验组和对照组患眼术前及术后不同时间共聚焦显微镜检查结果 试验组患眼术后不同时间角膜内皮细胞形态及密度均较术前变化不明显,对照组患眼术后角膜内皮细胞变大且大小不一,部分失去规则的正六边形形态。
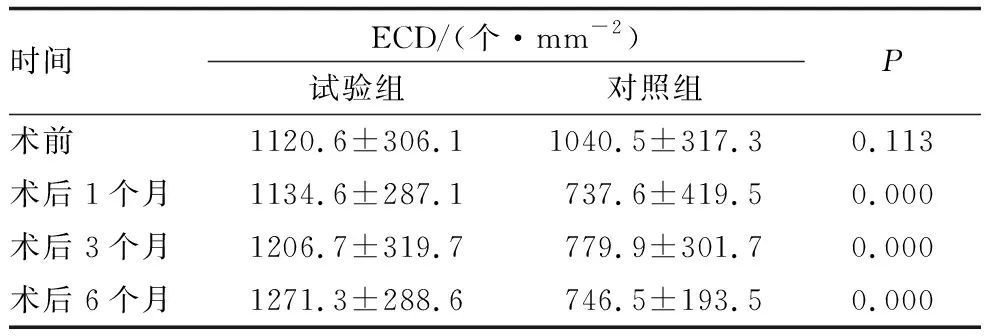
表2 试验组和对照组患眼术前及术后不同时间ECD
2.3 前节OCT检查结果前节OCT检查可见,对照组患眼术后1个月开始出现显著的角膜基质水肿伴后弹力层皱褶,而试验组患眼未见明显的角膜水肿(图2)。术后1个月、3个月、6个月,对照组患眼的CCT均较术前升高,差异均有统计学意义(均为P<0.05);试验组患眼术后各时间点CCT均较术前变化不明显,差异均无统计学意义(均为P>0.05)。术后3个月和6个月,试验组患眼CCT均显著低于对照组,差异均有统计学意义(均为P<0.05)(表3)。
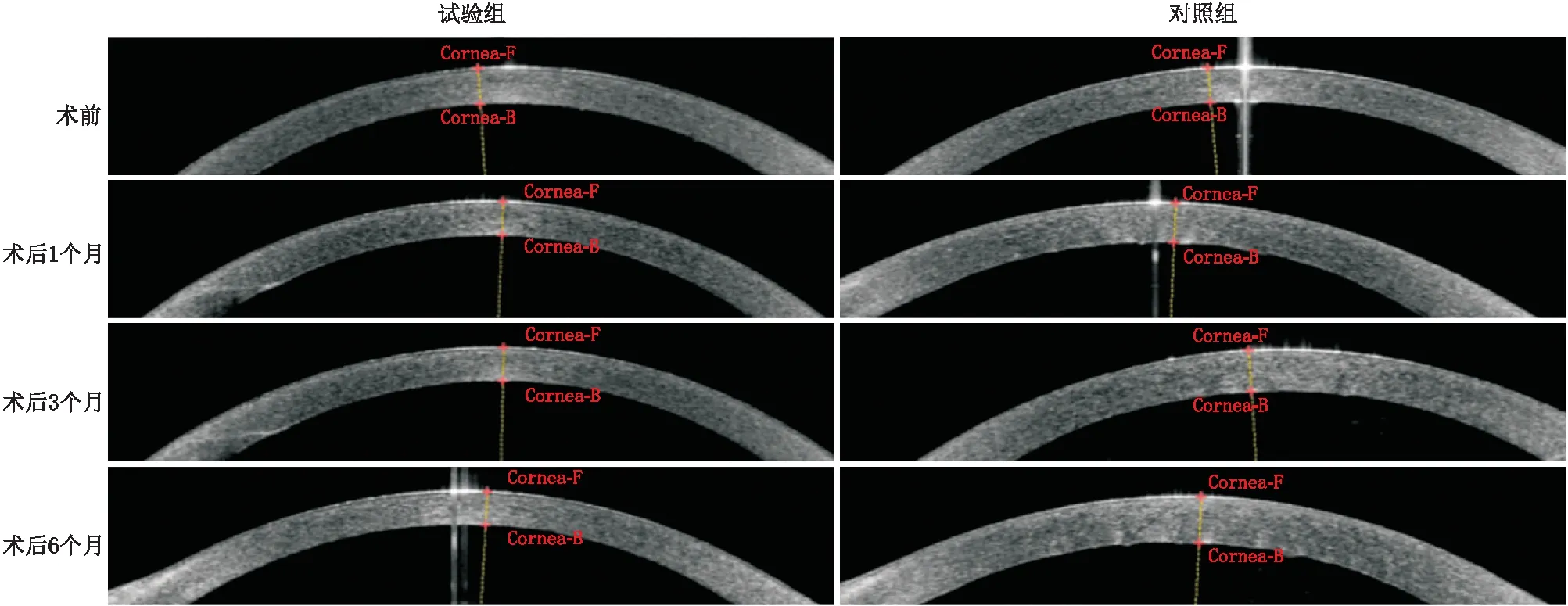
图2 试验组和对照组患眼术前及术后不同时间前节OCT检查结果 试验组患眼术后CCT较术前变化不显著,对照组患眼自术后1个月起,CCT较术前显著增厚。对照组患眼术后出现明显的角膜后弹力层皱褶和角膜基质水肿。
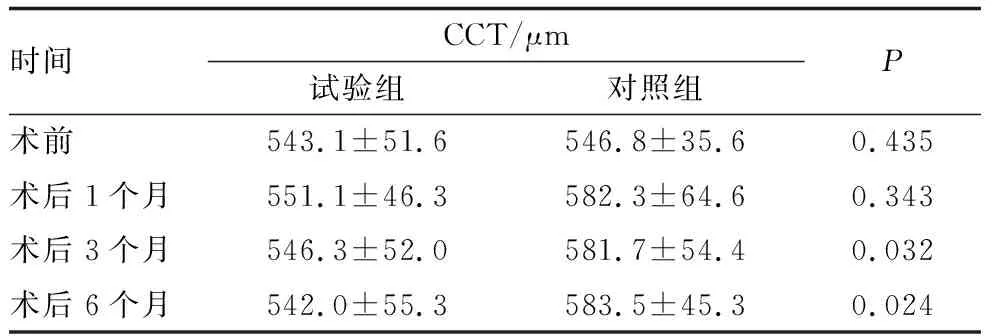
表3 试验组和对照组患眼术前及术后不同时间CCT
2.4 并发症及BCDVA本研究90眼中,88眼(97.8%)术后6个月内未发生角膜内皮失代偿,对照组2眼分别于术后5个月和术后6个月发生角膜内皮失代偿,2眼均行角膜内皮移植术治疗。术后1个月、3个月、6个月试验组和对照组患眼的BCDVA(logMAR)相比差异均无统计学意义(均为P>0.05)(表4)。

表4 试验组和对照组患眼术前及术后不同时间BCDVA
3 讨论
角膜内皮细胞位于角膜最内层,是由神经嵴产生的单层扁平六角形细胞,健康的角膜内皮在房水和角膜基质之间起到物理屏障作用,能够防止过多的房水进入角膜基质从而预防角膜水肿的发生。成人ECD约为3000个·mm-2,且随着年龄增长逐年减少。在正常生理情况下,包括人类在内的绝大多数灵长类动物的内皮细胞属于分化末端的终末细胞,不具备再生能力,因为内皮细胞间有接触抑制作用,同时房水中的转化生长因子-β2(TGF-β2)对细胞周期有抑制作用,使得角膜内皮细胞始终停留在G1期。故角膜内皮细胞一旦出现病理损伤,因其无法再生,周围的内皮细胞会水平延展来修补内皮细胞的缺损,导致内皮细胞密度下降。当人ECD下降到约500个·mm-2时,会出现大泡性角膜病变和内皮功能失代偿,导致视力严重下降。对于角膜内皮失代偿导致的大泡性角膜病变,目前临床上尚无有效的治疗药物,角膜内皮移植术是唯一有效的治疗方式。但是,因为角膜供体的来源严重不足,而大大限制了角膜内皮移植的临床应用。
目前临床上推荐的白内障超声乳化术前ECD为1500个·mm-2以上[4-6]。然而近年来,白内障术前检查逐渐精细化,很多角膜内皮疾病的早期患者是在做白内障术前检查时被确诊的,他们中有相当一部分患者的ECD不足1500个·mm-2,相当于处在传统观点认为的白内障超声乳化手术危险区。但是随着白内障超声乳化技术的进步,“1500个·mm-2以下”已不再是超声乳化手术的绝对禁区。对于这部分患者,如何在白内障术中和术后保护角膜内皮,帮助患者安全地完成手术和术后恢复,是目前研究的热点。现阶段比较公认的减少白内障手术对角膜内皮损伤的方法包括:术前控制影响角膜内皮状态的全身疾病——糖尿病[7];手术中合理应用低分子量和高分子量黏弹剂的“软壳技术”[8];以及调整白内障术中超声乳化流体动力学的参数设置等[9-10]。
在保护角膜内皮的白内障术后用药方面,研究主要集中在Rho激酶(ROCKs)上。Okumura等[11]发现,体外培养的人角膜内皮细胞培养基中加入ROCKs抑制剂,可以促进角膜内皮细胞的生长并维持其正常的六边形形态,同时在体研究中发现,ROCKs抑制剂可以激发灵长类动物角膜冻伤模型的内皮细胞增殖并恢复正常六边形形态[12]。然而,在眼科领域中,ROCKs抑制剂类药物的研究仍处在临床前期,至今并未上市。
目前,临床上并无确切有效的药物证实对角膜内皮细胞的修复有明确作用。而针对角膜上皮细胞修复的药物却较多,其中疗效确切的药物之一为re-bFGF。re-bFGF是一种多肽类的生长因子,和ROCKs类似,re-bFGF对细胞的生物学功能也具有广泛的调控作用。有研究发现,re-bFGF能激活神经外胚层和中胚层来源的细胞,促进其增殖,所以re-bFGF除了在神经损伤的修复方面有巨大潜力[13]之外,还能够促进角膜上皮细胞和内皮细胞的增生[3,14]。此外,re-bFGF可以维持体外培养的角膜内皮细胞的生物学特性,适用于离体角膜的贮存[15]。在临床治疗方面,有研究表明,利用re-bFGF滴眼液治疗可以显著缩短白内障手术引起的角膜水肿时间,并促进角膜切口愈合[16-17]。
本研究结果显示,试验组患眼术后ECD与术前相比差异无统计学意义(P>0.05),对照组患眼术后1个月、3个月、6个月ECD均较术前下降,差异均有统计学意义(均为P<0.05)。角膜内皮细胞的丢失导致了角膜水肿的发生,所以可以看到对照组患眼术后1个月、3个月、6个月CCT均较术前显著增高(均为P<0.05)。此外,术后随访6个月,90眼中有2眼发生了角膜内皮失代偿的严重并发症,且均发生在对照组。以上结果均说明,re-bFGF对白内障术后的角膜内皮细胞具有保护作用,可减少超声乳化白内障吸除术造成的ECD下降和术后角膜水肿的发生。探究其作用机制,既往体外研究发现,re-bFGF是一种高效的促角膜内皮细胞分裂剂[18]。re-bFGF可以选择性地和角膜内皮细胞中的re-bFGF受体结合,通过磷酸化依赖机制降解周期蛋白依赖性激酶抑制剂p27Kip1,从而促进磷脂酰肌醇3激酶的激活,使角膜内皮细胞突破G1期进入增殖期[19]。re-bFGF对基底膜和细胞外基质具有良好的亲和性,在对兔角膜切片的研究中发现,re-bFGF可以在角膜前弹力层、后弹力层、角膜基质以及角膜缘血管基底膜吸附沉积[20]。但是,因为完整的角膜上皮具有对re-bFGF的屏障作用,re-bFGF在角膜中的穿透性较差,很难到达角膜内皮层和房水中,所以难以和角膜内皮细胞发生作用。本研究白内障术中在角膜缘做了两个穿透性切口,沟通了角膜内外表面,为滴眼液中re-bFGF向前房内的转运提供了有利条件。同时有研究发现,白内障术后的14 d内,角膜上皮发生改建,术后3 d内角膜上皮水肿增厚,>3~7 d逐渐变薄,>7~14 d才逐渐恢复至术前的厚度[21]。在术后角膜上皮改建期内,其屏障作用可能会发生改变,从而可能增加对re-bFGF的通透性,为re-bFGF向角膜内皮层的转运提供了条件。
本研究的不足之处在于:(1)由于临床上角膜内皮细胞数量低于1500个·mm-2且眼部无其他严重疾病的患者总量较少,本研究的样本量相对较少,后期可继续增大样本量观察临床效果;(2)由于ECD随年龄不断衰减,在本身存在角膜内皮病变的患者中衰减速度更快,而本研究随访时间仅为术后6个月,所以术后re-bFGF滴眼液对角膜内皮细胞的远期保护作用仍有待研究。
综上所述,re-bFGF滴眼液对合并ECD低下患者行超声乳化白内障吸除术后的角膜内皮有保护作用,可减轻超声乳化手术造成的ECD下降,减少角膜水肿及术后短期角膜内皮失代偿等严重并发症的发生率,为临床上此类患者术后无药可用的困境找到一种可行的药物解决方案。
