基于JAK2/STAT3通路分析姜黄素对视网膜缺血-再灌注损伤大鼠视网膜小胶质细胞极化的影响△
2023-06-14赵玉泽王晨旭肖培伦李晓双王晓莉赵岩松
尹 伊 徐 莹 赵玉泽 王晨旭 肖培伦 李晓双 王晓莉 赵岩松
视网膜缺血-再灌注损伤(RIRI)是眼科常见的一种病理生理过程,其与急性闭角型青光眼、早产儿视网膜病变等疾病的发病机制密切相关[1]。小胶质细胞有M1型(促炎型)和M2型(抑炎型)两种激活状态[2]。有研究报道[3-5],脑缺血后大鼠脑组织中JAK2/STAT3信号通路被激活,加重脑缺血后炎症反应。Wang等[4]研究发现,姜黄素(CUR)可通过血脑屏障,有效减少脑损伤后激活的M1型小胶质细胞数量,且可促进M2型小胶质细胞极化,减轻缺血性脑卒中诱发的脑损伤,推测CUR可通过JAK2/STAT3信号通路调控小胶质细胞极化,进而减轻RIRI。因此,本研究通过高眼压法建立大鼠RIRI模型,观察CUR对RIRI大鼠视网膜小胶质细胞M1/M2极化的影响,并从JAK2/STAT3信号通路探讨其机制,为CUR的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组处理健康雄性成年Sprague Dawley大鼠(购自济南朋悦实验动物繁育有限公司)36只,体重200~220 g。实验前将大鼠随机分为假手术(Sham)组、RIRI组与CUR组,每组各12只。其中,RIRI组和CUR组大鼠采用高眼压法建立大鼠RIRI模型,Sham组仅将针头刺入大鼠右眼前房,不升高眼压。CUR组于造模前30 min腹腔注射CUR(100 mg·kg-1),RIRI组和Sham组腹腔注射等剂量生理盐水。实验动物操作均符合国家科学技术委员会制定的《实验动物管理条例》,且已获得潍坊医学院动物伦理委员会批准(批号:2019SDL099)。
1.1.2 主要试剂CUR粉末(美国MCE公司);兔抗Iba-1抗体(日本Wako公司);鼠抗Arg1抗体、鼠抗GAPDH抗体(武汉Proteintech Group公司);鼠抗Iba-1抗体(美国Santa Cruz公司);兔抗CD16抗体、兔抗p-STAT3抗体、兔抗STAT3抗体、兔抗JAK2抗体、兔抗p-JAK2抗体(江苏Affinity Biosciences公司);山羊抗兔二抗试剂盒、山羊抗小鼠二抗试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);HE染色试剂盒(北京Solarbio有限公司)。
1.2 方法
1.2.1 RIRI模型的建立采用前房高眼压法建立大鼠右眼RIRI模型[6]。10 g·L-1戊巴比妥钠腹腔注射麻醉大鼠,盐酸奥布卡因滴眼液局部麻醉,针头沿右眼颞侧角膜缘刺入前房并固定,升高生理盐水瓶,使眼压增加至110 mmHg(1 kPa=7.5 mmHg),此时,大鼠前房加深,球结膜苍白,直接检眼镜下发现大鼠眼底苍白;持续60 min后拔除针头,视网膜血流恢复,造模成功,滴加抗生素眼液预防感染。
1.2.2 标本的采集及石蜡切片的制作造模后24 h,各组随机选取6只大鼠腹腔注射10 g·L-1戊巴比妥钠麻醉后处死,完整取出右眼球,固定液中固定约24 h,梯度乙醇脱水,二甲苯透明,浸蜡包埋,平行于视神经矢状轴切片,制成厚4 μm的石蜡切片。
1.2.3 HE染色石蜡切片脱蜡至水,苏木素液染色10 min,去离子水冲洗,分化液分色后,去离子水冲洗,伊红染色2 min,乙醇脱水,二甲苯透明,中性树胶封片,在光学显微镜下观察各组大鼠视网膜形态学变化,计数视网膜单位面积内神经节细胞层(GCL)中视网膜神经节细胞(RGC)数量并测量内层视网膜厚度(内层视网膜厚度为从内界膜到内核层的距离),测量3次,取平均值记录。
1.2.4 免疫组织化学染色石蜡切片脱蜡至水,抗原修复,体积分数3% H2O2中37 ℃孵育 30 min。50 g·L-1牛血清白蛋白(BSA)-磷酸盐缓冲液(PBS)封闭后,分别加入兔抗JAK2抗体(1180)、兔抗p-JAK2抗体(1180)、兔抗STAT3抗体(1200)、兔抗p-STAT3抗体(1180)、鼠抗 Brn-3a抗体(1100),4 ℃冰箱过夜;37 ℃组织复温,滴加二抗试剂,37 ℃孵育60 min,滴加适量试剂3(增强酶标羊抗兔IgG聚合物),DAB显色,苏木素染核,梯度乙醇脱水,二甲苯透明,中性树胶封片。正置光学显微镜下观察、拍照并计数视网膜单位面积内GCL及内核层(INL)p-JAK2+、p-STAT3+细胞数,以及GCL中Brn-3a+细胞数。
1.2.5 免疫荧光双标染色石蜡切片脱蜡至水,抗原修复,体积分数0.3% TritonX-100透膜,体积分数5% BSA-PBS 37 ℃条件下封闭孵育,依次滴加兔抗Iba-1抗体(1150)、鼠抗Arg1抗体(1200)或鼠抗Iba-1抗体(1150)、兔抗CD16抗体(175),4 ℃冰箱过夜;37 ℃组织复温,滴加二抗(1200)试剂,避光37 ℃孵育,含DAPI荧光防淬灭剂封片。荧光显微镜下观察、拍照并计数视网膜单位面积GCL及INL中M1型小胶质细胞(即Iba-1+CD16+细胞)及M2型小胶质细胞(即Iba-1+Arg1+细胞)的个数。
1.2.6 Western blot检测造模后24 h,将剩余6只大鼠腹腔注射麻醉后,摘除右眼眼球并分离视网膜组织,称重,加入RIPA组织细胞裂解液,破碎后离心静置取上清液,测定蛋白浓度。制备100 g·L-1分离胶和50 g·L-1浓缩胶,进行电泳、转膜、脱脂奶粉封闭,加入兔抗STAT3抗体(12000)、兔抗p-STAT3抗体(12000)、兔抗JAK2抗体(12000)、兔抗p-JAK2抗体(12000)、鼠抗GAPDH抗体(110 000),4 ℃冰箱孵育过夜。次日,将目的条带置入山羊抗兔或山羊抗鼠二抗(11000)试剂中,高性能成像系统曝光、拍照。应用ImageJ软件对蛋白条带进行灰度值分析,以目的条带与内参GAPDH条带灰度值的比值作为目的蛋白相对表达量。
2 结果
2.1 CUR可减轻大鼠RIRIHE染色结果显示,Sham组大鼠视网膜组织各层细胞排列整齐,细胞形态规则,视网膜厚度适中,可见较多神经节细胞;造模后24 h,RIRI组大鼠视网膜组织各层细胞排列松散紊乱,出现视网膜严重水肿,内层视网膜厚度显著增加,RGC数显著减少;CUR组大鼠再灌注后24 h视网膜各层细胞排列较为规整,内层视网膜厚度较RIRI组变薄,且GCL中RGC数较RIRI组显著增多(均为P<0.05)(图1、表1)。

表1 造模后24 h各组大鼠RGC数及内层视网膜厚度
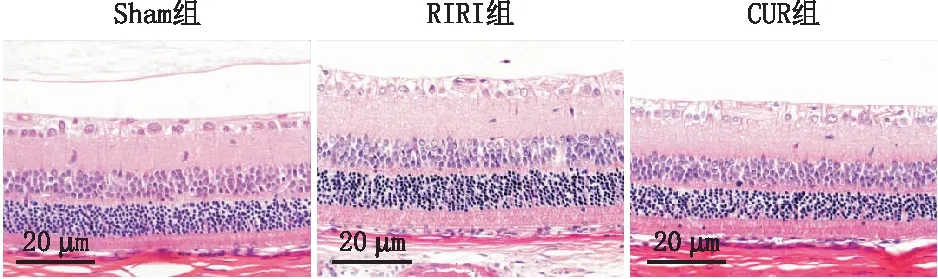
图1 HE染色示造模后24 h各组大鼠视网膜组织形态
免疫组织化学染色结果显示,Sham组大鼠视网膜GCL见大量Brn-3a+细胞,为(470.23±36.94)个·mm-2;与Sham组相比,造模后24 h,RIRI组大鼠Brn-3a+细胞数[(300.78±61.56)个·mm-2]显著减少,而CUR组大鼠视网膜Brn-3a+细胞数[(380.49±44.62)个·mm-2]显著多于RIRI组(均为P<0.05)(图2)。
2.2 免疫荧光双标染色结果Iba-1是小胶质细胞表面标记物,CD16是M1型小胶质细胞特异性表面标记物,Arg1是M2型小胶质细胞特异性表面标记物,因此,Iba-1/CD16免疫荧光染色法可双重标记M1型小胶质细胞,Iba-1/Arg1免疫荧光染色法可双重标记M2型小胶质细胞。免疫荧光双标染色结果显示,Sham组大鼠视网膜组织偶见少量Iba-1+CD16+细胞,为(103.69±19.01)个·mm-2;造模后24 h,RIRI组大鼠视网膜Iba-1+CD16+细胞数[(285.26±48.12)个·mm-2]增加,显著高于Sham组;CUR组大鼠视网膜Iba-1+CD16+细胞数[(201.39±29.53)个·mm-2]较Sham组增加,但显著少于RIRI组(均为P<0.05)。Sham组大鼠视网膜GCL及INL中偶见少量Iba-1+Arg1+细胞,为(143.90±39.87)个·mm-2;RIRI组大鼠视网膜Iba-1+Arg1+细胞数[(231.26±60.35)个·mm-2]增加,显著高于Sham组; CUR组大鼠视网膜Iba-1+Arg1+细胞数[(336.46±53.78)个·mm-2]增加,且显著高于RIRI组(均为P<0.05)(图3)。
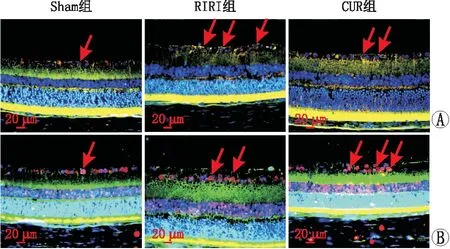
图3 免疫荧光双标染色示各组大鼠视网膜小胶质细胞极化情况 A:Iba-1+CD16+细胞(箭头);B:Iba-1+Arg1+细胞(箭头)。
2.3 各组大鼠视网膜p-STAT3、p-JAK2蛋白表达的变化免疫组织化学染色结果显示,p-STAT3、p-JAK2阳性细胞的细胞浆、细胞核均呈棕黄色染色,主要表达于各组大鼠视网膜GCL和INL中。Sham组大鼠视网膜偶见p-STAT3+、p-JAK2+细胞,分别为(204.21±40.65)个·mm-2、(131.49±29.09)个·mm-2;与Sham组相比,RIRI组大鼠视网膜p-STAT3+、p-JAK2+细胞数[(433.30±63.00)个·mm-2、(317.46±53.60)个·mm-2]显著增多,CUR组大鼠视网膜p-STAT3+、p-JAK2+细胞数[(345.59±43.96)个·mm-2、(199.30±49.18)个·mm-2]较Sham组增多,但仍少于RIRI组(均为P<0.05)(图4)。
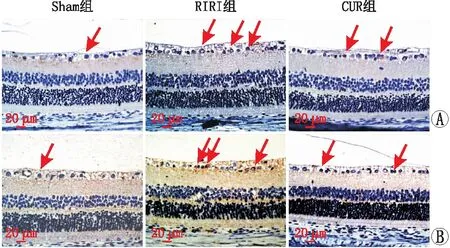
图4 免疫组织化学染色示造模后24 h各组大鼠视网膜p-STAT3、p-JAK2蛋白表达 A:p-STAT3+细胞(箭头);B:p-JAK2+细胞(箭头)。
Western blot检测结果显示,Sham组大鼠视网膜p-JAK2和p-STAT3蛋白表达微弱;造模后24 h,RIRI组大鼠视网膜p-JAK2和p-STAT3蛋白表达较Sham组明显升高,CUR组较RIRI组明显下降,但仍高于Sham组(均为P<0.05)(图5)。
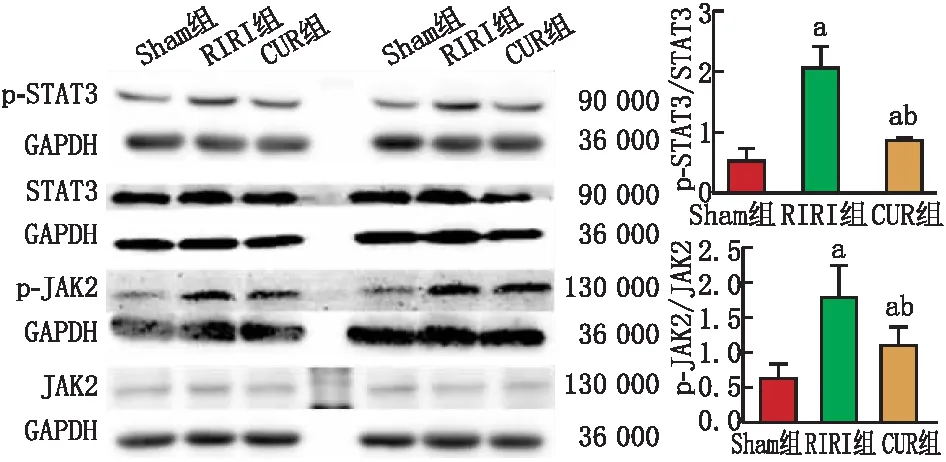
图5 Western blot检测示造模后24 h各组大鼠视网膜p-STAT3、p-JAK2蛋白表达 与Sham组比较,aP<0.05;与RIRI 组比较,bP<0.05。
3 讨论
临床上急性视网膜缺血后,在有限的治疗时间窗内,缺血再通虽然可挽救濒死的RGC,但缺血再灌注后视网膜微环境失衡,小胶质细胞活化,调控炎症介质的分泌,往往导致RIRI,是目前眼科致盲的主要原因及亟待解决的科学问题。已有研究发现,RIRI后24 h视网膜损伤最为严重,JAK2/STAT3信号通路在大鼠RIRI过程中起着至关重要的作用,该通路激活后在24 h达到高峰[7]。本研究通过前房高眼压法建立大鼠RIRI模型,并采用HE染色及Brn-3a免疫组织化学法观察视网膜厚度并比较RGC数以鉴定模型。本研究发现,造模后24 h,大鼠视网膜水肿,内层视网膜增厚,且RGC数减少;免疫组织化学结果进一步证明RIRI大鼠视网膜GCL中Brn-3a+数减少,提示大鼠RIRI模型建立成功。
小胶质细胞是视网膜神经细胞损伤的第一反应细胞,参与视网膜的损伤修复和炎症状态。在激活状态下,小胶质细胞主要位于视网膜GCL和INL,其作用靶点主要为RGC。视网膜缺血后,RGC破坏,小胶质细胞由静息状态变为活化状态[8-9],激活的小胶质细胞在视网膜局部缺氧微环境的作用下发生极化,加重视网膜损伤。CUR具有抗炎、抗氧化、抗血管生成及抗凋亡等多种生物学效应[10-12]。近年来研究表明,CUR治疗有助于维持血脑屏障的完整性和稳定性,可有效抑制脑缺血再灌注损伤诱导的M1型小胶质细胞激活,并促进M2型小胶质的极化,从而减少缺血性脑卒中诱发的脑损伤[4-5]。研究表明,CUR干预可通过抑制小鼠视网膜小胶质细胞的激活而延缓视网膜变性[13]。本研究发现,CUR干预后,RIRI大鼠视网膜水肿减轻,RGC数增加,提示CUR对大鼠RIRI具有神经保护作用,这与文献[4-5,13]报道一致;本研究分别采用Iba-1/CD16、Iba-1/Arg1免疫荧光双标法双重标记小胶质细胞M1及M2表型,结果发现,CUR干预后,RIRI大鼠视网膜Iba-1+CD16+细胞(小胶质细胞M1型)数减少,而Iba-1+Arg1+细胞(小胶质细胞M2型)数增多,提示CUR干预可通过抑制M1型小胶质细胞极化、促进M2型小胶质细胞极化减轻大鼠RIRI,起到神经保护作用,但CUR调控小胶质细胞的机制尚有待于进一步研究。
JAK/STAT与缺血、缺氧和氧化应激等应激反应密切相关,由 JAKs 蛋白家族(JAK1、JAK2、JAK3、 TYK2) 和 STATs蛋白家族(STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6)组成[14-16]。研究表明,JAK/STAT信号转导途径参与脑缺血等中枢神经系统疾病的病理生理过程[15]。JAKs被激活后发生磷酸化,STATs作为潜伏在细胞质中的转录因子,其含有的酪氨酸残基可被JAKs磷酸化,磷酸化的STATs发生核转位,与目的基因结合从而启动转录[14-15],参与疾病的发生[17]。JAK2/STAT3信号通路与小胶质细胞极化密切相关[18],但CUR干预调控小胶质细胞极化是否与JAK2/STAT3信号通路有关尚不清楚。研究表明,CUR干预可通过JAK/STAT通路发挥抗肿瘤细胞活性[19-20],还可以调控JAK2/ STAT3,减轻心肌缺血再灌注损伤,且CUR干预对脑缺血损伤具有神经保护作用,其机制可能亦与JAK2/STAT3信号通路有关[3,21]。近年来,CUR在视网膜疾病中的应用成为当前研究的热点。研究发现,CUR可通过上调p-STAT3减轻RIRI后视网膜神经元和微血管损伤[22]。而JAK2/STAT3信号通路与小胶质细胞极化密切相关[18],且CUR干预可调控小胶质细胞极化,推测CUR对RIRI大鼠视网膜小胶质细胞的保护作用可能与JAK2/STAT3通路有关。本研究采用免疫组织化学结合Western blot的检测方法,发现CUR干预后,大鼠视网膜组织中p-JAK2、p-STAT3蛋白的表达均下调,由此推测,CUR调控小胶质细胞极化、减轻大鼠RIRI的机制可能与JAK2/STAT3通路的激活有关。
综上所述,CUR可抑制RIRI大鼠视网膜小胶质细胞M1型极化,促进其M2型极化,从而减轻大鼠RIRI,具有神经保护作用,其机制可能与下调JAK2/STAT3信号通路有关,从而为CUR的临床应用提供科学的理论依据。CUR如何下调JAK2/STAT3信号通路,进而调控RIRI大鼠视网膜小胶质细胞极化的机制尚有待于进一步研究。
