异常糖链糖蛋白联合血清肿瘤标志物对非小细胞肺癌的早期诊断价值
2023-06-13薛漓丁好石婧奇
薛漓,丁好,石婧奇
非小细胞肺癌(NSCLC)一般是由肺泡上皮或支气管黏膜上皮细胞异常增殖后诱发的恶性癌变,在肺癌中占比超过80%,严重威胁患者的生命安全[1-2]。目前临床治疗NSCLC 早期患者可通过手术切除病灶,有效延长其生存周期,甚至治愈[3-4]。但由于NSCLC 早期并不具备特有的临床典型特征,且NSCLC 早期诱发的呼吸系统症状极易与肺结核、肺纤维瘤等良性病变混淆,因此提高NSCLC 早期筛选率成为目前改善患者预后的重要研究方向[5-6]。相关研究表明,异常糖链糖蛋白(TAP)可在一定程度上反映肿瘤细胞新陈代谢水平[7]。神经元特异性烯醇化酶(NSE)、细胞角蛋白19 片段(CYFRA21-1)、癌胚抗原(CEA)、糖类抗原125(CA125)等血清肿瘤标志物均在NSCLC 患者中检测异常[8-9]。基于此,为进一步提高NSCLC 患者的早期检出率,笔者选取NSCLC 患者进行研究,以分析TAP 联合血清肿瘤标志物对NSCLC 的早期诊断价值,为后续研究提供数据参考。
1 资料与方法
1.1 研究资料
回顾性分析南通市中医院2019 年1 月至2021 年10 月收治的80 例NSCLC 患者的病历资料,为NSCLC 组,年龄48~79 岁[(61.54 ± 3.09)岁];女34 例,男46 例;病理组织分型中鳞癌33 例,腺癌42 例,鳞腺癌及其他5 例;TNM[T(肿瘤原发灶的情况,tumor),N(区域淋巴结受累情况,node),M(远处转移,metastasis)]分期中Ⅰ期7 例,Ⅱ期26 例,Ⅲ期34 例,Ⅳ期13 例。纳入标准:(1)均符合《中华医学会肺癌临床诊疗指南(2019 版)》[10]中NSCLC 的临床诊断,且经病理学及影像学等检查确诊;(2)均为首次确诊;(3)卡氏评分(KPS)>60 分;(4)年龄≥18 岁;(5)临床资料完整。排除标准:(1)合并其他组织或器官恶性癌变;(2)合并心脑血管疾病;(3)肝肾功能严重损伤;(4)精神病或严重意识障碍;(5)哺乳或妊娠期女性;(6)预计生存期<6 个月。另选取与NSCLC 组性别、年龄匹配的同期住院的80 例肺部良性病变患者的病历资料进行对照,年龄18~79 岁[(61.79 ± 3.14)岁],女31 例,男49 例,均为肺部炎症患者。患者及其家属签署知情同意书,本研究经医学伦理委员会审批(20220328)。
1.2 方法
1.2.1 病例资料 收集并整理所有受试者的临床基础资料,包括性别、年龄、体重指数(BMI)、文化程度、饮酒史、吸烟史、基础疾病(糖尿病、高血脂、高血压等)、职业。
1.2.2 血清肿瘤标志物检测方法 于患者入院第2 天清晨采集其空腹外周静脉血3~4 ml,离心3 000 r/min(离心半径13.5 cm)10 min 后取上清,分别采用酶联免疫法检测血清NSE(正常值参考范围:0~17.5 μg/L)、CYFRA21-1(正常值参考范围:0~3.3 μg/L),双圄体墉心法检测CEA(正常值参考范围:0~5.0 μg/L),酶联免疫法检测CA125(正常值参考范围:0~35.0 μg/L)水平。NSE、CYFRA21-1 试剂盒购自广州奥瑞达生物科技有限公司,CEA试剂盒购自上海一研生物科技有限公司,CA125 试剂盒购自艾美捷科技有限公司。
1.2.3 TAP 检测方法 于患者入院第2 天清晨采血,取采集的血液样本涂片、风干,滴加TAP 检测试剂后干燥,制得TAP 血液标本,显微镜下观察TAP凝聚物变化,并通过捷达科技病理信息管理系统检测凝聚物生长面积。
1.2.4 其他实验室常规指标检测方法 于患者入院第2 天清晨采血,迈瑞BC-5390CRP 检测WBC,离子选择电极法检测K+、Ca2+、肌氨酸氧化酶法检测Scr 水平。
1.3 统计学处理
采用SPSS 26.0 统计学软件进行数据分析。计量资料以±s表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。Logistic 多因素回归分析NSCLC 发病的影响因素,受试者操作特征(ROC)曲线判定血清肿瘤标志物及TAP 对NSCLC 的单一及联合诊断效能。P<0.05 表示差异有统计学意义。
2 结果
2.1 NSCLC 组与良性病变组患者的血清肿瘤标志物及TAP 水平比较
NSCLC 组患者TAP、NSE、CYFRA21-1、CEA、CA125 水平均高于良性病变组(P<0.05)。见表1。
表1 NSCLC 组与良性病变组患者的血清肿瘤标志物及TAP 水平比较(± s,每组n=80)
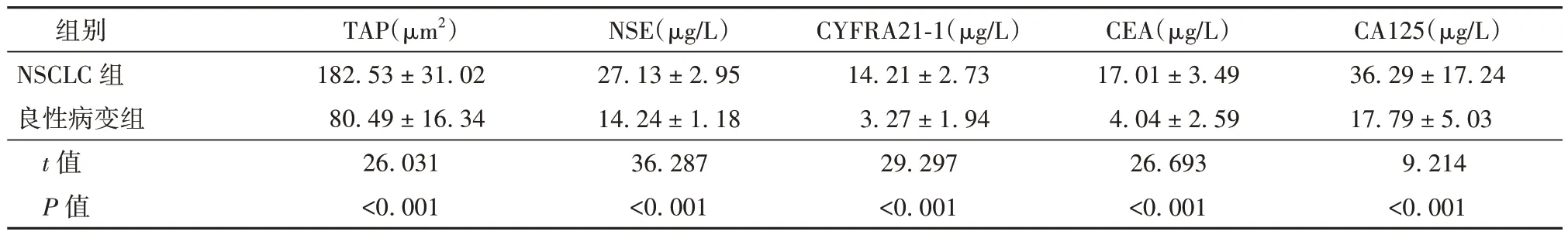
表1 NSCLC 组与良性病变组患者的血清肿瘤标志物及TAP 水平比较(± s,每组n=80)
注:NSCLC 为非小细胞肺癌,TAP 为异常糖链糖蛋白,NSE 为神经元特异性烯醇化酶,CYFRA21-1 为细胞角蛋白19 片段,CEA 为癌胚抗原,CA125 为糖类抗原125
组别NSCLC 组良性病变组t 值P 值TAP(μm2)182.53 ± 31.02 80.49 ± 16.34 26.031<0.001 NSE(μg/L)27.13 ± 2.95 14.24 ± 1.18 36.287<0.001 CYFRA21-1(μg/L)14.21 ± 2.73 3.27 ± 1.94 29.297<0.001 CEA(μg/L)17.01 ± 3.49 4.04 ± 2.59 26.693<0.001 CA125(μg/L)36.29 ± 17.24 17.79 ± 5.03 9.214<0.001
2.2 影响NSCLC 发病的单因素分析
NSCLC 组与良性病变组患者性别、年龄、BMI、糖尿病史、高血脂史、高血压史、文化程度、饮酒史及血液WBC、Scr、Ca2+、K+水平比较差异均无统计学意义(P>0.05)。NSCLC 组吸烟史及从事高油烟或高密度粉尘等相关工作职业所占比例均高于良性病变组(P<0.05)。见表2。
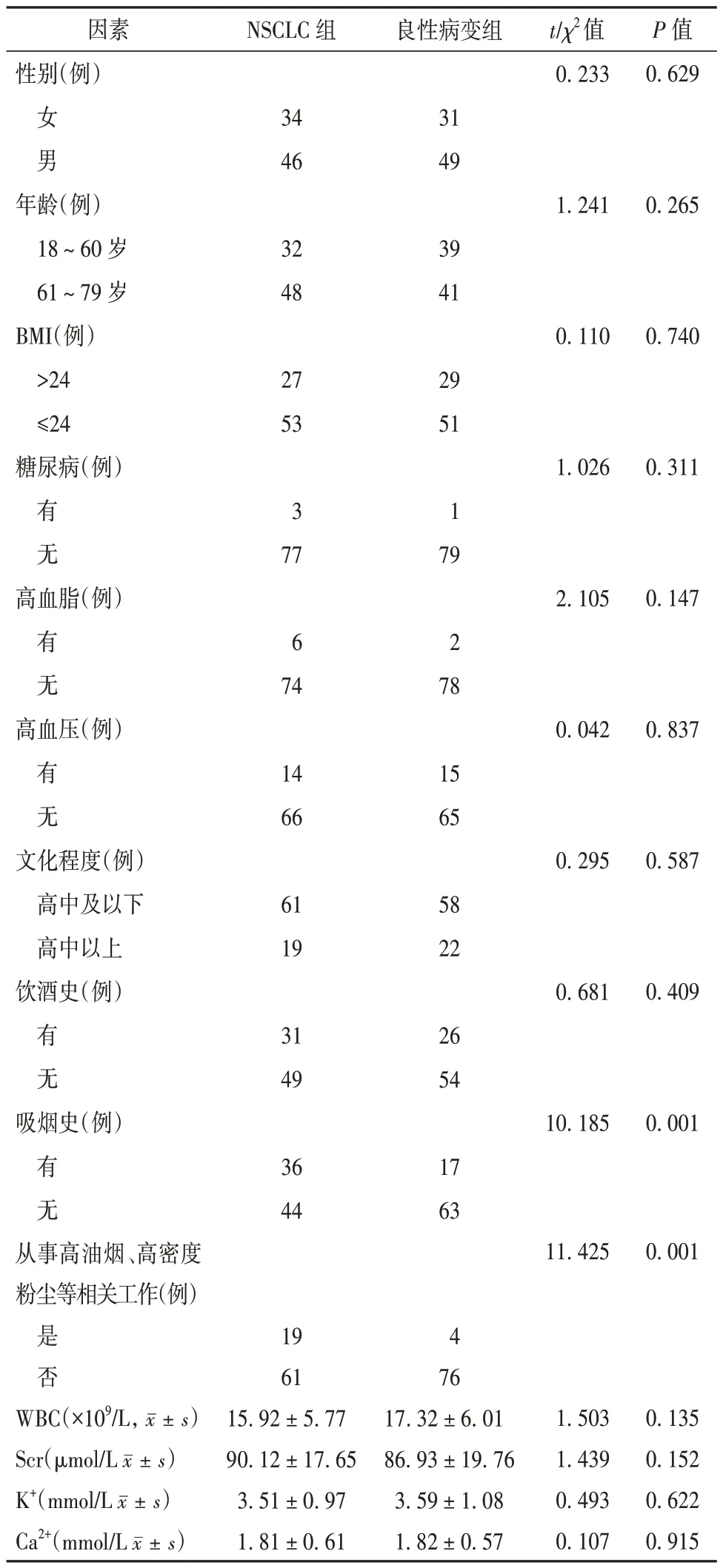
表2 影响NSCLC 发病的单因素分析(每组n=80)
2.3 影响NSCLC 发病的多因素分析
以发生NSCLC 为因变量(是=1,否=0),2 组存在差异的相关因素为自变量进行赋值,赋值内容见表3。Logistic 多因素回归分析结果显示,吸烟史、从事高油烟或高密度粉尘等相关工作及血液TAP、NSE、CYFRA21-1、CEA、CA125 水 平 升 高 均 为NSCLC 发病的影响因素(P<0.05)。见表4。

表3 自变量赋值

表4 影响NSCLC 发病的多因素分析
2.4 血清肿瘤标志物及TAP 对NSCLC 的诊断效能
ROC 分析显示,TAP、NSE、CYFRA21-1、CEA、CA125 单一诊断NSCLC Ⅰ~Ⅳ期患者的灵敏度中TAP、NSE 诊断效能较高。见表5。TAP 联合NSE诊断NSCLC I~Ⅳ期患者的AUC 分别为0.642、0.679、0.774、0.791,4 项血清标志物及TAP 联合诊断NSCLC 的AUC 分别为0.649、0.683、0.785、0.794。见表6。
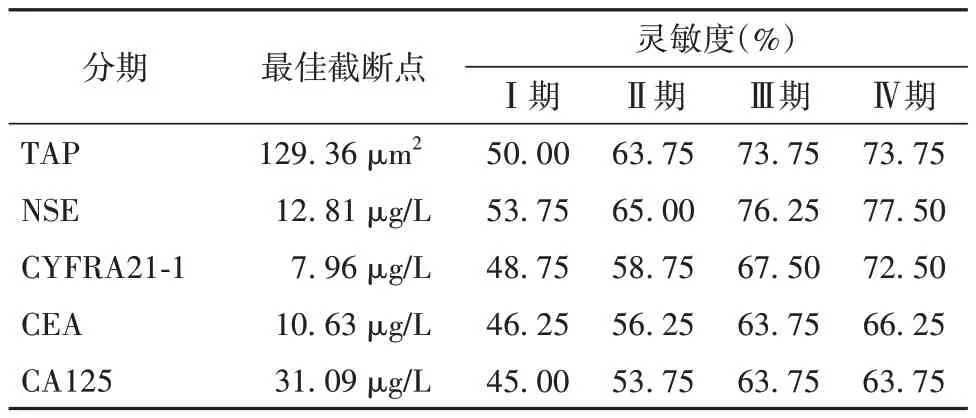
表5 血清肿瘤标志物及TAP 对NSCLC 的ROC 诊断
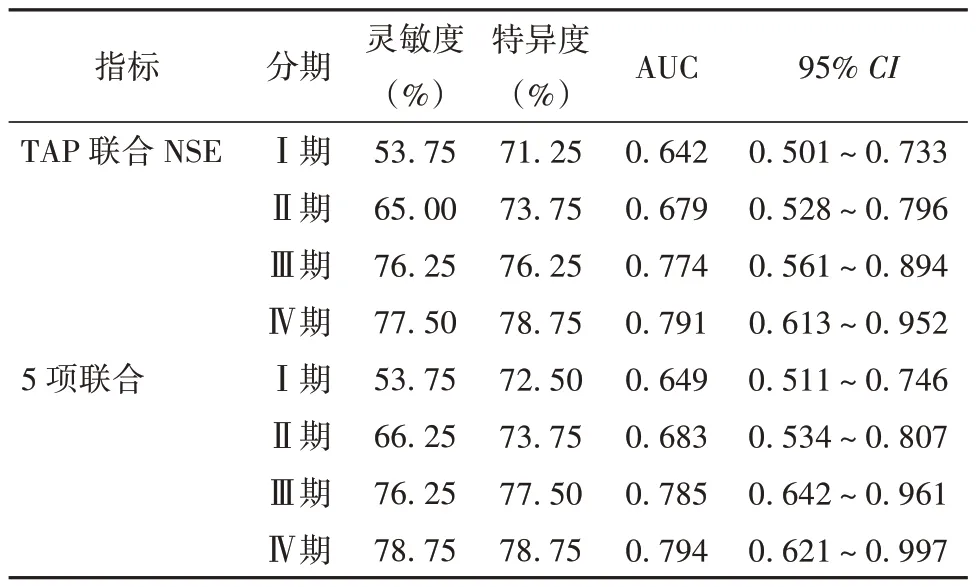
表6 血清肿瘤标志物及TAP 对NSCLC 的联合诊断分析
3 讨论
NSCLC 作为临床中常见的呼吸系统恶性病变,诱发因素较多,且致病机制复杂,目前临床中缺乏对NSCLC 中晚期治愈方案,因此提高NSCLC 的早期筛选并且通过手术切除癌变病灶成为有效延长NSCLC 患者生存期的主要研究方向[11-12]。目前,NSCLC 的临床检查方法主要包括支气管镜检查、CT或核磁共振(MRI)影像检查、基因检测、肿瘤标志物检测及病理学检查等多种筛查方案。其中多数学者均认同,病理学检查是NSCLC 临床诊断的金标准。但由于病理活检对患者机体创伤性较高,以致于部分患者配合积极性低,且病理组织活检培养耗时较长,从而导致部分患者病情持续进展,预后不良[13-14]。而肿瘤标志物检测作为肿瘤医学不断发展的产物,可通过对患者特异性血液指标检测,提高组织或细胞恶性病变的早期筛查,具有优越的临床应用效果[15-16]。
本研究中NSCLC 组TAP、NSE、CYFRA21-1、CEA、CA125 水平均高于良性病变组,表明NSCLC患者中TAP、NSE 及CYFRA21-1 表达水平较高。其中TAP 主要是糖基化不完全或由新的糖基转移酶被激活后诱导生成糖基化。当肿瘤细胞侵袭正常细胞时,可介导机体甲胎蛋白、碱性磷酸酶等蛋白多种糖链结构改变,且伴随肿瘤影响新陈代谢程度的加快,此类物质被过度排放至血液并储存于外周血液[17-18]。刘哲等[19]研究分析表明,检测肿瘤细胞代谢过程中,排放至外周血中的糖蛋白的糖链结构异常水平,对提高肿瘤细胞的阳性检出率具有积极意义。因此本研究分析TAP 可用于提高NSCLC的诊断效能。NSE 是一类参与糖酵解途径的烯醇化酶,主要存在于神经内分泌或神经组织中,血清中含量甚微[20]。但相关研究学者发现[21],NSCLC 患者血清中NSE 表达异常,且对患者的预后表现出较高的预测效能。CYFRA21-1 是形成上皮细胞的结构蛋白之一,在恶性上皮细胞中激活的蛋白酶加速了细胞的降解,使得大量细胞角蛋白释放入血,其中可溶性片段可与BM19.21 及KS19.1 等单克隆抗体特异性结合,从而生成CYFRA21-1[22]。既往研究显示,CYFRA21-1 在肺鳞癌中存在高表达[23]。因此,本研究认为CYFRA21-1 可用于辅助诊断NSCLC。CEA 是一种酸性糖蛋白,在胚胎时由胃肠道、肝、胰腺分泌,成年后血清含量极低,在多种恶性肿瘤中均有升高[24]。CA125 高度糖基化,为上皮细胞顶膜上的外来颗粒和感染因子的润滑屏障,在卵巢癌、消化道恶性肿瘤中表达增加[25]。CEA 和CA125 在既往研究中常为消化道肿瘤的检测标志物,但研究显示在早期肺癌患者中二者同样存在高表达现象[26],因此本研究认为CEA 和CA125 可用于辅助诊断早期NSCLC。本研究通过Logistic 多因素回归分析结果显示,吸烟史、从事高油烟或高密度粉尘等相关工作及血液TAP、NSE 和CYFRA21-1水平升高均为NSCLC 发病的影响因素。研究表明血液TAP、NSE 及CYFRA21-1 水平与NSCLC 关系密切。此外,烟草也是NSCLC 发病的影响因素,有研究分析烟草点燃后可释放大量亚硝胺及焦油等致癌物,且伴随烟龄的增加,可导致肺部对亚硝胺及焦油等致癌物的滤过率降低,从而导致肺癌发生率增高[27]。而从事高油烟或高密度粉尘等相关工作的人群,煤炭、油脂等燃烧产生苯并芘等致癌物,并随着8 μm 以下的微尘被吸入其肺部,提高了肺癌发病率[28]。本研究ROC 分析显示,TAP 联合NSE 诊断NSCLC Ⅰ~Ⅳ期患者和TAP、NSE、CYFRA21-1、CEA、CA125 联合诊断效能相近,临床实践中可优先根据TAP、NSE 联合诊断结果初步判定NSCLC,并根据诊断结果评估后续临床诊断中是否进行病理取样,提高临床诊断效能且节约经济成本。
综上所述,TAP 联合NSE 诊断Ⅰ~Ⅳ期NSCLC 的诊断效能较高,具有广阔的临床应用前景。但介于本研究样本量受限,后续临床仍需进一步扩大样本量证实本研究结论,以推动NSCLC 的临床诊断研究。
