基于ERK/COX-2信号通路研究电针干预原发性痛经机制
2023-06-13李娟刘余薛晓袁菡钰汪少华潘思安岳增辉
李娟,刘余,薛晓,袁菡钰,汪少华,潘思安,岳增辉
湖南中医药大学针灸推拿与康复学院,湖南 长沙 410208
原发性痛经(primaiy dysmenorrhea,PDM)是以下腹部痉挛性疼痛为主要特征且无盆腔器质性病变的月经疼痛,并可放射至下背部或腿部,常伴随头痛、恶心、腹泻及尿频等症状。流行病学研究指出,不同年龄和国籍人群PDM发病率在45%~97%,严重影响患者日常生活[1]。关于PDM的主要发病机制,普遍认为与子宫前列腺素(PG)水平异常升高有关[2]。目前治疗以布洛芬为代表的非甾体抗炎药为主,但容易引起恶心、呕吐、胃灼热等不良反应[3]。大量研究表明,电针可以有效缓解PDM疼痛且治愈率高[4-6],无明显不良反应,但其干预机制尚不明确。
丝裂原活化蛋白激酶(MAPK)在细胞信号传递中具有十分重要的作用,经过受体、转录因子等因素的影响激活,将表面信号传导到核内部,控制细胞生长发育、分化、癌变、转移、凋亡、炎症等多种生命活动过程,成为许多疾病研究的重点[7-8]。MAPK可分为ERK、p38、JNK和ERK5共4个亚族。研究表明,MAPK/ERK信号通路是影响PDM发生发展的重要通路和调控因子[9-10]。环氧化酶-2(COX-2)是影响PGs释放的关键酶[11],COX-2表达升高诱导PGs合成及释放,诱发炎症,导致疼痛[12],下调MAPK/ERK信号通路相关蛋白COX-2表达能减少PGs释放,缓解痛经[13]。本研究通过建立PDM大鼠模型,基于ERK/COX-2信号通路研究电针治疗PDM的作用机制。
1 材料与方法
1.1 动物
SPF级健康未孕雌性SD大鼠40只,8~10周龄,体质量180~200 g,动物许可证号SCXK(京)2019-0008。饲养于室温20~25 ℃、湿度50%~70%环境,自由饮水进食,适应性饲养1周后开始实验。本研究经湖南中医药大学动物伦理委员会审批(LL2021040703),并遵循关于善待动物的指导意见。
1.2 主要试剂与仪器
布洛芬(批号13062,中美天津史克制药有限公司),苯甲酸雌二醇(批号2011052,4 mg/2 mL,宁波第二激素厂),缩宫素(货号P1029,纯度98.52%,美国Selleck),亚甲基蓝(货号C12086108,上海麦克林生化科技有限公司),HE染色试剂盒(货号C0105,中国生物技术),PGE2、PGF2α ELISA 试剂盒(货号20211111-J2944、20211111-J3106,湖南艾方生物科技有限公司),GAPDH 抗体(货号GB15002,武汉Servicebio),ERK1/2抗体(货号AF02700,湖南艾方生物),p-ERK1/2抗体(货号AF01038,湖南艾方生物),COX-2 抗体(货号GB11077-2,武汉Servicebio),HRP-山羊抗鼠二抗(货号GB25301,武汉Servicebio),HRP-山羊抗兔二抗(货号GB25303,武汉Servicebio)。
光学显微镜(型号BA410E,厦门Motic),切片机(型号UC7,德国Leica),酶标仪(型号RT-6100,美国Rayto),涡旋混匀仪(型号MV-100,武汉Servicebio),化学发光仪(型号6300,上海CLINX),电针仪(型号SDZ-V,苏州医疗用品有限公司)。
1.3 分组及造模
采用随机数字表法将40只大鼠分为空白组、模型组、电针组和布洛芬组,每组10 只。参照前期研究[14-15]优化造模方法:通过阴道涂片筛选处于动情间期大鼠造模,模型组、电针组和布洛芬组连续10 d于股部皮下注射苯甲酸雌二醇,第1、10日注射0.5 mL/只,第2~9 日注射0.2 mL/只,第11 日腹腔注射缩宫素2 U/只诱发扭体反应,空白组注射0.9%氯化钠溶液。以大鼠子宫收缩出现扭体反应为造模成功标准[16]。
1.4 干预
造模第1 日开始干预,电针组参考《实验针灸学》[17]选穴。将大鼠固定于鼠板,常规消毒后“三阴交”直刺约5 mm,两侧“三阴交”隔日交替电针,“关元”直刺约2 mm,得气后连接电针仪,连续波,频率50 Hz,强度以大鼠局部肌肉轻微抽动,不出现挣扎嘶叫为度。每日1次,每次20 min,连续10 d。布洛芬组予布洛芬生理盐水溶液(1.25 mg/mL)灌胃,0.8 mL/只,每日1次。空白组和模型组只捆绑,不做其他处理。
1.5 指标检测
1.5.1 扭体潜伏期、扭体次数及扭体评分测定
第11日注射缩宫素后,记录大鼠30 min内出现扭体反应的时间,即扭体潜伏期,记录出现扭体反应的次数。参照行为学评分标准进行扭体评分[18]:正常探查行为,0分;身体躯干斜向一侧,腹部因收缩向内凹陷,1分;后肢伸展,后爪背屈,躯干伸展伴盆骨方向旋转,2分;腹部肌肉收缩,后肢后伸,3分。
1.5.2 HE染色
观察大鼠扭体反应后,腹腔注射2%戊巴比妥钠(3 mL/100 g)麻醉大鼠,摘除子宫组织,用无菌手术剪将大鼠左右两侧子宫剪成6等份,每组随机选取5只大鼠相同位置子宫组织,放入4%多聚甲醛溶液中固定,其余子宫组织标号冻存。子宫组织经固定24 h后进行脱水、二甲苯透明、包埋、切片(5 μm),脱蜡后HE染色,鼠李胶封片固定。光学显微镜下观察子宫组织病理变化,并对其进行评分。评分标准[19]:无明显病理变化,0分;内膜出现坏死,1分;固有层水肿,2分;固有层腺体增多,3分;固有层炎症细胞浸润,4分;子宫肌层炎症,5分。
1.5.3 ELISA检测
取大鼠子宫组织,加入缓冲液,匀浆,3 000 r/min离心20 min(离心半径15 cm),取上清液,根据ELISA试剂盒说明书检测PGF2α和PGE2含量。
1.5.4 Western blot检测
每组随机选取6 只大鼠相同位置子宫组织(约50 mg)剪成小块,研磨机低温研磨,加入预冷裂解液和蛋白酶抑制剂、磷酸酶抑制剂裂解30 min,4 ℃、12 000 r/min离心10 min(离心半径63 mm),取上清液,BCA法蛋白定量,加入样品缓冲液,沸水浴10 min。上样后电泳,PVDF 膜转膜、封闭后,加一抗孵育:GAPDH一抗(1∶2 000)、ERK1/2一抗(1∶1 000)、p-ERK1/2一抗(1∶1 000)、COX-2一抗(1∶1 000),4 ℃孵育过夜。TBST洗膜,加二抗(1∶5 000),室温孵育60 min,ECL法显色曝光。以GAPDH为内参,计算目的蛋白相对表达量。
1.6 统计学方法
2 结果
2.1 电针对模型大鼠扭体潜伏期、扭体次数及扭体评分的影响
空白组无扭体反应。与空白组比较,模型组大鼠扭体次数、扭体评分增加(P<0.01);与模型组比较,电针组和布洛芬组大鼠扭体潜伏期延长(P<0.01),扭体次数、扭体评分减少(P<0.05,P<0.01)。见表1。
表1 各组大鼠扭体反应比较(±s)

表1 各组大鼠扭体反应比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组电针组布洛芬组扭体评分0 2.90±0.32**1.70±0.83#1.30±0.68##只数10 10 10 10扭体潜伏期/s 0 150.80± 21.18**457.80± 93.02##430.50±116.81##扭体次数0 42.80±10.70**11.60± 6.11#6.80± 4.94##
2.2 电针对模型大鼠子宫组织病理形态的影响
空白组大鼠子宫内膜上皮细胞排列完整,无明显空泡水肿等病理变化;模型组大鼠子宫内膜上皮细胞大量空泡样变性、坏死,且有中性粒细胞浸润、子宫内膜剥脱水肿及炎症,伴小动脉充血;电针组和布洛芬组大鼠子宫内膜上皮细胞较少空泡样变性、坏死,内膜剥脱范围较小,水肿、炎症程度减轻。见图1。与空白组比较,模型组大鼠子宫组织病理评分显著升高(P<0.01);与模型组比较,电针组和布洛芬组大鼠子宫组织病理评分显著降低(P<0.05,P<0.01)。见表2。

图1 各组大鼠子宫组织形态(HE染色,×100)
表2 各组大鼠子宫组织病理评分比较(±s,分)

表2 各组大鼠子宫组织病理评分比较(±s,分)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
病理评分0.80±0.45 3.80±0.84**1.60±0.55#1.40±0.55##组别空白组模型组电针组布洛芬组只数5555
2.3 电针对模型大鼠子宫组织前列腺素F2α 和前列腺素E2含量的影响
与空白组比较,模型组大鼠子宫组织PGF2α含量显著增加,PGE2含量显著减少(P<0.01);与模型组比较,电针组和布洛芬组大鼠子宫组织PGF2α含量显著减少,PGE2含量显著增加(P<0.01)。见表3。
表3 各组大鼠子宫组织PGF2α、PGE2含量比较(±s,pg/mg)

表3 各组大鼠子宫组织PGF2α、PGE2含量比较(±s,pg/mg)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
PGE2 368.263±25.123 251.399±12.972**353.092±51.616##348.866±24.911##组别空白组模型组电针组布洛芬组只数5555 PGF2α 100.699± 5.761 221.095± 7.053**124.843± 6.761##121.555±12.408##
2.4 电针对模型大鼠子宫组织ERK、p-ERK、环氧化酶-2蛋白表达的影响
与空白组比较,模型组大鼠子宫组织ERK1/2、p-ERK1/2、COX-2 蛋白表达显著升高(P<0.01);与模型组比较,电针组和布洛芬组大鼠子宫组织ERK1/2、p-ERK1/2、COX-2蛋白表达显著降低,差异有统计学意义(P<0.05,P<0.01)。见图2、表4。
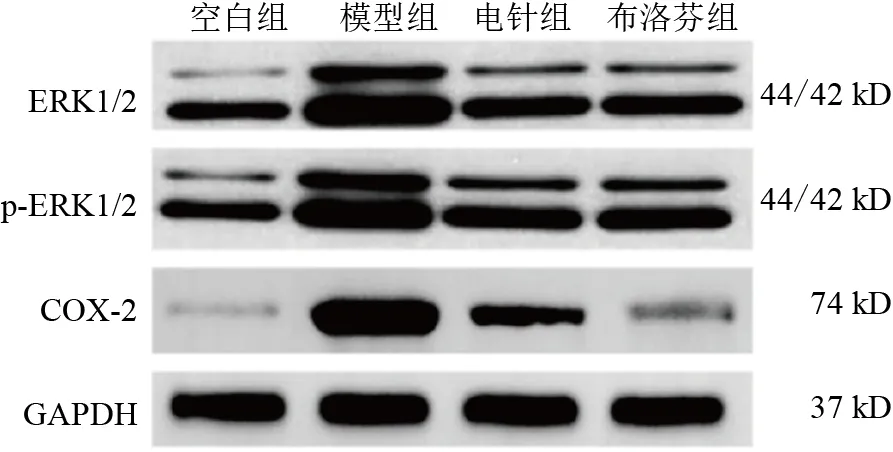
图2 各组大鼠子宫组织ERK1/2、p-ERK1/2、COX-2蛋白免疫印迹
表4 各组大鼠子宫组织ERK1/2、p-ERK1/2、COX-2蛋白表达比较(±s)

表4 各组大鼠子宫组织ERK1/2、p-ERK1/2、COX-2蛋白表达比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
COX-2 0.233±0.013 0.819±0.068**0.571±0.028##0.414±0.078##组别空白组模型组电针组布洛芬组只数6666 ERK1/2 0.277±0.036 0.715±0.061**0.429±0.072#0.465±0.080#p-ERK1/2 0.248±0.046 0.594±0.109**0.367±0.051#0.362±0.058#
3 讨论
中医学认为,PDM主要病机为气血亏虚,失于濡养经络脏器而引起疼痛。三阴交为足三阴脾、肝、肾经经气交汇之处,针刺此穴既可补益脾、肾、肝三经气血,又可通畅三经气血,使气血充养胞宫。关元位于脐下小腹部,为调理冲任二脉气血之要穴,具有温通濡养胞脉作用。两穴配伍为远近配穴,近端取关元可调节子宫局部经气,体现腧穴的近治作用,远端取三阴交起整体调节作用,体现腧穴的远治作用,可沟通机体上下经气,改善整体气血。因而两穴相伍可起到调冲任、理气血、通经止痛的效果[20]。课题组前期分析针刺治疗PDM的腧穴配伍规律,结果表明关元、三阴交出现频次最高[21]。因此,本研究观察结果显示,模型组大鼠扭体次数、扭体评分显著增加,出现扭体潜伏期,说明PDM造模成功;电针组和布洛芬组大鼠扭体次数、扭体评分显著降低,扭体潜伏期显著延长,表明疼痛症状明显减轻。
有学者认为,PGs分泌异常可导致子宫收缩、缺血、炎症及疼痛[2]。研究表明,PGF2α的异常释放作用于相应受体,导致平滑肌痉挛收缩、组织缺氧缺血、子宫内膜脱落,引起出血及疼痛,而PGE2能抑制子宫平滑肌收缩[22-23]。本实验结果显示,模型组大鼠子宫组织PGF2α含量显著增加、PGE2含量显著减少,电针组和布洛芬组PGF2α含量显著减少、PGE2含量显著增加,表明电针可能通过增加子宫组织PGE2含量、降低PGE2 含量缓解子宫强烈痉挛收缩,从而达到止痛效果。
COX-2 是参与PGs 合成的重要限速酶,月经前COX-2表达升高,可催化花生四烯酸转化为活性PGs,导致痉挛性疼痛。目前治疗PDM的临床药物如布洛芬,通过特异性抑制COX-2,降低PGs合成,减轻疼痛[24]。ERK 是细胞外调节蛋白激酶,包括ERK1 和ERK2,控制和调节细胞增殖、分化、凋亡等重要生理活动。研究表明,MAPK/ERK通路参与COX-2表达的调节,可通过抑制MEK1/2 和ERK1/2 磷酸化,降低COX-2表达[8]。本研究结果显示,模型组大鼠子宫组织ERK1/2、p-ERK1/2 及COX-2 蛋白表达明显升高,表明PDM的机制之一可能是激活MAPK蛋白启动信号传导通路,激活ERK1/2磷酸化,上调COX-2蛋白表达,增加PGs释放,从而引发痛经。进一步说明ERK/COX-2信号通路参与PDM的病理生理过程。经电针和布洛芬干预后,ERK/COX-2信号通路相关蛋白表达降低,且电针组与布洛芬组差异无统计学意义,表明电针与布洛芬疗效相当,提示电针可能通过抑制ERK/COX-2信号通路相关因子,减少PGs释放,从而治疗PDM。
综上所述,电针“三阴交”“关元”可缓解PDM大鼠疼痛症状,改善子宫病理损伤,其机制可能与抑制ERK/COX-2信号通路,降低PGs水平有关。今后将进一步从ERK信号通路上游进行研究,明确电针治疗PDM的作用机制。
