外周血hsa_circ_0105035表达水平与急性缺血性脑卒中的相关性▲
2023-06-12梁雪莹龙建雄朱路路杨佳磊
梁雪莹 赵 直 龙建雄 朱路路 杨佳磊 苏 莉
(广西医科大学公共卫生学院,广西南宁市 530021)
缺血性脑卒中是一种脑部供血障碍导致的脑组织坏死性疾病,约占全部脑卒中的80%,是全球死亡和残疾的主要原因之一[1]。在时间窗内(发病4.5 h内)尽早给予静脉溶栓,是缺血性脑卒中的有效疗法。但由于时间窗狭窄,只有不到3%的缺血性脑卒中患者可以获得有效的溶栓治疗[2-3]。因此,迫切需要寻找能够早期诊断和有效治疗缺血性脑卒中的新策略。近期研究表明,环状RNA(circular RNA,circRNA)参与缺血性脑卒中的发生发展[4-5],其中hsa_circ_0105035由切除修复交叉互补组4基因(excision repair cross complementation group 4, ERCC4)前体mRNA反向剪接形成,ERCC4在修复DNA损伤和维持基因组稳定性方面起重要作用[6]。ERCC4作为核苷酸切除修复途径中的限速酶,可能在缺血性脑卒中的病理生理过程中起关键作用,其变异可能会增加缺血性脑卒中的风险[7],但目前尚未见有关hsa_circ_0105035与脑卒中关系的研究报道。本文旨在探讨外周血hsa_circ_0105035表达水平与急性缺血性脑卒中(acute ischemic stroke, AIS)的关系,为AIS的防治策略提供新的依据。现报告如下。
1 对象与方法
1.1 研究对象
1.1.1 纳入、排除标准 (1)病例组纳入标准:①缺血性脑卒中病例均符合全国第四届脑血管病学术会议修订的《各类脑血管病诊断要点》诊断标准,均经头颅MRI和/或CT确诊;②起病在72 h以内的AIS患者。排除标准:①肿瘤、心源性栓塞、脑外伤、脑血管畸形等其他原因引起的AIS;②自身免疫性疾病患者;③合并严重心、肝、肾功能障碍的患者;④依从性差、不合作而无法完成资料收集的患者。(2)对照组纳入标准:无脑卒中、冠心病等心脑血管疾病史的社区人群。排除标准:①过去2周内有感染史;②依从性差而无法完成资料收集者。
1.1.2 研究对象来源 病例组来源于2015年12月至2021年9月在广西中医药大学第一附属医院脑病科住院的AIS患者,共纳入310例。对照组来源于同城区社区卫生服务中心每年定期体检的无脑卒中、冠心病等心脑血管疾病史的社区人群,共纳入310例。病例组年龄为(65.59±11.25)岁,对照组年龄为(67.22±6.98)岁,两组研究对象的年龄比较,差异无统计学意义(P>0.05)。所有对象均知悉研究内容,并签署知情同意书。本研究已通过广西医科大学医学伦理委员会审查批准。
1.2 方法
1.2.1 外周血标本采集与处理 利用含乙二胺四乙酸(ethylenediamintetra-acetic acid, EDTA)抗凝剂的真空采血管采集研究对象清晨空腹状态下的外周静脉血5 mL,病例组为入院次日采集,4℃、2 500 g离心15 min,分离血浆后加入红细胞裂解液(北京艾德莱生物科技有限公司)于抗凝管中,充分裂解后分装至2 mL离心管,4℃、13 000 g离心3 min,最后获得白细胞团,加入1 mL TRIzol试剂(美国Invitrogen公司),涡旋震荡,-80℃保存备用。
1.2.2 总RNA提取及实时荧光定量PCR 采用TRIzol试剂提取样本总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(日本TaKaRa公司),严格按照实验说明对RNA进行cDNA合成。引物序列由生工生物工程(上海)股份有限公司合成:hsa_circ_0105035的上游和下游引物序列(5′ to 3′)分别为ATATTTGGATACACAGGTCGGCC、TCGGTATGGTTAGAAGATATCCCAT;β-actin的上游和下游引物序列(5′ to 3′)分别为GTGGCCGAGGACTTTGATTG、CCTGTAACAACGCATCTCATATT;GAPDH的上游和下游引物序列(5′ to 3′)分别为GGAGCGAGATCCCTCCAAAAT、GGCTGTTGTCATACTTCTCATGG;U6的上游和下游引物序列(5′ to 3′)分别为GGAACGATACAGAGAAGATTAGC、TGGAACGCTTCA-CGAATTTGCG。使用SYBR PrimeScriptTMRT Master Mix试剂盒(日本TaKaRa公司)进行PCR,然后通过Sanger测序确认PCR反应产物的剪接序列,验证hsa_circ_0105035的环状结构。以2-△CT公式计算hsa_circ_0105035的相对表达水平。
1.2.3 线性消化酶(RNase R)实验 为了验证hsa_circ_0105035的环状结构,提取的RNA分为阴性对照组(MOCK组)和RNase R消化组,RNase R消化组按照1 μg RNA加入3U RNase R溶液(美国Epicentre公司)的标准配置线性消化反应体系,以37℃ 15 min,然后72℃ 10 min灭活酶活性,4℃ 5 min后保存收集样本,随后通过逆转录和qRT-PCR技术测定hsa_circ_0105035和GAPDH在两组中的相对表达水平。
1.2.4 核质分离实验 为了明确hsa_circ_0105035的亚细胞定位情况,本研究进行了核质分离实验。按照PARISTM核质分离试剂盒(美国Thermo Fisher Scientific公司)的使用说明,收集了293T细胞的胞核和胞质RNA。以U6作为细胞核定位标志物,GAPDH作为细胞质定位标志物,通过qRT-PCR检测细胞核和细胞质中U6、GAPDH、hsa_circ_0105035的相对表达水平。
1.3 脑梗死体积计算 本研究通过医院的临床病例信息系统收集了AIS患者的头颅CT、MRI影像学资料。通过Image J软件计算得到AIS患者脑梗死部位每张CT或MRI图像的梗死面积,每张图像层面厚度为5 mm,最终合并计算得到脑梗死体积。
1.4 临床血液生化指标的检测和分析 采用EDTA抗凝管采集AIS患者入院次日清晨的空腹外周静脉血2 mL,使用迈瑞6900全自动血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血常规指标。采用非抗凝采血管采集患者清晨空腹外周静脉血2 mL,使用HITACHI日立7600全自动生化分析仪[日立(中国)有限公司]检测心肌酶指标。
1.5 统计学分析 运用R软件(R 4.0.5)进行统计学分析。符合正态分布的计量资料采用t检验,非正态的计量资料采用非参数检验。计数资料的组间比较采用χ2检验。非正态分布计量资料的相关分析采用Spearman秩相关。所有的检验均为双侧检验,检验水准α=0.05。
2 结 果
2.1 hsa_circ_0105035的环状结构验证及亚细胞定位 将qRT-PCR产物进行Sanger测序,测序结果表明扩增产物为环状RNA hsa_circ_0105035(图1A)。RNase R消化后,RNA核酸凝胶电泳结果(见图1B)。线性消化酶实验结果显示,与未加RNase R组相比,hsa_circ_0105035的表达量稍有降低,而GAPDH作为线性RNA参照,表达量明显降低(图1C)。核质分离实验结果显示,hsa_circ_0105035在细胞质和细胞核中均有表达,主要分布于细胞质中(图2)。
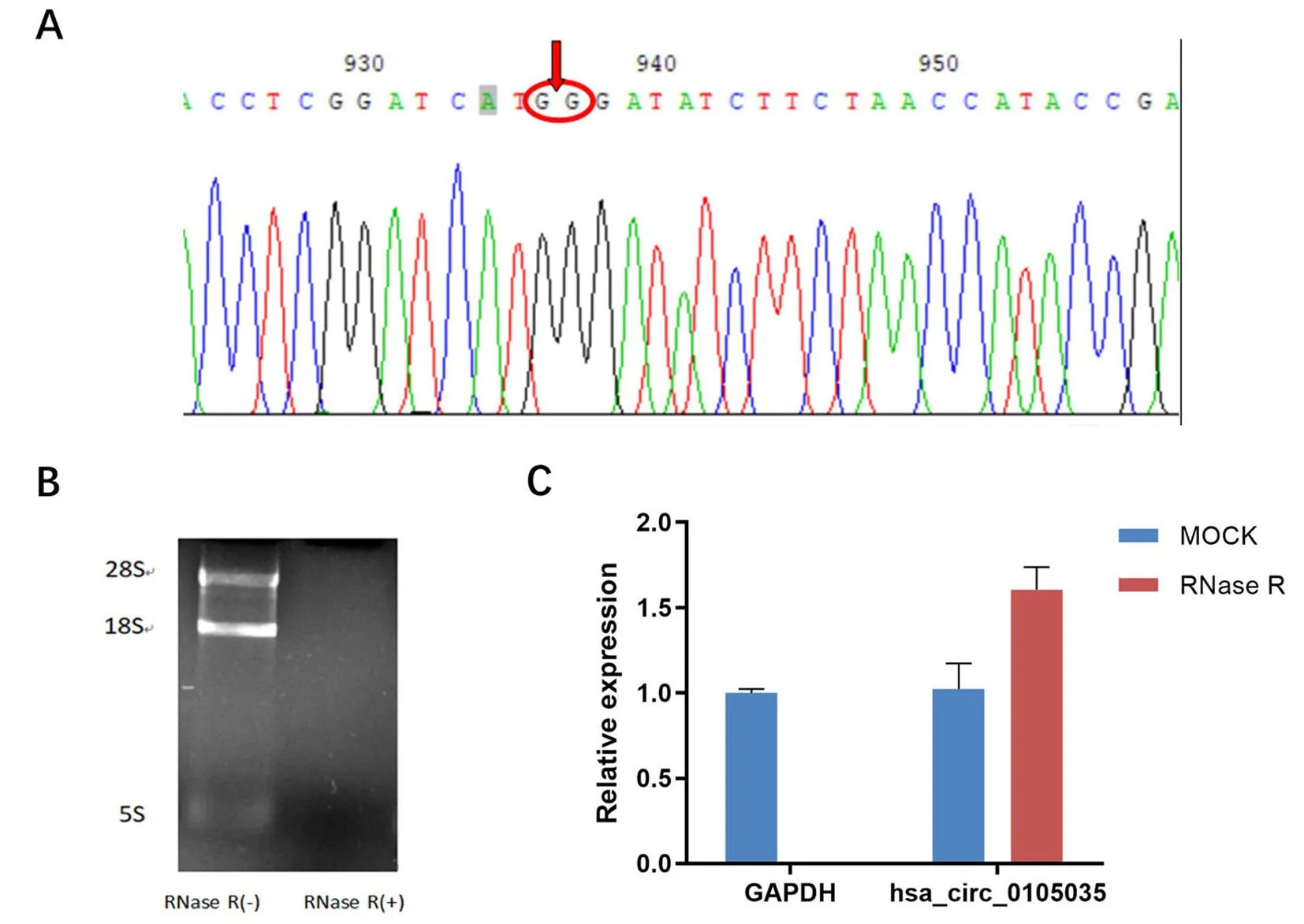
图1 hsa_circ_0105035环状结构的验证结果
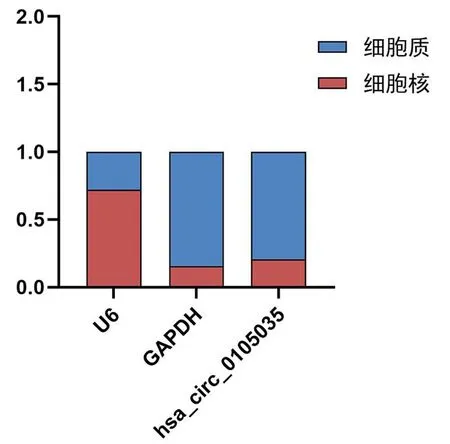
图2 hsa_circ_0105035在细胞中的分布情况
2.2 外周血hsa_circ_0105035表达水平比较 AIS患者外周血hsa_circ_0105035表达水平低于对照组,差异有统计学意义(Z=7.991,P<0.001),见图3A。按性别分层分析结果显示,男性AIS患者外周血hsa_circ_0105035表达水平低于男性对照(Z=5.570,P<0.001),女性AIS患者外周血hsa_circ_0105035表达水平也低于女性对照(Z=5.306,P<0.001)。见图3B。
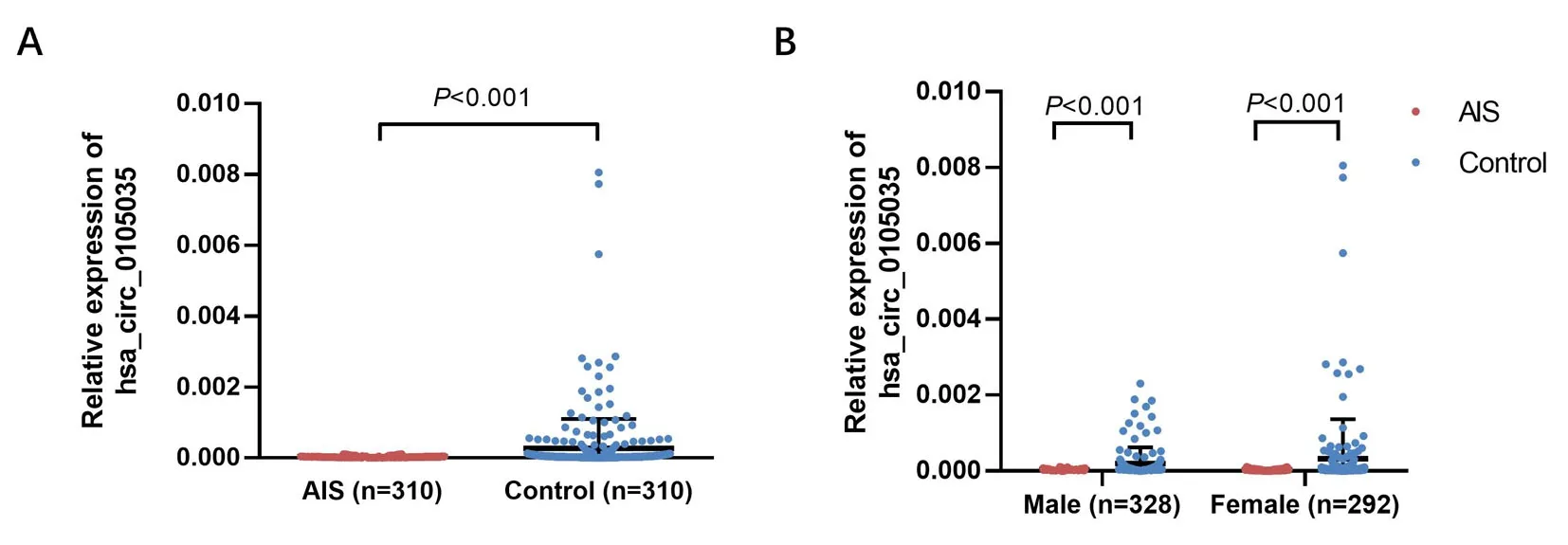
图3 外周血hsa_circ_0105035表达水平比较
2.3 hsa_circ_0105035表达水平与AIS患者脑梗死体积的关联 由于医院新旧系统更换,本研究只收集到248例患者的头颅CT、MRI影像学资料进行脑梗死体积计算。按照外周血hsa_circ_0105035表达水平的中位数,将AIS患者分为hsa_circ_0105035低表达组(n=124)和高表达组(n=124),结果显示,与hsa_circ_0105035低表达组AIS患者相比,hsa_circ_0105035高表达组AIS患者的脑梗死体积更小(Z=2.293,P=0.022),见图4A。Spearman相关分析结果显示,AIS患者的外周血hsa_circ_0105035表达水平与脑梗死体积呈负相关关系(rs=-0.127,P=0.045),见图4B。3例不同hsa_circ_0105035表达和脑梗死体积的AIS患者数据见图5。

图4 AIS患者外周血hsa_circ_0105035表达水平与脑梗死体积的关联
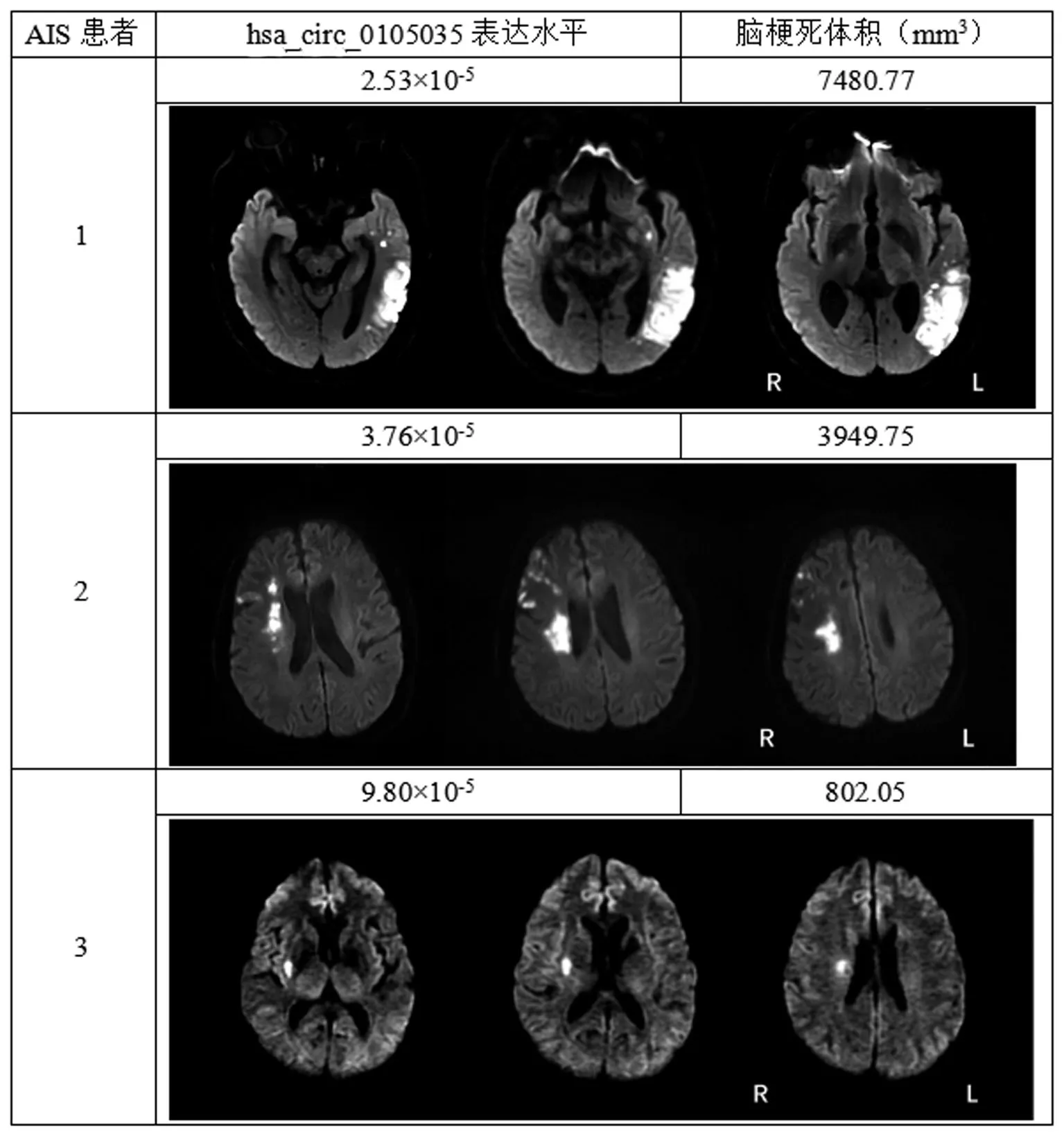
图5 3例AIS患者hsa_circ_0105035表达水平和脑梗死体积的代表性数据
2.4 hsa_circ_0105035不同表达水平AIS患者的临床指标比较 hsa_circ_0105035低表达组AIS患者的血小板体积分布宽度、乳酸脱氢酶含量高于高表达组,而红细胞体积分布宽度低于高表达组,差异均有统计学意义(均P<0.05)。两组AIS患者白细胞计数、中性粒细胞数、淋巴细胞数等血常规指标及肌酸激酶、MB亚型肌酸激酶同工酶、α-羟丁酸脱氨酶比较,差异均无统计学意义(均P>0.05)。见表1、表2。

表1 hsa_circ_0105035不同表达水平的AIS患者血常规指标比较 (x±s)
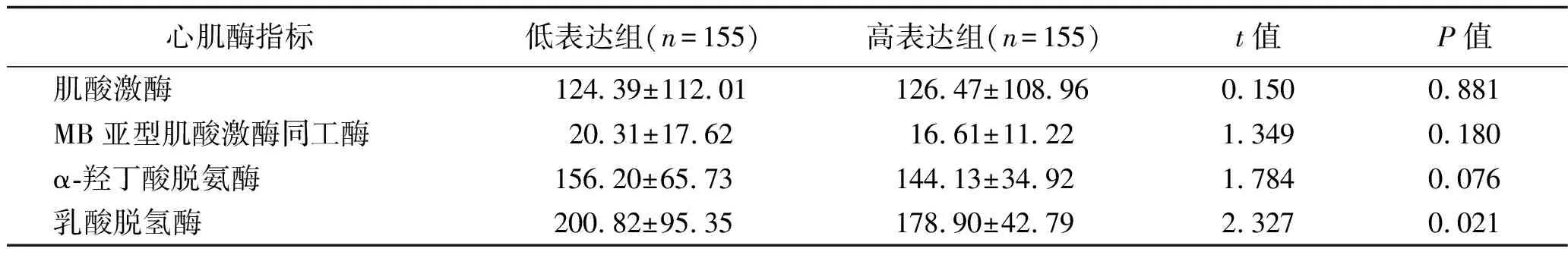
表2 hsa_circ_0105035不同表达水平AIS患者的心肌酶指标比较 (x±s,U/L)
3 讨 论
近年来,缺血性脑卒中的发病率呈逐年上升趋势,造成了严重的社会和经济负担,因而迫切需要探寻缺血性脑卒中的有效防治手段[8]。本研究首次报道hsa_circ_0105035在AIS患者外周血中表达下调,其表达水平与脑梗死体积呈负相关,而且与血小板体积分布宽度、乳酸脱氢酶等参数相关,为AIS的病情评估和疾病预测提供潜在的参考价值。
circRNA是一类不具有5′末端帽子和3′末端poly(A)尾巴的闭合环状RNA分子[9],这一特质使得circRNA能够耐受线性RNA消化酶的消化,具有更高的稳定性和更长的半衰期[10]。本研究通过线性RNA消化酶实验观察到hsa_circ_0105035的表达稳定性明显高于线性RNA,并通过PCR产物测序明确引物的特异性以及对hsa_circ_0105035的特异性扩增。我们最终证实hsa_circ_0105035是一个环状RNA分子,为后续研究的开展提供了严谨的基础。我们还通过核质分离实验明确了hsa_circ_0105035主要分布于细胞质,为后续功能和机制的研究指明了探索的方向。
近年研究发现,circRNAs在哺乳动物大脑组织中的表达丰度远高于其他组织,circRNAs可能参与缺血性脑卒中等神经系统疾病的病理生理过程[11]。Jiang等[12]报道缺氧缺血性脑损伤后大鼠海马体中circRNA表达谱发生改变。另有体内实验结果显示,过表达的circFOXP1能减轻小鼠神经功能缺损和缩小脑梗死体积,并通过调节STAT3/凋亡信号来缓解脑缺血后的脑损伤[13]。近年研究表明,circRNAs与缺血性脑卒中的发生密切相关。Wu等[14]研究发现circTLK1在小鼠缺血性脑组织和AIS患者血浆中表达升高,并且敲低circTLK1能够减少缺血性神经元损伤、改善神经功能缺损。Peng等[15]报道,circRNA HECTD1的表达与AIS的发病风险、严重程度和复发相关。但有关hsa_circ_0105035与缺血性脑卒中关系的研究尚未见报道,值得我们去探索和研究。hsa_circ_0105035是由ERCC4基因反向剪接形成的环状RNA。本研究发现hsa_circ_0105035在AIS患者外周血中表达下调,提示其可能影响AIS的发生发展。缺血性脑卒中发生后不久,会在大脑的多种细胞中引起DNA氧化损伤,同时细胞也会通过诱导内源性DNA修复机制来对抗DNA损伤的积累,其中就包括核苷酸切除修复途径[16]。有研究发现,ERCC4是核苷酸切除修复途径中必不可少的基因[17]。ERCC4作为核心的DNA核苷酸切除修复酶,在发生DNA氧化损伤后被激活,从而参与DNA损伤修复过程[18-19]。有研究报道大鼠脑缺血/再灌注后缺血区神经元凋亡与DNA修复酶活性下降有关[20]。何伟[21]也发现DNA损伤修复基因XRCC1 rs25487位点A等位基因可能是中国南方汉族人群缺血性脑卒中发病的独立保护因素。Ma等[7]发现,ERCC4基因可能在缺血性脑卒中的病理生理过程中发挥重要作用,其变异可能会增加缺血性脑卒中的发生风险。另有研究[22]报道,circRNA可以促进其亲本基因的转录并转化为肽,我们推测hsa_circ_0105035是否可以通过调控其亲本基因ERCC4来参与缺血性脑卒中的病理生理过程,这有待于下一步的探索。
AIS患者的脑梗死体积和神经功能缺损程度是判断病情严重程度的重要指标,脑梗死体积较大者更容易发生偏瘫、意识障碍,甚至危及生命[23-24]。在疾病早期尽快判断AIS患者脑梗死体积有助于临床制订个体化的诊疗方案,改善患者病情。氧化应激和炎症反应等多种破坏性机制是引起神经元损伤的原因[25]。在脑卒中患者中,神经元损伤与脑梗死体积相关,能够缩小脑梗死体积的治疗通常也能够减轻神经元损伤[26-27]。Wu等[14]研究发现,circTLK1在AIS患者血浆中表达上调,与脑梗死体积呈正相关关系;在小鼠脑卒中模型中敲低circTLK1可显著缩小脑梗死体积,减轻神经元损伤。Li等[28]观察到大动脉粥样硬化型缺血性脑卒中患者外周血的hsa_circ_0001599表达上调,与脑梗死体积呈正相关。Yang等[5]发现circUSP36在缺血性脑卒中患者外周血中显著降低,其表达水平与脑梗死体积呈负相关。与上述研究一致。本研究也发现在AIS患者外周血hsa_circ_0105035水平与脑梗死体积呈负相关。目前缺血性脑卒中的诊断主要依靠影像学检查,但卒中往往在初始发作时无法识别,MRI可能无法发现AIS患者潜在或微小的梗死病变。我们的研究发现可以为缺血性脑卒中早期的病情评估和疾病预测提供潜在的参考价值。
此外,circRNA还被报道与AIS相关的多种临床特征存在相关性[29]。在AIS患者中,表达上调的circHECTD1与C反应蛋白和多个促炎细胞因子水平呈正相关[15]。而AIS患者外周血中表达下调的circDLGAP4与C反应蛋白水平和多个促炎细胞因子水平呈负相关[30]。一般来说,在患者中表达上调的circRNA是疾病的风险因素,并与部分疾病促进因子呈正相关,而在患者中表达下调的circRNA则相反。我们的研究也发现在hsa_circ_0105035高表达组AIS患者中血小板体积分布宽度、乳酸脱氢酶含量降低。此前已有报道,血小板体积分布宽度可能参与了AIS的发生发展过程,并对疾病的严重程度有一定的影响[31]。临床研究发现,缺血性脑卒中患者的血小板体积分布宽度越大,病情越严重[32-33]。临床上已经发现缺血性脑卒中患者的血清和脑脊液中乳酸脱氢酶水平升高,与脑卒中发生有关[34]。还有研究发现急性脑卒中患者的脑脊液乳酸脱氢酶水平可以反映脑损伤的严重程度[35]。hsa_circ_0105035与血小板体积分布宽度、乳酸脱氢酶的关联也进一步表明了hsa_circ_0105035可能作为一个保护因素在AIS病理生理过程中发挥作用。
综上所述,我们首次揭示hsa_circ_0105035可能与AIS的发生相关,并且与AIS患者的脑梗死体积存在关联,可以为缺血性脑卒中早期的病情评估和疾病监测提供潜在的预测价值。本研究仅采集了AIS患者入院次日的血液样本,并未收集治疗后的样本以比较hsa_circ_0105035的表达差异对脑梗死体积及病情严重程度的影响,这也是我们未来的研究可以进一步探索的方向,从而促进缺血性脑卒中防治。
