真性小眼球性葡萄膜渗漏综合征的病理生理学机制与治疗进展▲
2023-06-12张天睿余晓伟范志刚
张天睿 余晓伟 石 砚 范志刚
(首都医科大学附属北京同仁医院眼科中心眼科研究型病房、北京市眼科研究所、北京市眼科学与视觉科学重点实验室,北京市 100730)
真性小眼球是指胚裂闭合后,眼球停止发育,使眼球表现为短眼轴、浅前房、厚巩膜、小角膜而晶状体厚度正常等特点,但无其他先天性眼部畸形或全身系统性疾病的一种先天性眼球发育异常[1]。患者常因自幼远视而影响视力发育,往往直到继发闭角型青光眼和真性小眼球性葡萄膜渗漏综合征(uveal effusion syndrome,UES)才就诊。真性小眼球性UES发病率极低,患者多为中年男性,常累及双眼,是一种以脉络膜积液伴浆液性脉络膜和/或视网膜脱离为特征的疾病,临床表现为“复发-缓解”型波动性病程[2],大多无需特殊治疗,但反复发作的UES可能使前房进一步变浅或加重眼部炎症,导致房角的粘连关闭,从而促进闭角型青光眼的发生、发展。临床上真性小眼球继发闭角型青光眼较常见,发病年龄较原发性闭角型青光眼更早,而且随着年龄增长,晶状体增厚,前房更拥挤,40~60岁为高发期。这类青光眼的治疗极具挑战性,往往需要行晶状体摘除以解除眼前节拥挤,同时联合玻璃体切除,尤其是贯通前后节的虹膜周切、局部悬韧带及玻璃体前界膜切开及前部玻璃体切除术,才能有效预防术后恶性青光眼的发生,此外还需要根据房角关闭情况及青光眼严重程度选择房角分离或滤过性手术。但对于本身极易自发UES的真性小眼球,任何降眼压治疗尤其是眼内手术都容易导致顽固的UES,严重影响患者的预后。因此,针对UES的预防性及治疗性手术也是真性小眼球继发闭角型青光眼手术治疗的重要模块之一,且只有了解真性小眼球性UES的发病机制,才能更好地防治这一并发症。鉴于此,本文主要介绍真性小眼球性UES的病理生理学机制与治疗进展,以期为真性小眼球性UES的治疗提供研究和诊治思路。
1 UES的临床表现
UES是指漏出液从脉络膜毛细血管中流出并异常地积聚于脉络膜上腔,使脉络膜肿胀,最终导致脉络膜脱离。UES的临床表现为巩膜表层静脉扩张、Schlemm管充血、前房变浅,眼后节可出现程度不一的浆液性视网膜脱离、脉络膜隆起、豹纹状眼底等表现[3]。UES患者眼内无明显炎症表现,多数患者眼内压在正常范围内。根据Uyama等[4]的研究,UES可分为三大类:(1)真性小眼球性UES最为常见,患者具有明显的真性小眼球特征,即眼轴长度小于19 mm,伴有高度远视,巩膜较厚且质地坚硬,手术治疗的预后较好;(2)无真性小眼球但伴有巩膜异常性UES,患者没有明显的短眼轴和屈光不正,只是巩膜较正常人更厚且质地坚硬;(3)特发性UES,患者眼球尺寸与巩膜厚度均正常。
2 UES的病理生理学机制
UES的病理生理学机制主要有4种假说:涡静脉引流不畅、巩膜对大分子物质通透性降低、低眼压和脉络膜血管通透性增高[2]。前两者是目前认可度较高的两种假说,低眼压主要见于真性小眼球青光眼术后患者,而脉络膜血管通透性增高这个假说目前尚未有文献能够直接证明。
2.1 涡静脉引流不畅 涡静脉为脉络膜血液的主要引流血管,经眶上静脉注入海绵窦或经眶下静脉注入翼静脉丛[5]。每只眼球的涡静脉数量通常为3~8条,其中65%的人有4条或5条[6-7]。临床医生在为真性小眼球患者进行手术时发现其巩膜比正常人要厚,真性小眼球并发UES患者的巩膜最厚部位的厚度在2.1~3.2 mm,而正常人群中,巩膜最厚的眼球后极部厚度大约为0.94 mm[8-10]。因此有人提出假说:增厚的巩膜阻碍了涡静脉内血液的流出,进而导致脉络膜上毛细血管充血,脉络膜毛细血管壁结构疏松,通透性较高,当管腔内压力升高时,液体自血管内渗出并积聚在脉络膜上腔,导致脉络膜脱离[11]。Brockhurst[12]对10只出现非孔源性视网膜脱离的真性小眼球进行了涡静脉减压术,即将涡静脉周围的巩膜切除,以解除巩膜对涡静脉的压迫,术后8只眼球的视网膜复位,这也从侧面证明了巩膜增厚导致涡静脉引流不畅引起UES这一假说的合理性。
2.2 巩膜对大分子物质的通透性降低 在真性小眼球患者中,巩膜异常不仅表现为厚度增加,巩膜本身的结构也发生了改变。Ward等[13]对一例UES患者的巩膜切片进行观察,发现巩膜上的胶原蛋白纤维排列紊乱,相互交织,大量葡萄糖胺聚糖样物质沉积在胶原蛋白纤维间隙。Stewart等[14]发现真性小眼球性UES患者自身的巩膜胶原蛋白纤维直径差异较大,可见“磨损样”外观,纤维蛋白在末端会像扫帚一样分裂成许多条细丝,并且这些部位弹性纤维的数量明显少于正常人。根据Gass的理论,眼组织内没有淋巴管,从血管内进入组织间隙的蛋白质无法通过淋巴管回流至体循环,其离开眼球主要通过两种方式:(1)通过Schlemm管和前部房水静脉回流;(2)直接经巩膜扩散或经巩膜流出管道进入后部眼眶[15]。巩膜结构的改变不仅压迫了涡静脉,还使得巩膜对蛋白质这类大分子物质的通透性降低。Forrester等[16]认为沉积在胶原纤维之间的葡萄糖胺聚糖类物质就是阻碍大分子物质跨巩膜流出的“罪魁祸首”。血管内的蛋白质是维持渗透压的主要物质,当白蛋白无法经巩膜流出时,会积聚在脉络膜上腔,导致腔内胶体渗透压增高,促使水分子从血管内渗入脉络膜上腔,导致脉络膜上腔积液和脉络膜脱离。真性小眼球的巩膜异常为先天性的,按照这个观点,UES的高发人群应以儿童、青少年为主,与临床发现的好发人群为中年人不相符。为此,Gass进一步完善了假说:异常巩膜的胶原蛋白和基质随着年龄的增长和激素水平的变化而不断改变,幼年时巩膜组织尚可转运部分蛋白,但随着巩膜对蛋白质的通透性进行性降低,最终白蛋白会逐渐积聚直至患者出现明显的临床表现[15]。
为了进一步验证以上假说,Jackson等[17]设计实验测量了白蛋白跨巩膜扩散系数:通过尤斯室,测量荧光染料标记的跨巩膜白蛋白浓度以计算真性小眼球性UES患者与正常人的白蛋白跨巩膜扩散系数,并用类似的染料结合法测量了脉络膜积液的白蛋白含量。研究结果显示:在相同条件下,UES患者巩膜对白蛋白的扩散系数为(1.22±0.67)×10-8cm2/s,对照组为(10.3±7.0)×10-8cm2/s,UES患者的扩散系数远低于正常人;UES患者脉络膜上腔积液中白蛋白浓度为200 g/L,总蛋白浓度为321 g/L,远高于其血清白蛋白浓度(42 g/L)和总蛋白浓度(70 g/L)。以上实验结果表明真性小眼球性UES患者的巩膜对白蛋白等大分子物质的通透性显著降低,显示出Gass假说的合理性。
2.3 脉络膜血管通透性增高 对真性小眼球性UES患者进行吲哚菁绿血管造影时,可观察到脉络膜上扩张的血管和弥漫性强荧光区域,表示有液体从血管渗出,但是无法确定液体从脉络膜血管渗出是由非特异性炎症引起的脉络膜血管渗透性增高,还是上述的涡静脉引流不畅导致的液体渗出或是脉络膜上腔的渗透压增高导致的液体渗出。因而真性小眼球患者存在脉络膜血管通透性增高,促使液体更易于从血管内渗出并积聚在脉络膜上腔。其导致UES的发生,目前只是一个推测,尚待进一步探索验证。
2.4 术后低眼压 真性小眼球患者虽然眼轴显著变短,但晶状体厚度与正常人相近,晶状体占眼球的比例较大,由于前房浅,更容易继发闭角型青光眼[18],因而常需要对这类患者进行降眼压治疗。Olayanju等[19]对小梁切除术后患者进行了20年的回顾性研究,发现10%的患者都发生了脉络膜脱离。青光眼引流阀植入、深层巩膜切除等手术也有较大概率出现这种并发症[20],其机理为青光眼术后滤过过强,使得脉络膜间质内压力下降,毛细血管内液体外渗的净驱动压升高,致使液体积聚于脉络膜上腔。此外,术后使用降眼压药物也同样会增加脉络膜脱离的风险[21]。
3 治 疗
3.1 手术治疗 手术治疗是目前针对真性小眼球性UES的主要治疗方式,相比于药物治疗,其效果更明显。我们大致将手术分成以下几类:(1)根据巩膜增厚导致涡静脉受压这一假说设计的涡静脉减压术(切除涡静脉周围巩膜),但是该手术风险较大,现已鲜有使用;(2)根据Gass提出的“巩膜结构异常阻碍蛋白质跨膜流出”这个假说而出现的板层巩膜切除术与巩膜全层切开术,前者又分为单纯的板层巩膜切除术和增加引流口的术式,如Gass手术、巩膜瓣下巩膜开窗术等,其主要通过削薄巩膜厚度来缓解脉络膜上腔积液,不涉及涡静脉减压;(3)另一类手术为目前主流的手术方式,其具体的巩膜切除范围、深度及切除部位也还在不断地探索和改进中。
3.1.1 涡静脉减压术 这是最早针对UES的手术,由Brockhurst提出,他对10只伴有UES的真性小眼球进行了涡静脉减压术(图1 A),术后8只眼脉络膜与视网膜复位,6只眼视力提高。他先切开Tenon氏膜和巩膜外组织,在涡静脉穿出巩膜位置的前方4 mm处做一个6 mm长、平行于眼球赤道的切口,再在静脉两侧距静脉4 mm处沿眼球子午线方向做两个切口,深度为能够透过巩膜看到青灰色的脉络膜为止,当巩膜瓣能使穿过巩膜的涡静脉完全暴露时,切除巩膜,对切口边缘、脉络膜和巩膜外血管都进行透热处理以防止积液和出血[12]。但是Gass在对患者进行该手术时发现游离涡静脉十分困难,很容易将其撕裂甚至离断,导致脉络膜上腔出血[15]。由于其难度大、并发症发生风险高,目前已很少有人采用该术式。
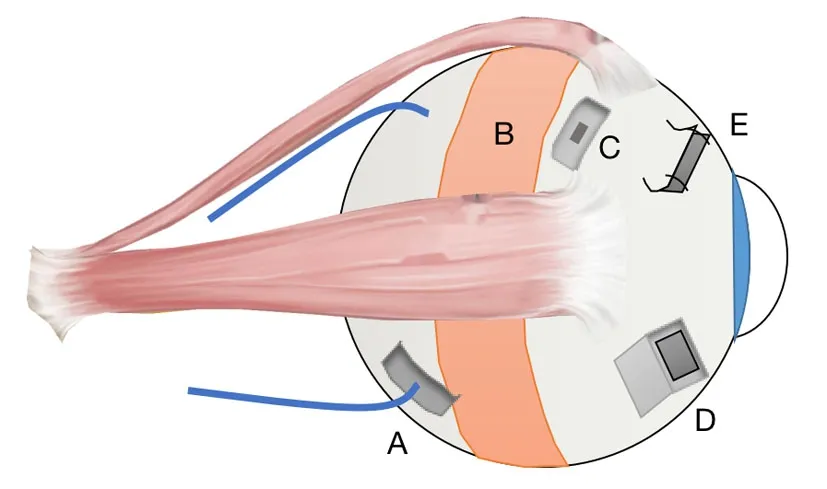
图1 真性小眼球UES的主要手术方式示意图
3.1.2 依据Gass理论的手术 (1)板层巩膜切除术:Ozgonul和Mansour分别对UES患者进行了板层巩膜切除术,Ozgonul采用的是4 mm×4 mm大小的2/3厚度巩膜切除,对于真性小眼球患者,该方法效果明显,但特发性UES患者却出现多次复发[22]。Mansour的方式更为激进(图1B),他切除了90%厚度的巩膜,并且扩大范围,沿巩膜外周环切360°,术后5例真性小眼球患者中只有1例复发,而且这种方式可以加快脉络膜积液的消除,缩短恢复时间[23]。(2)板层巩膜切除联合巩膜切开/开窗术:1983年,Gass为了验证自己的猜想,在眼球赤道前部1~2 mm(非涡静脉区)处进行了部分厚度巩膜切除术(图1C)。他在四个象限各做一个大小为5 mm×7 mm、厚度为整个巩膜1/2~2/3的巩膜切除区域,并在这些区域的中心做一个2 mm长的切口用来引流脉络膜上腔积液,术后10周患者脉络膜、视网膜全部复位[15]。1999年Uyama等[4]进行了不同于Gass的巩膜瓣下巩膜开窗术(图1D):他在眼球的颞下侧和鼻下侧的赤道处做一个4 mm×5 mm的巩膜瓣,厚度为巩膜全层的2/3,在巩膜瓣下,再切除剩余巩膜,面积为3 mm×4 mm,巩膜切口边缘灼烧以防止瘢痕组织粘连。Uyama对6只眼进行了手术,其中4只眼所出现的葡萄膜和视网膜脱离在术后1~2个月内好转;2只眼在重复手术治疗后好转;1只眼2年后复发,将巩膜瓣切除后痊愈。这种手术目前使用较为广泛,但其手术过程相对复杂。
3.1.3 巩膜全层切开术 受Gass理论的影响,Faulborn等[24]对5例真性小眼球性UES患者进行了巩膜全层切开术,他认为该手术不仅效果显著,步骤也更为简单。2013年,Kong等[25]进一步对该手术进行论述,其手术方式与前者类似:在距离角巩膜缘6~8 mm处的眼直肌之间,做一个前后长2~3 mm,水平长5~6 mm,形状类似于“[”的三边形开口,在两个直角处用线松散缝合,切口厚度为巩膜全层,切口数量可调整(图1E)。这个手术不仅可以直接引流脉络膜上腔积液,还可以通过降低巩膜张力来减轻对涡静脉的压迫,一举两得。但目前并没有大范围应用,其效果和可靠性还有待更多数据进行验证。
3.1.4 术后药物辅助 由于原切口处瘢痕组织的生长使得脉络膜上腔积液的引流通道再次受阻,部分UES在巩膜切除术后易出现复发。丝裂霉素C是一种能使细胞DNA解聚并抑制其复制的药物,常用于抗癌,在眼科领域,其常应用于外路手术以抑制巩膜外瘢痕组织的生长。有研究对出现术后复发的UES患者,在再次手术时使用丝裂霉素C,术后再未出现积液[26-27]。
3.2 药物治疗 药物治疗远不如手术治疗见效快,且容易复发,因此其常作为UES术后的辅助治疗方法。关于单纯使用药物治疗真性小眼球性UES的报道更是很少,远没有手术方法更有说服力。以下列举几种可能具应用价值的药物。
3.2.1 皮质类固醇药物和非甾体抗炎药 皮质类固醇药物和非甾体抗炎药都是抑制炎症反应的药物。大量文献显示这两类药物对UES的治疗效果并不显著,但Shields等[28]研究发现皮质类固醇可以治疗特发性UES,即眼球结构无先天异常的UES。但是目前没有证据表明该疗法对真性小眼球性UES有效。Kumar等[29]认为UES与脉络膜炎症导致的血管高通透性有关,故可采用非甾体抗炎药物治疗,但与前者一样,该方法只在特发性UES患者取得成功,而真性小眼球患者却无报道。因此,有人认为自发的真性小眼球性UES可能与炎症无关,但临床上普遍认为手术诱发的UES与炎症刺激相关,围术期仍需积极抗炎治疗。
3.2.2 拉坦前列腺素与乙酰唑胺 拉坦前列腺素常用于治疗青光眼,它可以改变睫状肌细胞外基质,增加房水经葡萄膜巩膜途径的外流,从而降低眼压。Weinreb[30]发现其还可以使巩膜上的胶原蛋白减少,增加巩膜对大分子物质的通透性。乙酰唑胺为碳酸酐酶抑制剂,可降低房水渗透压和房水生成量。有研究发现乙酰唑胺可以增强视网膜色素上皮层向外转运液体的功能,进而消除视网膜与脉络膜积液[31]。Park等[32-33]通过联合应用拉坦前列腺素和乙酰唑胺,成功治愈了多例UES患者。但是Sakai等[34]发现患有Sturge-Weber综合征伴发青光眼的患者在应用拉坦前列腺素后反而出现了脉络膜渗漏,可能是Sturge-Weber综合征会使巩膜外静脉压升高,拉坦前列腺素降低眼压,两者的共同作用使得葡萄膜渗漏更易发生。因此,这些药物治疗的作用机制和疗效还需要进一步研究证实。
3.2.3 抗血管内皮生长因子 血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种调节血管生成和血管通透性的物质,其对肿瘤转移、炎症反应、淋巴管生成等过程也产生影响[35]。在眼部,其与黄斑退行性病变、糖尿病视网膜病变有关。Guo等[36]发现一例真性小眼球性UES患者房水中VEGF含量高于正常人,因此推测VEGF与这种顽固性积液相关,其巩膜切除术后视网膜下积液未消失,在进行了玻璃体内抗VEGF治疗(贝伐单抗)后积液彻底消失。Song等[37]推测抗VEGF治疗可以降低脉络膜血管的通透性,减少渗漏。目前VEGF导致UES的具体机制尚无定论。
4 小结与展望
真性小眼球属于较罕见的疾病,因其独特的眼部解剖结构异常而易并发UES。虽然自发的UES多无需特殊治疗,但顽固性UES常常严重影响患者的视力预后,且极易复发。而且针对真性小眼球的任何眼部治疗都有可能导致顽固性UES,尤其是在治疗真性小眼球继发闭角型青光眼时,若处理不当,患者可因UES而导致失明、眼球萎缩,因此对临床医生是极大的挑战。了解UES的发病机制是防治真性小眼球性UES的关键,但目前其确切的病理生理学机制尚无定论。同时由于此病罕见,对其发病机制和治疗方式的研究进展也较为缓慢,相关的研究报道多为个案或数个病例的系列报道,鲜有较大规模的临床研究,而且治疗多为经验性治疗,缺乏统一的共识和规范。值得强调的是,临床医生无论对真性小眼球进行何种治疗都应该警惕UES的发生,未来仍需进一步探索其确切的病理生理学机制并摸索更有效、更安全的治疗方式。
