甲硝唑片的质量分析
2023-06-11张秉华牛龙青衷红梅杜亚俊邓玉龙周志云
张秉华?牛龙青?衷红梅?杜亚俊?邓玉龙?周志云
摘要:目的 评价国内不同企业生产的甲硝唑片的质量。方法 按照现行质量标准检验结合探索性研究,包括有关物质方法的测定、亚硝酸盐含量的测定、溶出行为一致性及溶出度方法考察、微生物限度方法适用性实验及分析,综合评价产品质量及现行质量标准对产品质量的可控性。结果 抽取的130批样品,按法定标准检验合格率为100.0%。探索性研究结果表明,本品的杂质水平主要与原料药有关,不同企业的杂质检出情况差异不明显;不同企业样品均检出亚硝酸盐,但均符合ICH限度要求;各企业样品15 min的溶出度均大于85%;微生物限度试验结果显示甲硝唑片对需氧菌总数均有不同程度的抑制作用。结论 目前甲硝唑片总体质量较好;现行标准需进一步提高,建议现行标准增加有关物质和亚硝酸盐含量的检测方法。
关键词:甲硝唑片;质量评价;药品标准;有关物质;亚硝酸盐;溶出行为
中图分类号:R917文献标志码:A
Abstract Objective To evaluate the quality of metronidazole tablets from different manufactures. Methods The quality and standard controllability of metronidazole tablets was evaluated by researching on the original standard and the exploratory experiments including the determination of related substances and nitrite, dissolution behavior consistency and dissolution method inspection, and microbial limit method suitability test and analysis. Results The qualified rate was 100.0% for the 130 batches of samples extracted according to the original standard. The exploratory research results showed that the impurity level of this product was mainly related to the API, and the difference of impurity detection among different enterprises was not obvious. Nitrite was detected in samples from different enterprises, which met the ICH limit requirements. The dissolution of samples from all enterprises in 15 min was more than 85%. The results of microbial limit test showed that metronidazole tablets had different degrees of inhibition on aerobic bacteria. Conclusion The quality of metronidazole tablets was good at present and the current standard should be further improved. It was proposed that the related substance method and the nitrite method should be added.
Key words Metronidazole tablets; Quality evaluation; Drug standard; Related substance; Nitrite;
Dissolution behavior
甲硝唑為第一代硝基咪唑类抗感染药物,对厌氧菌具有较强是抗菌作用,其抗菌原理是其硝基被易感生物激活还原成一种高活性的自由基阴离子,以蛋白质和DNA分子为靶点,抑制细菌的DNA合成,从而干扰细菌的生长、繁殖,最终导致细菌死亡。甲硝唑由GD SEARLE公司(辉瑞子公司)研发,1960年甲硝唑片在法国上市,商品名“FLAGYL”,1981年在中国境内上市。目前国内上市的制剂包括片剂(主要规格为0.2 g,另外还有0.1 g、0.25 g和0.5 g上市)、胶囊、注射液、溶液剂、凝胶剂、栓剂等。现行的USP、JP及ChP均收载有甲硝唑原料和甲硝唑片。
甲硝唑片为2022年国家质量评价抽验品种,共抽到35个生产企业的130批样品,涉及全国31个省、自治区和直辖市的药品生产、经营和医疗单位,其中93批抽自经营单位,6批抽自医疗机构,31批抽自生产企业,可较客观地反映国内该品种的质量现状。本文按现行质量标准对130批样品进行检验,并针对其中发现的问题开展相应的探索性研究,进而从有效性、安全性角度对该产品目前的质量现状进行评价,并对完善制剂的质控标准提出建议。
1 仪器及试药
1.1 仪器与试剂
高效液相色谱仪(岛津LC-2030 3D)、离子色谱色谱仪(22176-6000)、RC1208D型溶出度仪(天津天大天发科技公司)、UV-2600型紫外-可见分光光度计(日本岛津公司)、电子分析天平(瑞士梅特勒XPE205)、高纯水机(美国Millipore公司)、卧式矩形压力蒸汽灭菌器(上海华成医用核子仪器公司)、霉菌培养箱(重庆四达实验仪器厂)、OLYMPUS.CH型三目显微镜(日本奥林巴斯公司)、pH酸度计(赛多利斯科技(北京)有限公司)。
甲醇(色谱纯,美国SIGMA-ALORICH公司)、氢氧化钾(分析纯)、盐酸(分析纯)。
1.2 对照品
2-甲基-5-硝基咪唑对照品:批号100191-20180,纯度100.0%,中国食品药品检定研究院。亚硝酸钠对照品:批号E003013,纯度99.0%,北京曼哈格生物科技有限公司。
1.3 菌株
金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26 003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B) 10 104]、枯草芽胞杆菌(Bacillus subtilis)[CMCC(B)63 501],大肠埃希菌(Escherichia coli)[CMCC(B) 44 102]、白色念珠菌(Candida albicans)[CMCC(F) 98 001]、黑曲霉( Aspergillus niger)[CMCC(F) 98 003]。
1.4 样品
甲硝唑片为2022年国家抽验样品,共130批,样品涉及35个生产企业,个别企业未提供原辅料,部分企业提供了近效期样品。
2 实验方法
2.1 法定检验
分别按照《中国药典》2020年版标准及各企业注册标准对130批甲硝唑片进行检验。
2.2 探索性研究
2.2.1 有关物质测定
筛选并优化已通过一致性评价的企业G和企业H有关物质HPLC方法,并对所有企业样品及部分近效期样品有关物质进行考察[1-2]。色谱方法为:Welch
(250 mm×4.6 mm,5 μm)色谱柱;流动相:甲醇:水(20:80, V/V);柱温:30℃;流速:1.0 mL/min;检测波长315 nm;进样量:20 μL。
2.2.2 亚硝酸盐测定
筛选并优化已通过一致性评价两家企业标准中的亚硝酸盐IC方法,并对部分企业的亚硝酸盐含量进行考察[3-4]。色谱条件:色谱柱AS11-HC RFICTM;柱温:30℃;淋洗液:氢氧化钾溶液;进样量:10 μL,梯度洗脱表见表 1。
2.2.3 溶出行為一致性及溶出度方法考察
考察35家厂家的样品在15 min时的溶出度,同时对两种溶出度计算方式进行比较[5-6]。
2.2.4 微生物限度方法适用性实验及分析
根据《中国药典》附录“微生物限度检查法”对甲硝唑片进行需氧菌总数的检验,分别采用平皿倾注(直径90 mm,1 mL/皿)法和中和培养基稀释法对需氧菌总数和控制菌大肠埃希菌进行适用性试验[7]。平皿倾注法适用性试验,试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值均应在0.5~2范围内,即方法有效。中和培养基稀释法适用性试验分别设立试验组、阳性组和阴性组,革兰染色镜检试验组和阳性组均应检出大肠埃希菌革兰阴性菌直短杆菌,两端钝圆,无芽孢),阴性组应无任何菌落生长。
3 结果与讨论
3.1 法定检验结果
按现行质量标准检验,130批甲硝唑片全部合格,合格率为100.0%。
比较不同企业法定检验执行的质量标准差异,主要区别:①是否设置有关物质和亚硝酸盐检查项目;②亚硝酸盐限度存在差异;③溶出度计算方式存在差异。
3.2 探索性研究结果
3.2.1 有关物质测定结果
对不同企业的甲硝唑片进行有关物质考察,典型色谱图见图1。从典型色谱图可以看出,不同厂家甲硝唑片主要检出4个杂质,查询文献,同时利用中国食品药品检验研究院提供的甲硝唑杂质A(2-甲基-5-硝基咪唑)对照品进行定位,确定检出的4个杂质中有一个已知杂质,其他3个均为未知杂质。杂质I为起始物料,杂质A为起始物料位置异构体,参照通过一致性评价的企业提供的研究资料和国抽标准内有关物质检验情况,杂质A和杂质I出峰位置基本一致,两者合并控制。
采用通过一致性评价的企业有关物质的测定方法,对未通过一致性评价企业样品进行有关物质考察。已知杂质2-甲基-5-硝基咪唑按外标法计算,检出范围在0.004%~0.02%,其中企业A有一批样品已知杂质检出量为0.02%,企业E和F均有一批样品已知杂质检出量为0.01%,但均小于企业G和H的已知杂质标准限度(0.1%);杂质总量检出范围为0.01%~0.06%,均在限度0.4%范围内。与通过一致性企业G和企业H比较,6家企业杂质检出情况与企业G和H无较大差异。对所有企业样品的杂质A(杂质I)、和杂质总量数据绘制频数分布图和箱式图,见图2~3。
从频数图可以看出,各企业样品基本呈正态分布,已知杂质、其他单个最大杂质和杂质总量分布较为均匀。从箱式图可以看出,与通过一致性评价的企业G和企业H的样品检验情况比较,其他6家企业样品中检出的其他未知杂质个数更多,各杂质水平稍偏大,企业A个别批次的样品已知杂质检出情况和杂质总量出现了离散情况,但各企业整体杂质检出情况比较稳定,杂质检出含量普遍较小。
通过对企业A和E提供的近效期样品和各企业提供的原料进行检测发现,企业A、E近效期样品的杂质检出情况和效期样品检出情况一致,且各杂质含量无较大差异,也反应了甲硝唑片在正常的保存情况下,药品质量较稳定;不同企业甲硝唑片检出杂质种类、个数和甲硝唑原料检出杂质基本一致,说明甲硝唑片剂生产过程中基本不引入其他工艺杂质。
综上可知,甲硝唑片中的杂质水平基本由其原料药的杂质水平决定,提示甲硝唑片中的杂质主要来源于原料药,控制好原料药生产工艺是保证制剂质量的关键。从甲硝唑片有关物质检出情况推测,各企业由原料引入的工艺杂质均较低。
3.2.2 亚硝酸盐测定结果
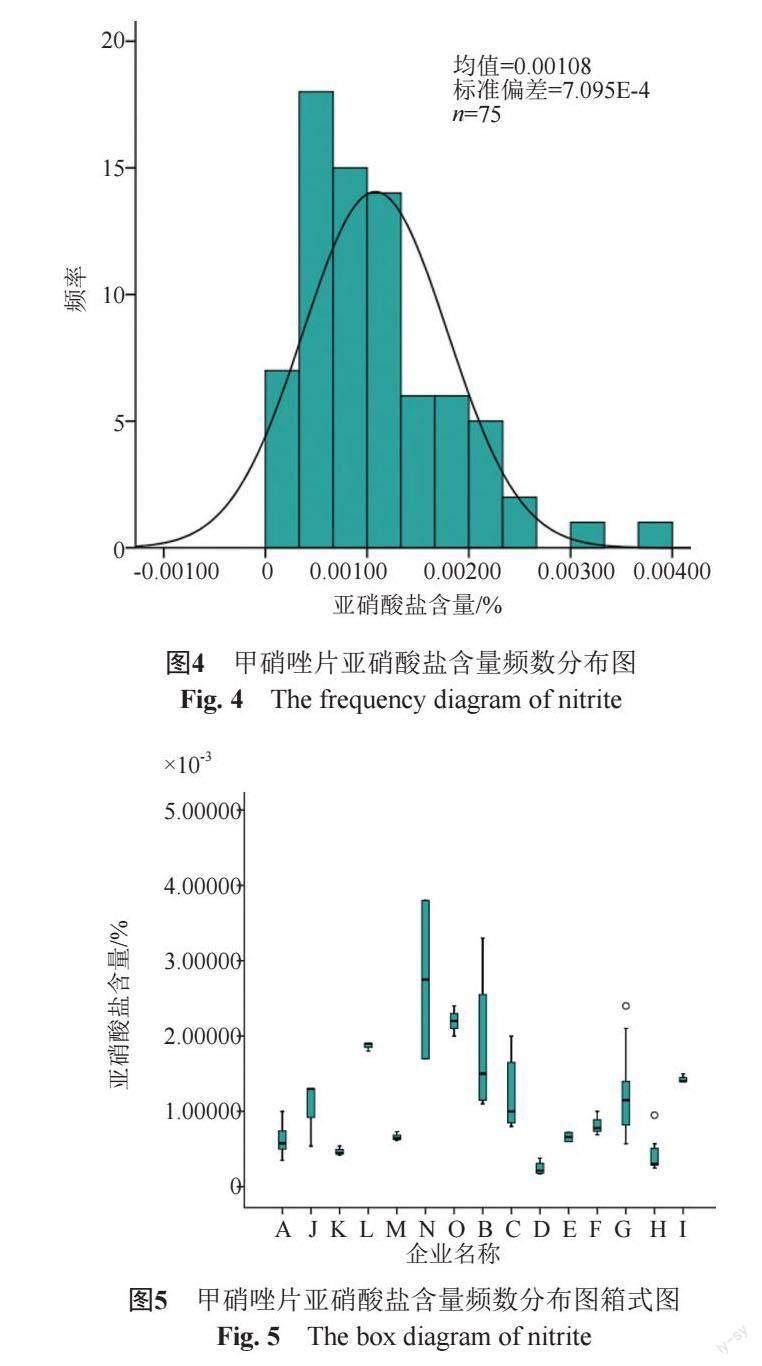
参考文献[8-9]及通过一致性评价的企业H企业标准,采用离子色谱法对部分企业的亚硝酸盐含量进行了考察,并进行比较分析,测定结果频数分布图见图4,箱式图见图5。
甲硝唑片最大日服剂量2400 mg,治疗期不超过1个月,参照ICH M7指导原则,日摄入量按120 μg/d计算,亚硝酸盐限度应为0.005%。按通过一致性评价的企业H亚硝酸盐检查标准,对抽样批数≥2的其他未控制亚硝酸盐的企业进行亚硝酸盐计算,通过分析甲硝唑片亚硝酸盐测定结果,亚硝酸盐检出范围在0.00017%~0.0019%,各企业亚硝酸盐均在限度0.0045%范围内。与通过一致性评价的企业G和H的样品检验情况比较,13家企业样品亚硝酸盐检出情况基本一致。
由频数分布图和箱式图可知,各企业样品基本呈正态分布,亚硝酸盐含量分布较为均匀,企业B和N亚硝酸盐含量批间差异较大,但各企业整体亚硝酸盐检出情况比较稳定,检出含量普遍较小。
亚硝酸盐为甲硝唑结构中硝基的降解产物,大量摄入亚硝酸盐可诱导高铁血红蛋白血症,临床表现为口唇,指甲发绀,皮肤出现紫斑等缺氧症状,可致死亡;此外,亚硝酸盐存在一定的致癌性,为了更好地控制甲硝唑片的质量,建议各企业在内部标准中对亚硝酸盐含量进行控制。
3.2.3 溶出行为一致性及溶出度方法比较
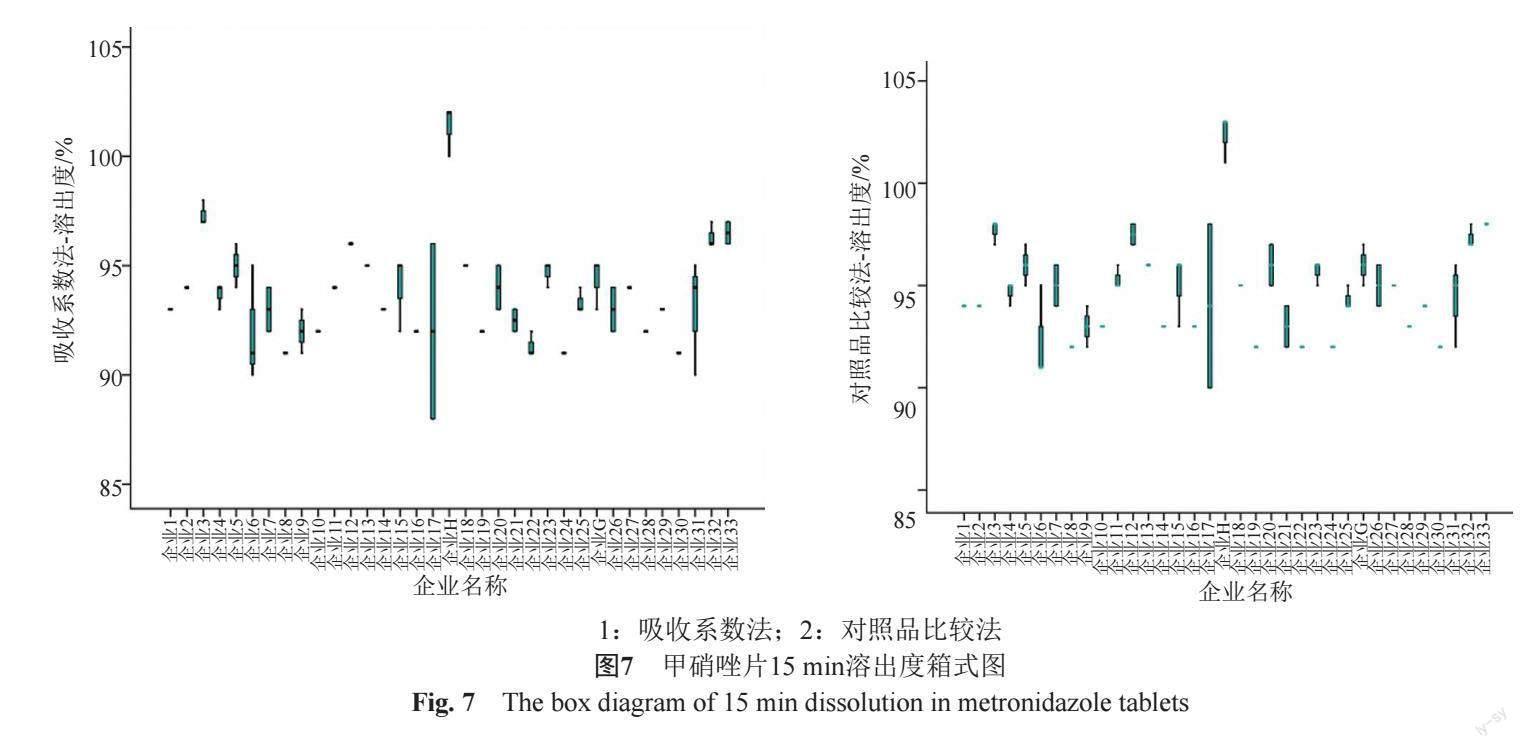
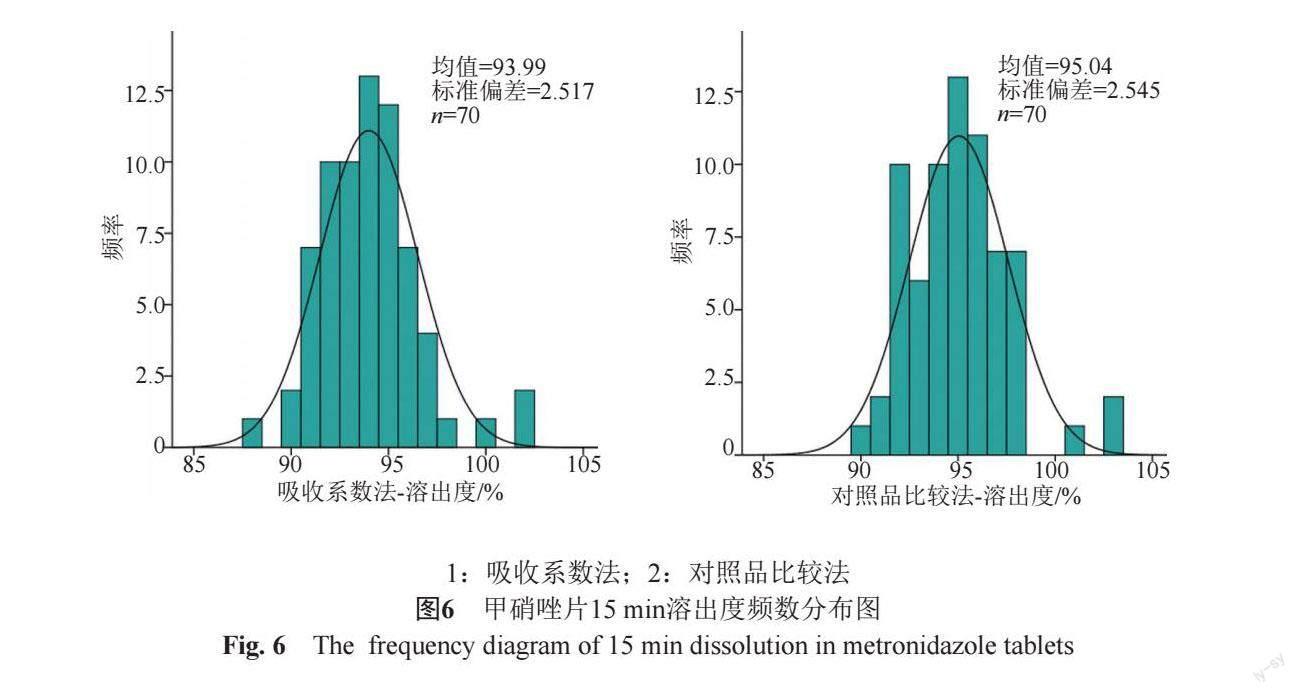
按《普通口服固体制剂溶出度试验技术指导原则》要求,对35家企业15 min溶出度进行了考察,同时对溶出度两种计算方法进行了比较,如图6~7所示。
由频数分布图和箱式图可知,各企业溶出度均值并未出现明显的离散,35家企业样品15 min溶出度均大于85%,70批樣品的溶出度均值数据呈正态分布,分布均匀。
通过对70批样品分别按吸收系数法和对照品比较法考察,实验表明两种方法的溶出度结果基本一致。考虑两种计算方式各有优势,且计算结果无较大差异,故各企业可继续沿用各自执行标准的计算方式。
3.2.4 微生物限度测定
对35家企业的130批甲硝唑片采用平皿倾注法分别进行需氧菌总数、霉菌和酵母菌总数检测,所有供试品需氧菌总数、霉菌和酵母菌总数均符合规定。采用中和培养基稀释法进行控制菌(大肠埃希菌)检查方法,所有供试品均没有检出大肠埃希菌。
4 结论
按法定标准检验,甲硝唑片合格率为100%,结合探索性研究情况认为,甲硝唑片总体质量情况较好。探索性研究结果显示,甲硝唑片整体杂质检出情况比较稳定,杂质检出量普遍较小,与原料药杂质含量相近;近效期样品杂质检出情况和效期样品检出情况一致,且各杂质含量无较大差异,反应了甲硝唑片在正常保存情况下,药品质量稳定。为更好地反映药品质量的标准,建议对质量标准中的方法进行统一。
参 考 文 献
向东, 杨智勇, 何建武, 等. 甲硝唑有关物质测定及杂质谱研究[J]. 医药导报, 2017, 36(3): 308-311.
苏中利. 关于甲硝唑片有关物质检查的探讨[J]. 中国基层医药, 2003, (6): 552-553.
汪杨俊杰. 亚硝酸盐及其对人体的危害[J]. 化工管理, 2017, (5): 118-120.
张颖琦, 沈俊毅, 徐映如, 等. 亚硝酸盐对人体的危害及检测方法的进展[J]. 职业与健康, 2015, 31(6): 851-855.
江冬英, 胡巧云. HPLC-UV法测定不同厂家甲硝唑片的含量和溶出度[J]. 中国医药指南, 2012, 10(17): 100-101.
门铁军, 李敬波. 影响甲硝唑片溶出度的因素[J]. 黑龙江医药, 2003, 16(3): 187-188.
史永惠, 张烨, 安月华, 等. 甲硝唑片微生物限度检查方法验证 [J]. 北方药学, 2013, 10(6): 15.
勾秋芬, 封家福, 陈玉玺. 离子色谱法对甲硝唑片中亚硝酸盐含量的测定[J]. 基因组学与应用生物学, 2017, 36(7): 2787-2792.
曹大春, 余敏灵, 周筠. 应用离子色谱法测定甲硝唑片中亚硝酸盐的含量[J]. 实用医院临床杂志, 2014, 11(4): 191-192.
