国产诺氟沙星口服固体制剂的质量评价
2023-06-11宋丽娟孙荧鲍实吴蔚刘晨曦
宋丽娟?孙荧?鲍实?吴蔚?刘晨曦
摘要: 目的 对国产诺氟沙星胶囊和片的质量现状进行评价并提出意见。方法 采用法定标准对288批胶囊和13批片抽检样品进行了检验,并对有关物质、杂质谱分析、遗传毒性杂质、溶出曲线和水分等关键项目进行探索性研究。结果 301批样品法定检验合格率为100%。探索性研究优化了有关物质测定方法,并对杂质来源进行了归属;建立了遗传毒性杂质(杂质2)的LC/MS检测方法;发现过评胶囊与未过评胶囊质量存在明显差异,表现为二者的溶出曲线存在显著差异,过评胶囊的溶出量明显高于未过评胶囊,且过评胶囊和片剂的水分控制相对较好,采用PVC加套袋包装可以有效地阻隔水分的侵入。结论 诺氟沙星片质量总体一般,胶囊质量总体较差;通过一致性评价企业的片/胶囊质量整体优于未过评企业的产品。建议现行标准应优化有关物质和溶出度测定方法;增订杂质2和水分检查;建议片/胶囊生产企业对原料的晶型与粒度、产品包装形式进行严格把控;尽快开展一致性评价工作。
关键词:诺氟沙星胶囊;诺氟沙星片;质量评价;有关物质;杂质;溶出度;水分;包材
中图分类号:R978.1文献标志码:A
Abstract Objective To evaluate the quality of domestic norfloxacin capsules and tablets and put forward a series of improvement suggestions. Methods 288 batches of capsules and 13 batches of tablets were tested using the legal standards; and exploratory studies were carried out on key items like impurity spectrum, genotoxic impurity, dissolution curves and water. Results The qualified rate of 301 batches of samples was 100%. Through the exploratory studies, testing methods of related substance were optimized, source of major impurities were attributed and analysis methods of genotoxic impurity were established. In addition, according to dissolution curves tests, the dissolution of capsules passing the consistency evaluation were higher than that of unevaluated varieties and the water content of the over-evaluated capsules and tablets were controlled in low level, and the PVC plus sleeve packaging form could effectively block the intrusion of moisture. Conclusion The quality of norfloxacin tablets was under general standards. However, the quality of norfloxacin capsules was of poor quality. It is recommended that the detection methods of related substances and dissolution determination should be optimized, adding the method of genotoxic impurity and water. It is also suggested that the tablet/capsule manufacturers should strictly control the crystal shape and particle size of raw materials and product packaging forms, and carry out the consistency evaluation as soon as possible.
Key wordsNorfloxacin capsules; Norfloxacin tablets; Quality evaluation; Related substances; Impurity; Dissolution; Water; Packaging form
諾氟沙星是杏林制药株式会社1978年研制的第三代喹诺酮类抗生素,主要用于治疗敏感菌所致的感染等[1]。诺氟沙星原研制剂包括片剂和滴眼剂,其中诺氟沙星片分别于1983年在意大利由默沙东公司上市和1984年由杏林制药在日本上市,商品名分别为Norocin和Baccidal。目前国内使用的诺氟沙星口服固体制剂主要为胶囊和片剂,其中胶囊剂为我国独有的剂型。诺氟沙星胶囊和片剂的现行标准均收载于《中国药典》2020年版,国外药典(USP40、BP2021)中收载了片剂质量标准,胶囊剂标准为我国特有剂型的标准。在仿制药一致性评价工作中,日本杏林制药的诺氟沙星片为国家药品监督管理局公布的第五批参比制剂,国产仿制的片剂与胶囊剂均以此为参比制剂进行生物等效研究。通过一致性评价(简称过评)后的产品执行各企业的注册标准。
2022年国家药品抽检任务共抽取到诺氟沙星胶囊288批、片剂13批,涉及83家生产企业的88个批准文号,两种制剂的规格均为0.1g;其中过评企业的产品有19批,占总数的6.3%,包括2家胶囊生产企业(约为过评企业的33.33%)的8批样品和2家片剂生产企业(约为过评企业的50%)的11批样品。本次抽检工作基于法定检验中发现的有关物质、溶出度等问题,针对性地开展探索性研究工作,通过对比过评制剂和未过评制剂的质量差异,从安全性和有效性的角度评价国产诺氟沙星固体制剂的质量现状,分析存在的问题,进而明确提高产品质量的方向。
1 仪器及试药
1.1 仪器
Waters高效液相色谱仪(Waters e2695-2489和Waters e2695-2998);Agilent高效液相色谱仪(Agilent1260);液相色谱质谱联用仪(日本岛津公司IT TOF);超高效液相与三重四极杆质谱联(岛津LC30和AB4500QQQ);溶出仪(SOTAX AT 7smart、SOTAX CE7 smart 和Agilent708+850DS);卡氏水分仪(Metrohm 890+885);X射线衍射仪(北京普析XD6);差示扫描量热仪(Waters DSC250);电子天平(Mettler Toledo XS205)。
1.2 试药
乙腈(色谱纯,Merck)、超纯水(Millipore仪制备),甲酸(色谱纯,Fisher),乙酸铵(分析纯、国药集团化学试剂有限公司),高氯酸钠(分析纯、国药集团化学试剂有限公司)、三乙胺(色谱纯,Merck)、磷酸(分析纯、国药集团化学试剂有限公司)。
对照品:诺氟沙星(批号130450-201907,含量99.6%),诺氟沙星杂质A(批号130610-201903,含量99.6%),诺氟沙星杂质B(批号130611-201001,含量100%),诺氟沙星杂质E(批号510121,含量100%),諾氟沙星杂质K(批号510128-201501,含量100%),依诺沙星(批号130453-201802,含量91.5%)和环丙沙星(批号130451-201904,含量83.1%)均来源于中国食品药品检定研究院;诺氟沙星杂质C(批号0428-RC-0035,含量80.6%),诺氟沙星杂质D(批号0205-RC-0051,含量80.6%),诺氟沙星杂质F(批号0316-RD-0050,含量95.7%),诺氟沙星杂质G(批号0722-RC-0017,含量99.3%),诺氟沙星杂质H(批号0511-RC-0062,含量90.2%),诺氟沙星杂质I(批号0428-RC-0034,含量88.5%),诺氟沙星杂质J(批号0428-RC-0033,含量93.4%)和诺氟沙星遗传毒性杂质2(批号0429-RD-0080,含量98.7%)均来源于CATO Research Chemicals Inc。
样品:301批次诺氟沙星胶囊和片剂(正文中Y代表原料企业,J代表胶囊,P代表片剂,数字代表企业编号)来自全国83家固体制剂生产企业,为2022年诺氟沙星国家药品抽检样品。
2 方法
2.1 法定检验
未过评胶囊和片剂按《中国药典》2020年版二部进行法定检验;两家企业的过评胶囊分别执行企业注册标准YBH15832020和YBH07902019;两家企业的过评片剂执行注册标准YBH12412020和 YBH05432020。主要检测项目包括:鉴别、有关物质、溶出度、重量(片重)差异、含量测定。胶囊剂标准YBH15832020中增加了干燥失重和杂质2的检查;片剂标准YBH12412020中增加了乙醇量检查。
2.2 探索性研究
针对法定检验中发现的问题,通过文献检索[2-3]及对调研情况的分析,对产品的有关物质方法、杂质谱分析、遗传毒性杂质、溶出曲线、影响药物的稳定性因素等项目开展研究。
2.2.1 有关物质方法优化
参考相关文献[4-5]及BP2021方法,以可以有效分离国评中涉及的所有诺氟沙星已知杂质为目标进行优化。
色谱条件:色谱柱为Waters SunFire C18(4.6 mm×250 mm,5 μm);流动相A:醋酸铵高氯酸溶液(取醋酸铵1.0 g和高氯酸钠7.0 g,加水1300 mL使溶解,用磷酸调节pH值至2.4);流动相B:乙腈,按表1线性梯度洗脱。检测波长为265 nm;流速为
1.4 mL/min;柱温为50℃;进样体积20 μL。
2.2.2 杂质谱研究
LC/MS测定。色谱条件:采用Discovery RP Amide C16(4.6 mm×250 mm,5μm)色谱柱,以0.1%甲酸水(流动相A)-乙腈(流动相B),按表1进行梯度洗脱;柱温为50℃;流速为1.4 mL/min;进样体积
20 μL;质谱条件:离子化方式为E S I ( + ),一级扫描范围为100~800,二级扫描范围为50~500。离子源电压:4.5 kV,雾化气流量:1.5 L/min,Block温度:200 ℃,DL温度:200 ℃,干燥气压力:100 kPa,离子累积时间为10 msec,碰撞气体注入量为50%。
2.2.3 遗传毒性杂质-杂质2方法的建立
对照品溶液:取杂质2对照品适量,精密称定,加乙腈溶解制成约含0.05 mg/mL的溶液。精密量取适量,用稀释剂定量稀释制成约含杂质2为2、5、10、15和20 ng/mL的溶液。
供试品溶液:取诺氟沙星制剂适量,精密称定,加稀释剂溶解制成约含0.1 mg/mL的溶液。
LC/MS色谱条件:色谱柱为Agilent ZORBAX SB-C18(100 mm×2.1 mm,3.5 μm);流动相A相为0.1%甲酸-水溶液;B相为0.1%甲酸-乙腈溶液;按表2线性梯度洗脱;检测波长为278 nm;流速为0.6 mL/min;
柱温为40℃;进样体积2 μL。质谱条件:离子源:ESI(+);毛细管电压:5500 V;雾化器温度:400℃;扫描方式:MRM,正离子扫描模式;干燥气流速:35 psi。
2.2.4 溶出曲线及生物等效性研究
以日本杏林制药的诺氟沙星片为参比制剂,选取大于6批次的10家企业的样品,参照日本橙皮书,采用桨法,分别以pH 1.2、pH4.0、 pH 6.8和水各1000 mL作为溶出介质,转速为50 r/min测定,参考文献[6],绘制溶出曲线。采用Gastro plusTM软件预测诺氟沙星固体制剂体内药动学曲线,进行生物等效性预测。
新溶出度测定方法:采用桨法,以pH6.8的磷酸缓冲液1000 mL为溶出介质,转速为50 r/min,温度37℃,取样时间60 min,限度80%。色谱条件:采用X-Bridge-C18色谱柱(150 mm×4.6 mm,5μm),以0.1%磷酸溶液-乙腈(85:15, V/V)为流动相;检测波长为275 nm;流速1.0 mL/min;柱温40℃;进样量5 μL。
2.2.5 水分与包材相关性研究
针对本次抽检中胶囊套袋包装有复合膜袋包装和复合膜袋加干燥剂包装2种包装形式,片剂包装有高密度聚乙烯塑料瓶、PVC加套袋、PVC加套袋并内置1袋硅胶干燥剂3种包装形式。考察水分对套袋和未套袋样品的影响。对14家企业样品在温度40℃,湿度75%条件下放置0个月、1个月和3个月后测定水分。
2.2.6 原料晶型及粒度相关研究
粉末X射线衍射法:射线管为Cu靶,管压36 kV,管流20 mA,扫描范围(2θ)为3°~80°;发射狭缝为1°,接收狭缝为0.15°,防散射狭缝为1°;单色化方法:有滤玻片,采样步宽0.02;连续扫描,扫描速度为8°/min。
DSC法:采用铝坩埚,升温程序:初始温度为40℃,以20℃/min升至250℃,恒溫3 min,平衡50℃。
粒度分布分析:采用Malvern Mastersizer 2000粒度仪,按《中国药典》通则粒度和粒度分布测定法第三法[7]测定;遮光度为4%~7%,颗粒吸收率为1.462。
表观溶解速率测定:采用流池法,溶出介质为pH 6.8缓冲液,泵速为8 mL/min,测定不同晶型原料的表观溶解速率。
利用X-粉末衍射分析法和DSC法考察诺氟沙星原料晶型的一致性;粒度分布分析比较各企业原料的粒度分布差异;流池法测定不同晶型原料的溶解速率。
3 试验结果
3.1 法定标准检验
法定检验结果显示,虽然所有样品均符合规定,但分析过程提示,有关物质、溶出度、含量测定项目仍需进一步完善。
3.1.1 有关物质
检验中发现,诺氟沙星制剂涉及6个标准,不同标准对杂质的种类和含量要求不同,过评企业的标准也不一致;未过评产品的杂质总量偏高,其中“其他单杂”的含量可高达0.4%,其主要原因在于ChP2020标准仅对杂质A进行了规定,未对诸如杂质B、杂质E和杂质K等特定杂质分别进行控制。此外,按照ChP2020方法进行检验,样品主峰前的杂质E和主峰不能分离,未能真实地反应各特定杂质的量。因而,将建立统一、严谨的有关物质检查方法,分析其杂质谱、杂质来源及影响因素,作为探索性研究的方向之一。
3.1.2 溶出度
288批诺氟沙星胶囊的溶出度检验均符合规定,但溶出量差异较大,这与不同企业的处方投药量和工艺相关。在法定溶出条件下,介质区分效果较差,所有样品在15 min内均能溶出80%。诺氟沙星为难溶性药物,由调研情况看,大部分制剂企业的原料来源于同一企业,辅料来源于不同企业。通过对调研回函的分析,认为影响溶出度的主要因素为原料的晶型、粒度和制剂的水分。鉴于溶出度是影响体内生物利用度的重要因素,探索研究中将对上述因素对溶出度的影响展开研究。
3.2 探索性研究
3.2.1 有关物质分析方法的优化
优化后的分析方法可以实现对所有诺氟沙星已知杂质的有效分离(图1);按优化方法对抽取的胶囊和片剂行检测,各企业样品可检出7~19个杂质,杂量总量分布于0.11%~0.39%,均值为0.23%,杂质数目及含量均较优化前方法提高(图2)。
3.2.2 杂质谱分析
通过分析诺氟沙星的合成路线[8-11]结合强制降解试验,对12种已知杂质的来源进行了归属。各杂质结构图见表3。杂质B和杂质K为胶囊和片剂的共有杂质。诺氟沙星主要有4个降解杂质,杂质B、杂质D、杂质G和杂质2,其中杂质B为主要降解杂质,可由诺氟沙星经多种途径降解产生,说明其既是在原料合成中需要控制的工艺/降解杂质,也是制剂生产、储存过程中需要控制的降解杂质。杂质K仅在原料合成过程中产生,也作为分析制剂中原料来源的特征性杂质。
3.2.3 杂质2检测结果
对诺氟沙星胶囊和片剂中的杂质2进行测定[12],按标准曲线法计算含量,结果见图3。胶囊企业J9、J13、J15和片剂企业P1产品中杂质2控制得较好,均在15 ppm以内。其他企业产品中的杂质2均超出限度。其中胶囊企业J9和片剂企业P1为过评企业。杂质2属于芳香胺类化合物,属于潜在基因毒性杂质,建议在诺氟沙星制剂质量标准中增订杂质2检查项,以进一步保证临床用药的安全性。
3.2.4 溶出曲线及生物等效性结果
在4种溶出介质中,水和pH6.8的缓冲液有一定的溶出区分能力,能将通过一致性评价的产品和未通过一致性评价的产品进行区分。在pH6.8的溶出介质中,4家过评企业(J9、J10和P1、P3)样品的溶出曲线与参比制剂的溶出曲线相似;P2企业片剂虽未通过一致性评价,但在上述两种介质中溶出曲线均与参比制剂相似;其它未过评胶囊企业的产品,在上述两种介质中溶出曲线与参比制剂均不相似(图4~5)。
采用Gastrol PlusTM软件,将诺氟沙星片在不同溶出介质的体外释放曲线作为体内释放曲线,预测药物体内的PK情况[13]。结果显示,以pH6.8溶出曲线作为体内释放曲线时,预测结果基本能与体内PK实测数据吻合,且释放与吸收曲线与日本杏林片剂体内数据建模得到的结果一致,故采用新建立的溶出度方法(溶出介质为pH6.8)测定的溶出曲线进行生物等效性拟合。
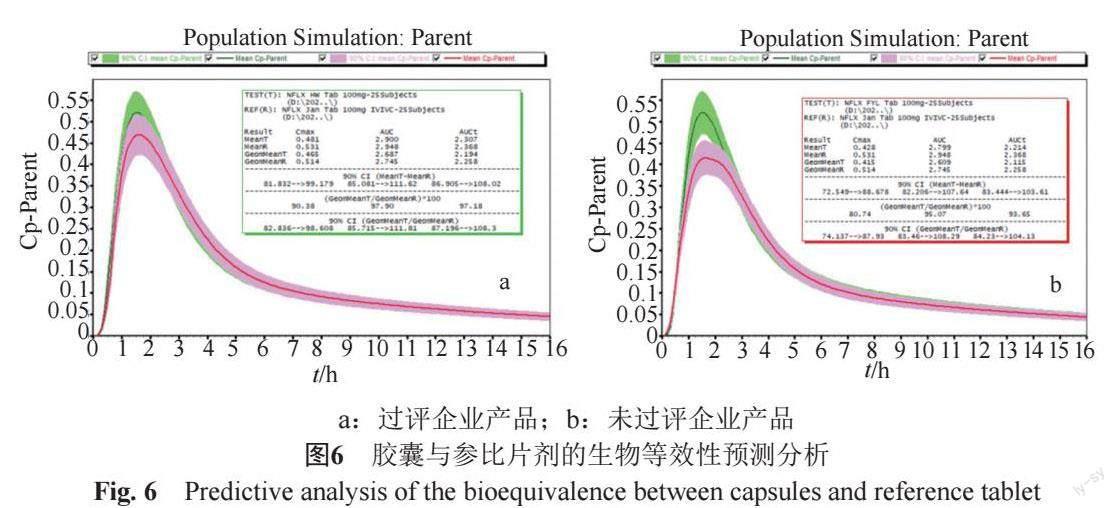
采用上述模拟软件的群体模拟模型,以Cmax和AUC为指标,模拟国产胶囊和片剂与参比制剂的等效性。模拟结果均值的90%置信区间如果在参比均值的80%~125%范围内时,即认为二者生物等效。模拟结果表明,通过一致性评价的制剂,无论是片剂还是胶囊剂,都能够与原研片剂生物等效;但未通过一致性评价的胶囊剂则与原研片剂生物不等效(图6)。
3.2.5 水分及包材相关性结果
影响胶囊剂溶出的主要因素包括囊壳和内容物两部分,内容物回填实验发现,内容物在胶囊中结块将导致其溶出度低。结块的原因可能与诺氟沙星原料有较强的引湿性有关;按ChP2020附录明胶空心胶囊项下的方法,通过干燥失重,测定胶囊壳中的水分,发现加速试验前后,仅样品内容物中的水分增加而空胶囊壳中的水分基本不变。说明外界环境中的水分透过外部包材经过囊壳进入到胶囊剂内容物内部,导致了样品水分的增加。
加速稳定性实验显示,在40℃、75%RH条件下加速放置1个月和3个月后,再次测定样品的水分。诺氟沙星胶囊在较高温度和湿度条件下水分升高,溶出度下降。
片剂中的水分含量在5%以下,均值低于胶囊,可能与其生产过程中需要控制水分有关。过评企业的胶囊和片剂中的水分均控制在6%以下,其溶出曲线与参比制剂相似,溶出度按新建立的溶出度方法测定平均溶出量在85.2%~94.9%之间;未过评胶囊企业部分产品的水分超过10%,相对应的溶出曲线与参比制剂不相似,溶出度按新建立的溶出度方法测定结果在11.7%~75.2%之间,均低于拟定的80%这一限度值。采用PVC加套袋包装形式的企业,胶囊和片剂的水分明显低于未加套袋的产品。
3.2.6 原料晶型及粒度相关结果
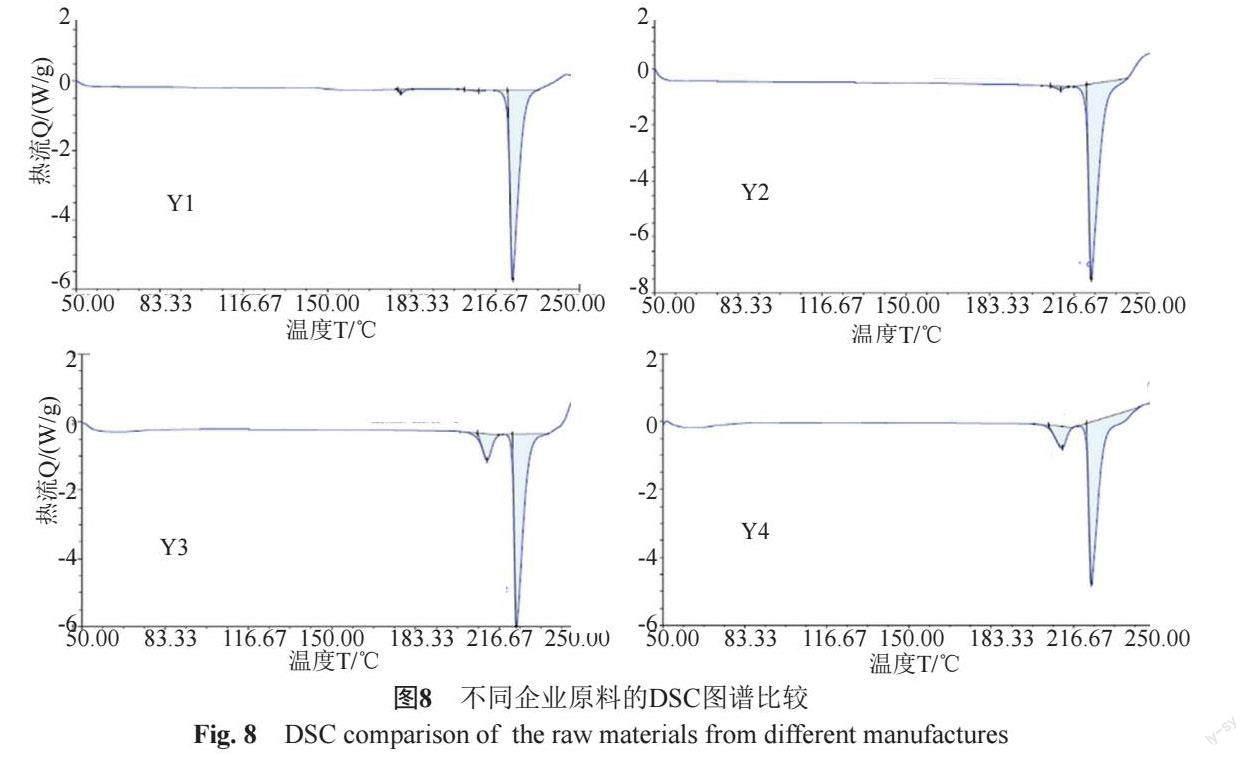
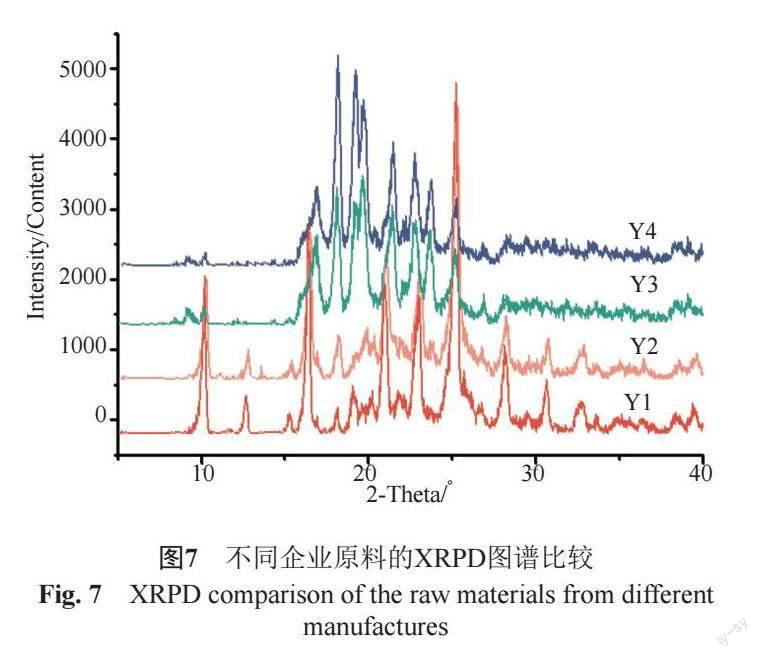
文献[14-15]报道诺氟沙星有A、B、C 3种常见晶型。C晶型为稳定晶型,A晶型为亚稳晶型,B晶型为不稳定晶型。XRPD测定4家原料企业的产品,结果显示:Y1产品基本为A晶型,Y2产品有A晶和C晶(图7),Y3和Y4产品的晶型与C晶型较为一致。DSC分析显示,Y1产品和Y2产品较为一致;Y3和Y4产品较为一致(图8)。已过一致性评价企业(P3)提供的原料Y1产品的低共熔杂质较小,纯度较高。
不同企业原料的粒度分布范围差别较大:Y1产品的d(0.9)范围区间最大,为160~1637 μm(图9a);胶囊和片剂过评企业均控制原料粒度d(0.9)在360 μm以内;P3提供的Y1原料藥粒径呈现均匀的正态分布,而Y3原料粒径分布不均匀,有双峰显现(图9b)。
原料的表观溶出速率曲线见图10。结果显示:A晶型原料在60 min内的溶出较快且溶出曲线平滑、连贯,可能与该晶型具引湿性有关;C晶型原料的溶出曲线存在浸润、突释的过程,可能与C晶型更稳定不易吸湿有关。
4 讨论
4.1 整体质量评价
按照拟定的方法检验,诺氟沙星片质量标准“一般”,质量状况“一般”;诺氟沙星胶囊质量标准“一般”,质量状况“较差”,片剂质量整体高于胶囊。
探索性研究显示,通过一致性评价企业的片/胶囊的质量整体优于未过评企业的产品,未过评企业的样品在溶出度、有关物质等方面均与原研参比制剂不一致,可能存在临床安全性和有效性风险。本次抽检数量显示,市售样品仍以未过评样品为主,建议片/胶囊生产企业尽快开展仿制药的评价工作,提高产品的质量。
4.2 产品关键质量属性的控制
诺氟沙星作为BCS Ⅳ类难溶性药物,可通过选择优势晶型或对原料进行微粉化来提高药物的溶解速率,从而提高口服固体制剂的溶出速率。文献报道诺氟沙星有A、B、C 3种常见晶型,其中C晶型为稳定晶型,A晶型为亚稳晶型,B晶型为不稳定晶型。目前国内诺氟沙星的原料主要来源于四家原料生产企业,而本次抽检涉及的六成以上制剂企业使用的原料来自于Y1,探索研究显示该企业原料晶型主要为A晶型。由调研可知,过评企业的处方和工艺虽不同,但都采用诺氟沙星A晶型原料,并严格控制粒度d(0.9)小于360 μm,从而保证了过评产品与参比制剂具有相似的溶出曲线,提示原料的晶型是影响本品片/胶囊的溶出度关键质量属性。
诺氟沙星A晶型原料虽然是较理想的晶型,但该晶型具引湿性,在生产与贮存中易吸潮,进而影响其溶出特性。因此在进行仿制药一致性评价工作时,还应注重包装材料对制剂在贮存、运输过程中水分的影响进行考察。可选择使用双铝包装或增加复合膜套袋等包装方式避免水分增加导致产品的溶出下降。
4.3 现行质量标准有待提高
在本次国家药品抽验工作中,发现诺氟沙星片/胶囊产品中存在遗传毒性杂质(杂质2)。诺氟沙星对光不稳定,杂质2作为API的光降解产物,化学式中带有警示结构[16-17],目前未见关于该杂质的毒性试验数据报道。现行标准多将其作为未知杂质计算,应按照ICH M7的指导原则进行有效控制。此外,还发现部分未过评企业的溶出度限度偏低、未控制固体制剂水分等潜在风险。建议在ChP2020标准基础上应对诺氟沙星片/胶囊的质量标准进行修订提高,包括:①建立片/胶囊有关物质测定方法;②增订LC-MS/MS的遗传毒性杂质2检测方法,以毒理学关注阈值设置质控限度;③将片/胶囊的溶出度介质修订为pH6.8磷酸盐缓冲液,规定60 min溶出不低于80%;④增订片/胶囊的水分。
参 考 文 献
陈新谦, 金有豫, 汤光. 新编药物学[M]. 第15版. 北京: 人民卫生出版社, 2003: 105.
刘珊珊, 耿雅杰, 夏媛媛等. LC-MS/MS法定量测定人血浆中诺氟沙星浓度的分析方法研究及其应用[J]. 药学学报, 2019, 54(4): 695-700.
李俊, 杨玉琴, 王英瑛. 诺氟沙星胶囊的质量分析与研究[J]. 中国抗生素杂志, 2019, 44(5): 563-567.
British Pharmacopeia Convention.The British Pharmacopeial [S]. BP2021, (Ⅱ): 435-437.
国家食品药品监督管理总局. 国家食品药品监督管理局标准[S]. YBH07902019.
吴莲琴, 范师振. 原研诺氟沙星片与自研诺氟沙星片溶出曲线对比[J]. 中外医学研究, 2019, 17(13): 168-170.
国家药典委员会.《中国药典》2020年版四部[S]. 中国医药科技出版社, 2020, 145-147.
慈天元. 诺氟沙星合成工艺的综述 [J].青岛医药卫生, 2009, 41(3): 219-223.
李灵芝. 诺氟沙星的合成工艺研究[J]. 山西化工, 2004, 24(1): 64-65.
胡国强, 董秀丽. 诺氟沙星合成方法的改进 [J]. 化学试剂, 2007, 29(9): 575-576.
乐夏云. 诺氟沙星的合成工艺[J]. 當代化工研究, 2018: 129-130.
刘海姣, 廖音娟, 唐智. UPLC-MS/MS 测定人血浆中诺氟沙星的含量及其应用[J]. 中南药学, 2021, 19(9): 1859-1864.
胡昌勤. 生理药动学模型在固体口服制剂一致性评价中的应用[J]. 中国抗生素杂志, 2021, 46(3): 177-186.
邢逞, 吕扬. 抗菌药诺氟沙星多晶型研[C]. 第四届全国晶型药物研发技术学术研讨会.
Barbas R, Prohens R, Puigjaner C. A new polymorph of norfloxacin[J]. J Therm Anal Calorim, 2007, 89( 3): 687-692.
Xiao C, Han Y, Liu Y, et al. Relationship between fluoroquinolone structure and neurotoxicity revealed by zebrafish neurobehavior[J]. Chem Res Toxicol, 2018, 31: 238-250.
Han Y, Ma Y, Yao S, et al. In vivo and in silico evaluations of survival and cardiac developmental toxicity of quinolone antibiotics in zebrafish embryos (Danio rerio)[J]. EnvironmPollut, 2021, 277: 116779.
