电针预处理对脓毒症急性肺损伤大鼠肺组织中NEK7-NLRP3炎症小体激活的影响
2023-06-10张玉洁徐淑文刘文美张新芳项水英江传玮王媛刘自兵
张玉洁,徐淑文,刘文美,张新芳,项水英,江传玮,王媛,刘自兵,
(1.安徽中医药大学研究生院,安徽 合肥 230038;2.安徽中医药大学中西医结合学院,安徽 合肥 230038;3.安徽中医药大学针灸推拿学院,安徽 合肥 230038)
急性肺损伤(Acute lung injury,ALI)是以肺部弥漫性炎症发作及肺泡上皮-毛细血管内皮屏障破坏为特征的临床综合征[1],可最终进展为急性呼吸窘迫综合征(Acute respiratory disease syndrome,ARDS)[2]。临床中常表现为肺水肿、低氧血症以及需要机械通气的呼吸窘迫急性发作。ALI是常见的呼吸系统危重疾病,发病迅速、死亡率高[3]。现代研究表明[4-5],针刺可以抑制TNF-α、IL-6的表达,减轻ALI肺水肿及肺部病理损伤。ALI发病机制复杂,主要包括肺内大量炎性细胞浸润及炎性介质释放。研究发现[6]核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor family pyrin domain-containing protein 3,NLRP3)炎症小体的激活参与了ALI的发病过程。NLRP3炎症小体是一种多蛋白复合体,可在多种病原微生物和危险信号刺激下活化,导致促炎因子IL-1β和IL-18的成熟和分泌,加重ALI炎症反应[7-8]。NIMA相关激酶7(NIMA-related kinase 7,NEK7)是NEK家族的成员之一,广泛表达于心、脾、肾、肺等多种组织[9]。NEK7能够与NLRP3结合,介导NLRP3炎症小体的激活[10]。本研究利用脂多糖(Lipopolysaccharide,LPS)制备脓毒症ALI大鼠模型,观察电针预处理“足三里”“尺泽”穴对脓毒症ALI大鼠肺组织中NEK7-NLRP3炎症小体激活的影响,探讨电针预处理对ALI大鼠发挥的肺保护作用及其可能机制。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠40只,体质量300~350 g,由济南朋悦实验动物繁育有限公司提供,清洁级,许可证号:SCXK(鲁)2019-0003。大鼠分笼饲养,自由进食,饮水。适应性饲养2周后,随机分为对照组、电针预处理+对照组、模型组、电针预处理+模型组,每组10只。研究经安徽中医药大学动物实验伦理委员会批准,批件编号:AHUM-rats-2020009。实验过程中对大鼠的所有操作均符合中国科学技术部颁布的《关于善待实验动物的指导性意见》。
1.2 主要试剂及仪器
戊巴比妥钠(美国Sigma公司,P3761),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,P0010),IL-1β、IL-18 ELISA试剂盒(武汉基因美科技有限公司,JYM0419Ra、JYM0650Ra),Caspase-1抗体、NEK7抗体、ASC抗体(北京博奥森生物技术有限公司,AG03071020、AD19562205、AF03162934),NLRP3抗体(英国Abcam公司,批号:GR3369573-3),IL-1β抗体(美国Cell Signaling Technology公司),β-actin单抗、山羊抗小鼠IgG、山羊抗兔IgG(北京中杉金桥生物技术有限公司,19C10509、140193、202700514),山羊抗兔IgG(FITC)(上海碧云天生物技术有限公司,07032210)。
小动物呼吸功能检测仪(北京贝兰博科技公司,Ani-Res2005),华佗牌针灸针(0.3 mm×25 mm,苏州医疗用品厂有限公司),华佗牌多功能电针治疗仪(苏州医疗用品厂有限公司,SDZ-V),光学显微镜(日本奥林巴斯公司,BX53),数字切片扫描仪(匈牙利3DHISTECH公司,Pannoramic 250Flash Ⅱ),酶标仪(美国雷杜公司,RT-6000),凝胶成像系统(北京科创锐新生物科技有限公司,K8160T)。
1.3 模型制备
脓毒症ALI大鼠模型的制备方法参照文献并结合本课题组之前造模方法进行改良[11-12]。模型组及电针预处理+模型组所有大鼠均向腹腔内注射LPS(5 mg·kg-1),对照组及电针预处理+对照组给予等体积生理盐水腹腔注射。
1.4 电针预处理方法
于模型制备前1周进行电针预处理。选择“足三里”穴及“尺泽”穴,穴位定位参照《实验针灸学》[13]:“足三里”穴位于后肢膝关节后外侧,腓骨小头下方大约5 mm处;“尺泽”穴位于大鼠前肢肘横纹偏外凹陷处。大鼠固定于鼠板后,将0.3 mm×25 mm针灸针直刺入双侧“足三里”穴5 mm及“尺泽”穴3 mm,接入电针仪,正极接“尺泽”穴,负极接同侧“足三里”穴,波形为疏密波,频率4 Hz/20 Hz,强度1~2 mA,以引起大鼠四肢轻微颤动为准,每次30 min,每日1次,连续治疗7 d。电针预处理+对照组大鼠以相同方法进行电针,对照组及模型组大鼠每日以相同方法固定,但不进行其他干预。
1.5 检测指标及方法
肺通气功能检测:造模24 h后,使用2%戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉大鼠,行气管插管,将大鼠置于体描箱中,连接导管、呼吸机和呼吸信号调理器,使用Ani-Res2005小动物肺功能分析系统,测量大鼠用力肺活量(Forced vital capacity,FVC)、第0.1秒用力呼气量(Forced expiratory volume at 0.1 second,FEV0.1)及第0.3秒用力呼气量(FEV0.3)、FEV0.1/FVC、FEV0.3/FVC。
HE染色法观察大鼠肺组织病理变化:腹主动脉取血处死大鼠后,开胸分离大鼠右肺上叶,置4%多聚甲醛中48 h,常规脱水,包埋,切片厚度5 μm,脱蜡脱水,苏木精-伊红(HE)染色,中性树胶封片,于显微镜下观察肺组织病理学变化。
肺组织湿/干质量比(W/D)测定:取大鼠左肺,用滤纸吸取肺表面水分后称湿质量(W),放置于60 ℃恒温干燥箱中干燥48 h,测量干质量(D),计算W/D比值。
免疫荧光法观察大鼠肺组织中ASC蛋白表达:对右肺上叶蜡块切片,高压抗原修复,PBS-T冲洗3次,滴加ASC一抗(1∶200),37 ℃培养箱孵育60 min,PBS-T冲洗3次,滴加免疫荧光二抗(1∶400),37 ℃孵育30 min,PBS-T冲洗3次;用含DAPI的抗荧光淬灭封片剂封片,数字切片扫描仪扫描荧光切片,观察并分析采集图片中ASC蛋白阳性表达。
ELISA法检测大鼠血浆、右肺中叶组织IL-1β、IL-18含量:肺功能检测完毕后,使用真空干燥抗凝管取大鼠腹主动脉血5 mL,室温静置2 h,4 ℃、3 000 r·min-1离心15 min,取上层血浆待测。大鼠取血后开胸,取右肺中叶,冲洗干净后,于冰上将取下的肺组织剪碎匀浆并离心,后取上清液,置于-80 ℃冰箱待测。按照ELISA试剂盒说明书提示检测IL-1β、IL-18的含量。
Western blot法检测大鼠肺组织内NEK7、NLRP3、Caspase-1、IL-1β蛋白的表达:取大鼠右肺下叶组织0.1 g,加入600 μL RIPA细胞裂解液进行裂解,提取总蛋白。使用BCA法检测蛋白浓度,分装储存于-80 ℃冰箱备用。取50 μg蛋白总量进行上样,然后电泳、转膜、封闭。参照一抗说明书进行稀释,NEK7(1∶1 000)、NLRP3(1∶1 000)、Caspase-1(1∶500)、IL-1β(1∶1 000),4 ℃孵育过夜,加入二抗(1∶20 000)室温孵育2 h,用ECL发光试剂盒来检测蛋白,β-actin作为内参,以目的蛋白和内参的灰度值之比表示目的蛋白的相对表达量。
1.6 统计学分析

2 结果
2.1 各组大鼠肺功能比较
与对照组比较,电针预处理+对照组无统计学差异(P>0.05),模型组大鼠FVC、FEV0.1、FEV0.3、FEV0.1/FVC、FEV0.3/FVC均显著降低(P<0.001);与模型组比较,电针预处理+模型组大鼠FVC、FEV0.1、FEV0.3、FEV0.1/FVC、FEV0.3/FVC均显著升高(P<0.05,P<0.001)。见图1。

注:与对照组比较,***P<0.001;与模型组比较,图1 各组大鼠肺功能比较Fig.1 Comparison of lung function of the rats in each group
2.2 各组大鼠肺组织形态学比较
对照组、电针预处理+对照组大鼠肺泡结构完整,肺间隔连续、自然,未见肺组织有明显的炎症细胞浸润及充血;模型组大鼠肺泡结构紊乱,肺间隔增厚,肺组织内炎性浸润明显,且渗出大量红细胞;电针预处理+模型组大鼠肺间隔变薄,炎症细胞浸润减少,红细胞渗出不明显。见图2。

注:黑色箭头指示为大量炎性细胞浸润;绿色箭头指示为红细胞渗出图2 各组大鼠肺组织形态学比较(HE染色,×200)Fig.2 Comparison of lung histomorphology of rats in each group (HE staining,×200)
2.3 各组大鼠肺组织W/D值比较
与对照组相比,电针预处理+对照组大鼠肺组织W/D值增高,但差异无统计学意义(P>0.05),模型组大鼠肺组织W/D值明显增高(P<0.001);与模型组比较,电针预处理+模型组W/D值显著降低(P<0.01)。见图3。

注:与对照组比较,***P<0.001;与模型组比较,图3 各组大鼠肺组织W/D值比较Fig.3 Comparison of wet/dry weight ratio of lung tissue of rats in each group
2.4 各组大鼠血浆及肺组织中IL-1β、IL-18含量的比较
与对照组相比,电针预处理+对照组大鼠血浆及肺组织中IL-1β、IL-18含量差异无统计学意义(P>0.05),模型组大鼠血浆及肺组织中IL-1β、IL-18含量明显升高(P<0.001);与模型组比较,电针预处理+模型组大鼠血浆及肺组织中IL-1β、IL-18含量显著降低(P<0.01,P<0.001)。见图4。
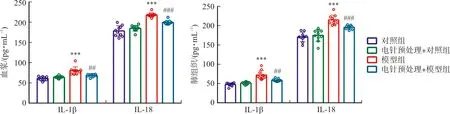
注:与对照组比较,***P<0.001;与模型组比较,图4 各组大鼠血浆及肺组织中IL-1β、IL-18含量比较Fig.4 Comparison of IL-1β and IL-18 in plasma and lung tissue of rats in each group
2.5 各组大鼠肺组织中ASC蛋白阳性表达比较
对照组、电针预处理+对照组大鼠肺组织中存在少量ASC蛋白,差异无统计学意义(P>0.05);模型组大鼠肺组织中观察到ASC蛋白阳性表达明显增多(P<0.001);电针预处理+模型组大鼠肺组织中ASC蛋白阳性表达显著降低(P<0.001)。见图5。

注:细胞核呈蓝色,ASC蛋白阳性表达呈绿色。与对照组比较,***P<0.001;与模型组比较,图5 各组大鼠肺组织中ASC蛋白阳性表达比较(免疫荧光,×400)Fig.5 Comparison of the positive expression of ASC protein in lung tissue of rats in each group (IF staining,×400)
2.6 各组大鼠肺组织内NEK7、NLRP3、Caspase-1、IL-1β蛋白相对表达量的比较
与对照组比较,电针预处理+对照组大鼠肺组织内NEK7、NLRP3、Caspase-1、IL-1β蛋白表达量差异无统计学意义(P>0.05),模型组大鼠肺组织内NEK7、NLRP3、Caspase-1、IL-1β蛋白表达量显著升高(P<0.001);与模型组比较,电针预处理+模型组大鼠肺组织内NEK7、NLRP3、Caspase-1、IL-1β蛋白表达量显著降低(P<0.05,P<0.01,P<0.001)。见图6。

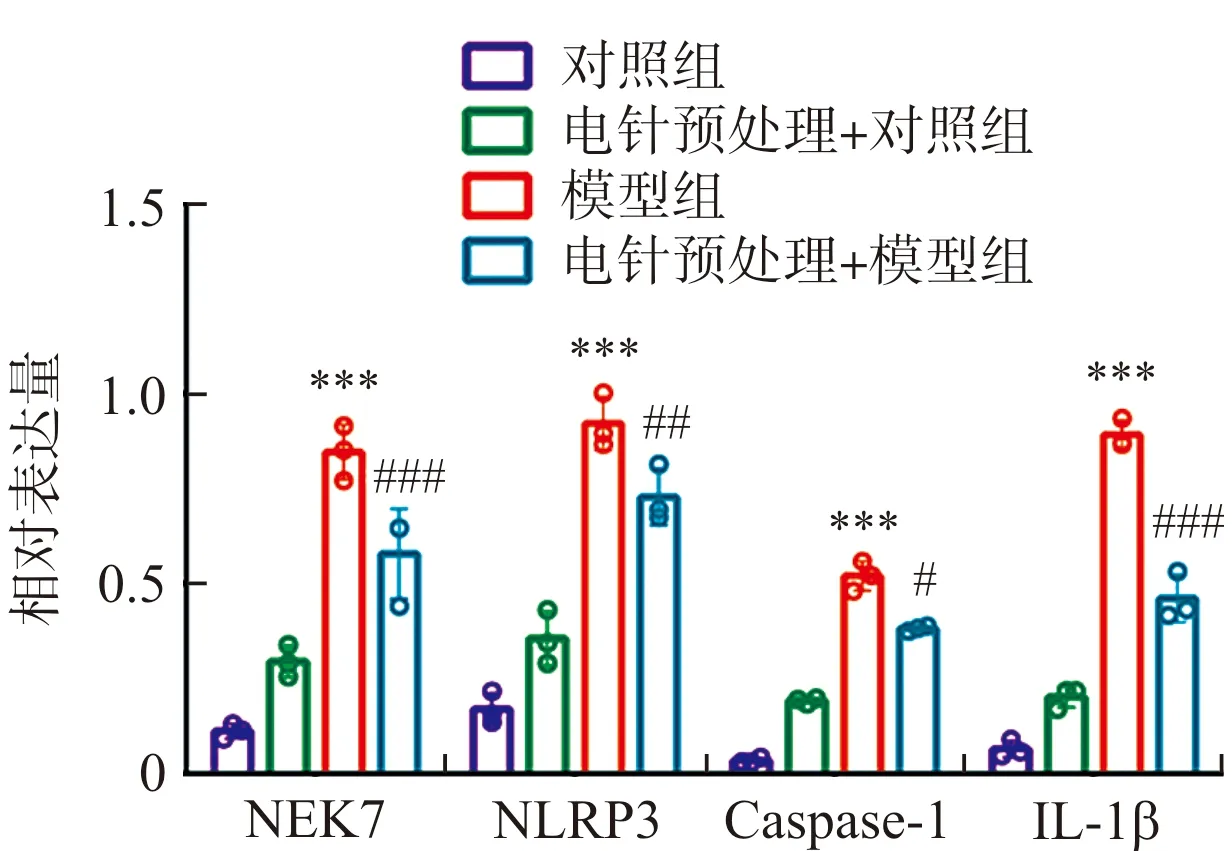
注:与对照组比较,***P<0.001;与模型组比较,图6 各组大鼠肺组织中NEK7、NLRP3、Caspase-1与IL-1β蛋白相对表达量比较Fig.6 Comparison of the relative expression levels of NEK7, NLRP3, Caspase-1 and IL-1β in lung tissues of rats in each group
3 讨论
ALI在中医学中属“暴喘”“喘脱”“结胸”等范畴,其病机复杂,多为淫邪侵袭肺系,痰浊内蕴,肺气上逆,表现为呼吸急促,进而出现喘息无力[14]。针刺具有便捷、有效、安全等特点,有研究[15]表明预电针可以改善ALI模型的肺通气功能,抑制促炎因子IL-1β、TNF-α及增加抑炎因子IL-10的释放,发挥肺保护作用。“足三里”穴是足阳明胃经穴,也是常用的保健要穴,具有固本培元,调补气血的功效;“尺泽”穴为肺经之合穴,常用于治疗肺系病症。马秋富等[16]研究显示,高强度电针预处理“足三里”穴在内毒素血症中可以激活迷走-脾反射通路引起抗炎效应;低强度电针“足三里”穴可以通过迷走-肾上腺轴发挥抗炎作用。Zhang等[17]研究发现,电针“足三里”穴能显著减少ARDS小鼠肺组织的病理变化,减少肺泡内蛋白液的渗出,提高小鼠存活率。课题组前期研究显示[18],电针“足三里”穴和“尺泽”穴可以抑制脓毒症ALI模型大鼠肺泡巨噬细胞向M1表型极化,减少炎症因子的释放。ALI可由多种因素引起,脓毒症是ALI常见的诱因[19]。肺部过度的炎症反应引发肺泡-毛细血管通透性增加导致弥漫性肺泡损伤,其中肺水肿是ALI的关键病理特征之一。本实验中经LPS诱导的大鼠表现为呼吸急促,HE染色显示肺泡结构紊乱,肺组织炎性浸润明显,充血水肿,且W/D比值升高,炎症因子分泌增多,提示脓毒症ALI模型复制成功。而电针预处理可以改善大鼠肺功能,减轻肺组织炎性病理反应,表明电针预处理可在脓毒症ALI中发挥肺保护效应。
IL-1β具有强致炎作用,启动炎症反应并引起炎症级联效应,可诱导IFN-γ的产生,增加一氧化氮和趋化因子的合成等促进炎症反应[20]。在ALI模型小鼠中IL-18含量明显增加[21]。本研究中,模型组大鼠血清及肺组织中IL-1β、IL-18含量明显升高,电针预处理后IL-1β、IL-18含量均降低,提示电针可以抑制促炎因子的释放,减轻脓毒症ALI大鼠的炎性反应。
IL-1β、IL-18的分泌与炎症细胞中NLRP3炎症小体的激活直接相关[22]。NLRP3炎症小体是一种多蛋白复合体,可在多种免疫细胞中表达[23]。NLRP3炎症小体由三部分组成:以NLRP3作为受体蛋白、凋亡相关斑点样蛋白(Apoptosis associated speck like protein containing,ASC)作为接头蛋白和半胱天冬蛋白酶的前体Pro-Caspase-1为效应蛋白[24]。NLRP3在被LPS、ATP、尿酸结晶、尼日尼亚菌素等刺激后,募集ASC,ASC寡聚化形成ASC斑点进一步组装炎症小体;最后,ASC与Pro-Caspase-1结合激活NLRP3炎症小体[25]。NLRP3炎症小体活化后介导Caspase-1活化,剪切细胞质中的前白细胞介素-1β(Pro-IL-1β)和Pro-IL-18,形成成熟的IL-1β和IL-18并释放至细胞外参与炎症反应[26]。在ALI小鼠模型中,通过抑制NLRP3炎症小体的激活,减轻了肺损伤及炎症细胞的浸润[27-28]。NEK7是一种多功能激酶,影响中心体复制、线粒体调节、DNA修复和有丝分裂纺锤体组装等[29]。NEK7是NLRP3炎症小体激活的关键蛋白,其与NLRP3中的亮氨酸重复序列域及核苷酸寡聚化结构域结合,介导NLRP3炎症小体的寡聚化和激活,促进ASC斑点形成和钾离子外流下游Caspase-1的激活[30-31]。有研究发现[32],采用NEK7 siRNA沉默NEK7后,显著抑制了Caspase-1、IL-1β蛋白的表达和ASC斑点形成,影响NLRP3炎症小体激活。另有研究[33]显示,格列本脲通过干扰NEK7/NLRP3结合,抑制NLRP3炎症小体激活及IL-1β的表达。在本实验中,模型组大鼠肺组织中ASC蛋白阳性表达增加,NEK7、NLRP3、Caspase-1、IL-1β蛋白的表达明显增加,经电针预处理后,大鼠肺组织中ASC蛋白阳性表达减少,NEK7、NLRP3、Caspase-1及IL-1β蛋白的表达显著降低,提示电针预处理可能通过抑制NEK7-NLRP3炎症小体的激活,减轻脓毒症ALI的肺损伤。
综上所述,电针预处理可以减轻脓毒症ALI模型大鼠肺部的病理损伤,减轻肺水肿,改善肺功能以及减少肺部的炎症因子分泌和ASC蛋白阳性表达,其机制与抑制肺组织中NEK7-NLRP3炎症小体的激活相关。但电针预处理抑制NEK7-NLRP3炎症小体的上游机制尚需进一步研究。
