芒果炭疽病拮抗菌L18-7菌株的筛选、鉴定及拮抗机制研究
2023-06-10蒋攀婷伍玉玲何昊哲蒙姣荣方中斌李界秋
蒋攀婷,伍玉玲,何昊哲,蒙姣荣,罗 慧,方中斌,李界秋
(1.广西大学农学院,南宁 530004;2.广西大学农牧产业发展研究院,南宁 530004)
【研究意义】芒果炭疽病是芒果的主要病害之一,在各芒果产区均普遍发生,造成严重经济损失,是制约芒果产业持续健康发展的重要因素[1-2]。防控果树病害的主要措施有种植抗病品种、农业防治、物理防治、化学防治和生物防治等[3],其中,化学防治会引发环境污染、农药残留和病原菌抗耐药性增强等问题,而生物防治具有安全、有效、成本低及防效稳定等特点,在当前推行的植物病害绿色防控中占据重要地位。芽胞杆菌(Bacillusspp.)在自然界广泛分布,是土壤和植物微生态环境中的优势种群,具有较高的防病促生功能和较强的抗逆能力,且抑菌谱广、繁殖快、生产成本低、安全性高和种类繁多,已广泛应用于多种作物病害的生物防治[4-5]。已有研究证实,枯草芽胞杆菌(B.subtilis)、暹罗芽孢杆菌(B.siamensis)和贝莱斯芽胞杆菌(B.velezensis)等多种芽胞杆菌对芒果炭疽病均具有较好的防治效果[6-10]。但在已有的研究中均以胶胞炭疽菌(Colletotrichumgloeosporioides)作为室内筛选芒果炭疽病生防菌的靶标测试菌[10-14],针对优势种亚洲炭疽菌进行拮抗菌筛选和鉴定的研究鲜见报道。因此,筛选芒果亚洲炭疽病菌拮抗菌菌株,对芒果炭疽病的生物防治具有重要意义。【前人研究进展】芒果炭疽病由多种炭疽菌(Colletotrichumspp.)侵染引起,在早前的研究中,基于形态学或结合ITS序列分析通常将芒果炭疽病的病原菌鉴定为胶胞炭疽菌[1]。潘朝勃等[10]筛选出对芒果炭疽菌菌丝生长具有明显抑制作用的9A、26A和4N菌株,其抑制率分别达88.83%、87.83%和85.87%;以其发酵菌液喷雾离体果实,24 h后再接种新鲜的炭疽菌分生孢子液,结果显示对芒果炭疽病的防治效果均达100.00%。韦丹丹等[12]分离的解淀粉芽孢杆菌(B.amyloliquefaciens)HAB-2菌株提取物可引起芒果炭疽病菌菌丝畸形和扭曲,可较好地抑制芒果炭疽病菌生长,处理后的芒果未出现炭疽病病状。赵超等[13]以筛选得到的2株拮抗菌A1和C13的10倍稀释菌液处理芒果,对采后炭疽病和蒂腐病的平均防效分别达74.18%和62.99%。上述关于芒果炭疽菌拮抗细菌筛选鉴定、活性成分分析和生防试验的研究均是使用胶孢炭疽菌作为靶标菌。Mo等[15]、Li等[16]研究报道,在我国主要芒果产区,芒果炭疽病菌主要有亚洲炭疽菌(C.asianum)、果生炭疽菌(C.fructicola)和暹罗炭疽菌(C.siamense)3个种,其中以亚洲炭疽菌最重要;覃丽萍等[2]从广西百色市、南宁市和钦州市等芒果产地采集分离获得50株芒果炭疽病菌菌株,其中36株为亚洲炭疽菌、12株为果生炭疽菌、2株为暹罗炭疽菌,也说明亚洲炭疽菌为优势种。【本研究切入点】目前,芒果炭疽病在生产上危害严重,但针对其优势种亚洲炭疽菌进行生防菌的研究少,缺乏生防菌种资源。【拟解决的关键问题】以芒果炭疽病菌优势种亚洲炭疽菌为靶标,以37株芽胞杆菌进行对峙培养和离体接种防效试验,筛选芒果亚洲炭疽病菌的候选生防菌株,并对具有较好防治效果的菌株L18-7进行鉴定和拮抗机制分析,以期为芒果炭疽病的生物防治提供菌种资源,为研制生物防治制剂提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 芒果炭疽病菌和芽胞杆菌菌株 在广西南宁市良庆区那陈镇那徐村芒果‘桂七’品种植株上采集典型炭疽病病叶,进行分离、纯化和致病性测定,经形态学和分子生物学鉴定为芒果亚洲炭疽菌,菌株编号CLQ-1。37株芽胞杆菌菌株为广西大学植物病理学研究室前期研究从20种作物根际土壤中分离、纯化获得。
1.1.2 培养基和主要试剂 培养基:枯草芽胞杆菌常用培养基(葡萄糖20.00 g/L,蛋白胨15.00 g/L,NaCl 5.00 g/L,牛肉膏0.50 g/L,pH 7.0)、Landy培养基(L-谷氨酸5.00 g/L,酵母浸膏1.00 g/L,L-苯丙氨酸2.00 mg/L,葡萄糖20.00 g/L,KH2PO41.00 g/L,KCl 0.50 g/L,MgSO4·7H2O 0.50 g/L,FeSO4·7H2O 0.15 g/L,CuSO4·5H2O 0.16 mg/L,MnSO45.00 mg/L,pH 7.0)、马铃薯葡萄糖琼脂(PDA)培养基、LB(Luria-Bertani)培养基、牛肉膏蛋白胨(NA)培养基、营养肉汤(NB)培养基、酵母蛋白胨(YEP)培养基及其培养液均按照常规方法配制。检测胞外酶活性和溶磷能力的培养基参考Khamna等[17]、王芳等[18]的方法进行配制。
主要试剂:25%吡唑醚菌酯悬浮剂(山东康乔生物科技有限公司)、2×RapidTaqMaster Mix(南京诺唯赞生物科技公司)和DNA纯化试剂盒(广州美基生物科技有限公司)。
1.2 试验方法
1.2.1 芽胞杆菌对病原菌菌丝生长抑制效果测定 采用平板对峙法对芒果炭疽病菌进行拮抗菌初筛和复筛。在芒果炭疽病菌菌落边缘用打孔器打取直径0.6 cm菌饼,接种于PDA平板培养基中央,在距菌饼3.0 cm的2个对称位置上接种拮抗菌,以不接种拮抗菌为空白对照,每个处理3个重复。接种后置于28 ℃培养箱中培养,待对照菌落长满平板时,采用十字交叉法测量病原菌菌落直径,计算菌丝生长抑制率。
菌丝生长抑制率(%)= [(对照菌落扩展半径-处理菌落扩展半径)/对照菌落扩展半径]×100
1.2.2 芽胞杆菌离体叶片防治效果测定 分别取50.00 μL活化后的芽胞杆菌菌液接种到含10.00 mL NB液体培养基的50.00 mL离心管中,28 ℃条件下200 r/min振荡培养48 h。采摘无病芒果新梢叶片,用75%酒精进行表面消毒,用无菌梅花针刺伤叶片组织,再用相应拮抗菌液(1×108CFU/mL)喷雾,晾干后在伤口处接种直径0.6 cm的芒果炭疽病菌菌饼;接种病菌后第2次喷雾相应的拮抗菌液(1×108CFU/mL),晾干后置于28 ℃、湿度90%的保湿盒中。每张叶片接种3个点,每个处理接种3张叶片,以25%吡唑醚菌酯悬浮剂2000倍液为试验对照,以无菌水为空白对照。接种后10 d采用十字交叉法测量病斑直径。
防治效果(%)= [(无菌水对照病斑扩展面积-处理病斑扩展面积)/无菌水对照病斑扩展面积]×100
1.2.3 芽胞杆菌培养性状观察及革兰氏染色 将筛选获得具有较好拮抗效果的菌株划线培养于LA和NA平板培养基上,28 ℃培养48 h,观察、记录菌株的菌落大小、颜色、形状、湿润度和黏度等。参照《常见细菌系统鉴定手册》[20]中的常见细菌鉴定方法,对拮抗菌进行革兰氏染色,在显微镜下观察细菌菌体的形态特征和染色结果,并拍照记录。
1.2.4 拮抗菌分子鉴定 采用煮沸法提取拮抗菌的总DNA。挑取拮抗菌株单菌落至LB培养基中,28 ℃振荡培养16 h(200 r/min),离心收集菌体,加入300.00 μL ddH2O制成菌体浮液;将悬浮液放入-20 ℃冰箱中静置30 min后用沸水浴煮5 min,置于室温下12 000 r/min离心10 min,取上清即为总DNA溶液。 以拮抗菌总DNA为模板,分别以fD2(5′-AGAGTTTGATCATGGCTCAG-3′)/rP1(5′-ACGGTTACCTTGTTACGACTT-3′)和Hr-f(5′-AGGTCAA CTAGTTCAGTATGGAC-3′)/Hr-r(5′-AAGAACCATA ACCGGCAACTT-3′)为引物,对16S rRNA和rpoB基因进行PCR扩增。PCR反应体系25.0 μL:2×RapidTaqMaster Mix 12.5 μL,上、下游引物(10.0 mmol/L)各1.0 μL,DNA模板(50 ng/μL ) 1.0 μL,ddH2O 9.5 μL。扩增程序:95 ℃ 预变性5 min;94 ℃ 30 s,53.5 ℃ 30 s,72 ℃ 2 min,进行30个循环;72 ℃延伸5 min。PCR产物经1.0%琼脂糖凝胶电泳检测,对与预期大小一致的片段经DNA纯化试剂盒纯化后进行测序。测序结果在NCBI(www.ncbi.nlm.nih.gov/BLAST/)中进行BLAST比对,下载多种芽胞杆菌菌株rpoB序列,用MEGA 7.0邻接法(Neighbor-joining,NJ)和重复1000次的Bootstrap进行置信度检测,构建系统发育进化树。
1.2.5 拮抗菌胞外酶活性测定 参考王芳等[18]、李界秋等[20]的方法进行胞外酶(β-1,3-葡聚糖酶、蛋白酶和纤维素酶)活性测定。
1.2.6 无菌发酵液拮抗活性测定 以NA培养基、枯草芽胞杆菌常用培养基、LB培养基、YEP培养基和Landy培养基为测试培养基,参考宋文欣等[21]的方法进行拮抗物质活性测定。取新鲜活化的0.40 mL(OD600为0.8)菌液接种到10.00 mL待测培养基中,在28 ℃下200 r/min培养48 h,测定OD600;10 000 r/min离心10 min,吸收上清液,并用0.22 μm细菌过滤器过滤,获得无菌发酵液备用。制作双层PDA平板,下层培养基琼脂粉含量为20.00g/L,上层为16.00 g/L;待上层培养基完全凝固后,在距中心2.0 cm的4个对称位置打0.6 cm圆孔,取出上层培养基圆片;在培养基中央接种直径为0.6 cm的亚洲炭疽菌菌饼,将50.00 μL无菌发酵液加入双层培养基圆孔中,以不加无菌发酵液为空白对照,每个处理3个重复;28 ℃下培养,待对照组菌落长满培养皿时,采用十字交叉法测量菌落直径,计算抑制率。
1.2.7 产抗生素相关基因的分子检测 总DNA提取方法同1.2.4,以拮抗菌总DNA为模板,以表1所列引物进行PCR扩增,对mycB、ifuA、yndj、fenB和bacA5种抗生素产生相关基因进行检测[22],反应体系和扩增程序与1.2.4相同,具体退火温度如表1所示。

表1 用于检测抗生素产生相关基因的引物名称及序列Table 1 Names and sequences of primers used to detect genes related to antibiotic production
1.3 统计分析
试验数据采用Excel 2019进行整理,以SPSS 26.0进行统计分析。
2 结果与分析
2.1 37株芽胞杆菌对亚洲炭疽菌菌丝生长的抑制效果
将前期研究获得的37株芽胞杆菌菌株活化后与芒果炭疽病亚洲炭疽菌菌株CLQ-1进行平板对峙培养,结果显示有32株菌株对病原菌(亚洲炭疽菌)菌丝生长具有一定的抑制作用。进一步复筛结果(图1)显示,有10株菌株(L11-3、L11-6、L11-7、L16-1、L16-4、L17-3、L18-7、L19-3、M11-6和M12-5)对芒果炭疽菌菌丝生长抑制效果明显,菌丝抑制率均超过78.00%,其中M12-5、L18-7、L19-3、 L17-3和M11-6的抑制率分别达96.24%、94.94%、94.10%、91.25%和90.00%。
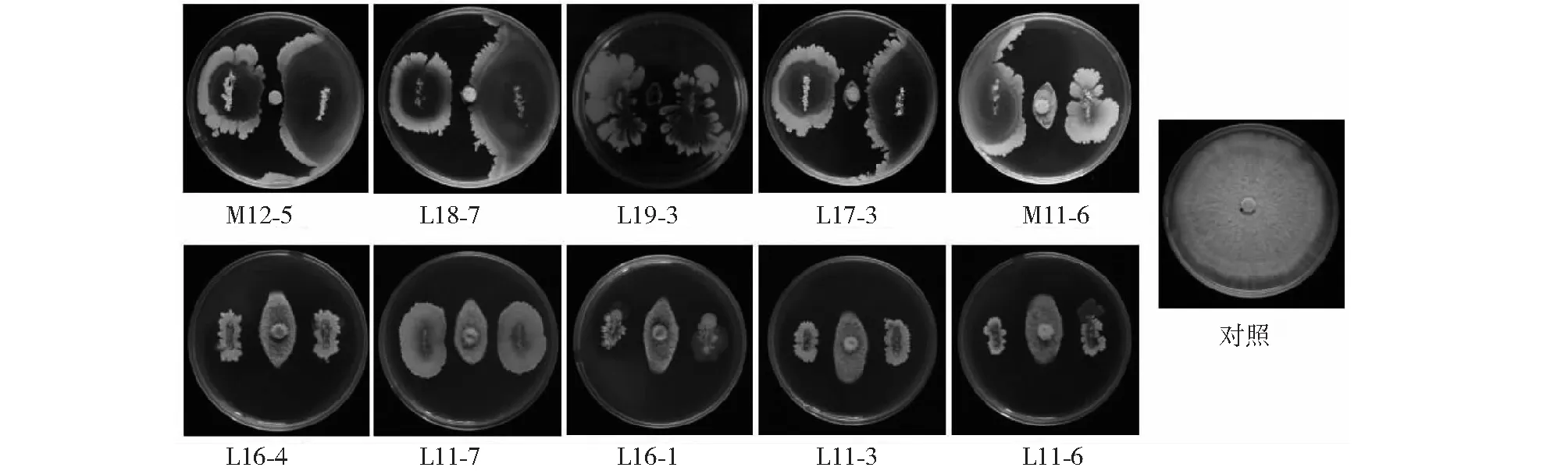
图1 10株芽胞杆菌菌株对亚洲炭疽菌菌丝生长的抑制效果Fig.1 Inhibitory effect of 10 Bacillus strains on the mycelial growth of C. asianum
2.2 拮抗菌的离体叶片防治效果
以菌株CLQ-1接种芒果叶片,对菌丝生长抑制效果明显的10株菌株进行离体叶片防效测定。从图2和表2可看出,菌株L18-7、L16-4和L19-3等8株拮抗菌的菌液对芒果炭疽病病斑扩展均具有一定抑制作用,防效为39.57%~83.00%,其中,菌株L18-7的防效最佳,平均为83.00%,其次是菌株L16-4,平均防效为79.16%,二者间差异不显著(P>0.05),但均显著高于其他菌株(P<0.05,下同);各菌株的防效均低于25%吡唑醚菌酯2000倍液的防效。说明菌株L18-7具有较强的菌丝抑制效果和最好的防治芒果炭疽病效果,可进一步选择该菌株进行分类学鉴定及拮抗机制研究。

A:无菌水;B:吡唑醚菌酯2000倍液;C:L18-7;D:L16-4;E:L19-3;F:L11-6;G:L16-1;H:M12-5;I:L17-3;J:M11-6;K:L11-7;L:L11-3。A:Sterile water;B:Pyrazolylostrel 2000 times liquid;C:L18-7;D:L16-4;E:L19-3;F:L11-6;G:L16-1;H:M12-5;I:L17-3;J:M11-6;K:L11-7;L:L11-3.图2 10株芽胞杆菌菌株对离体叶片病斑的抑制效果Fig.2 Inhibitory effect of 10 Bacillus strains on leaf plaques in vitro
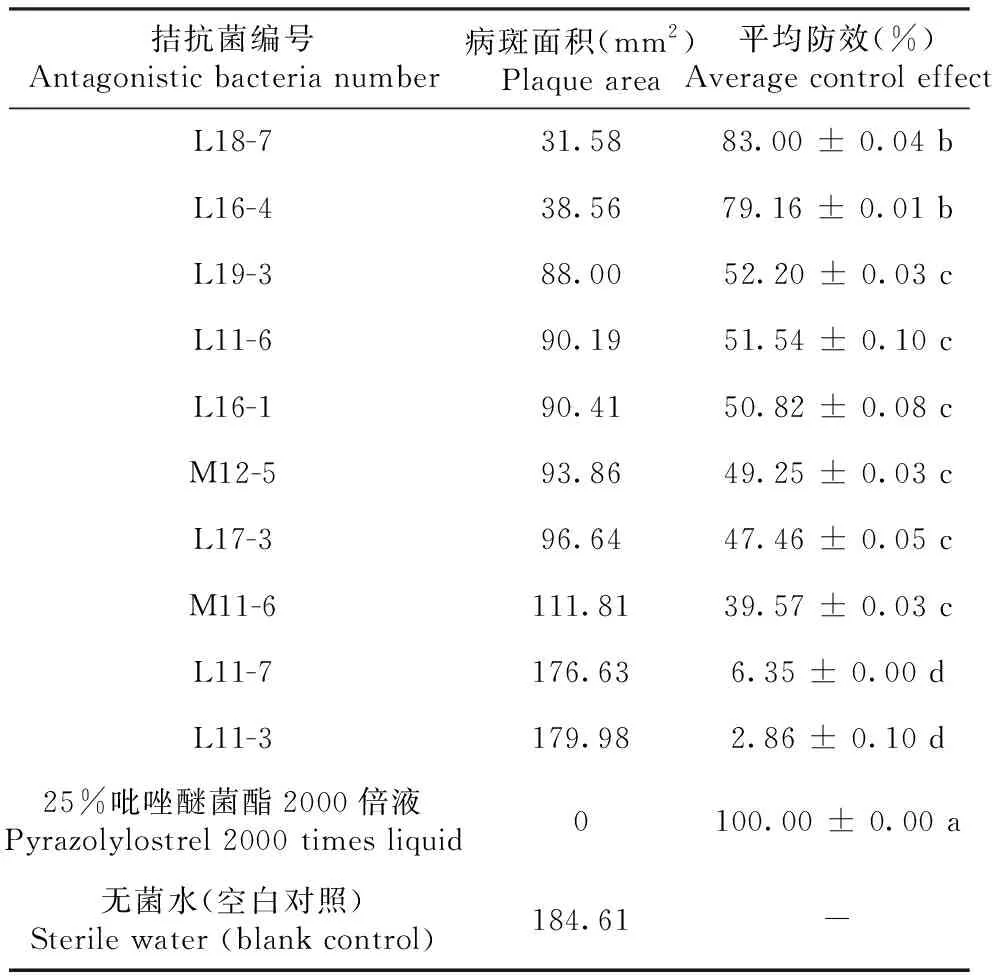
表2 10株芽胞杆菌菌株对离体叶片芒果炭疽病的防治效果Table 2 Control effect of 10 Bacillus strains on mango anthracnose in vitro
2.3 拮抗菌菌株L18-7的鉴定
2.3.1 菌株L18-7培养性状观察及革兰氏染色结果 从图3可知,菌株L18-7在LA培养基上生长快,菌落白色、较大、边缘不整齐、中间凹陷、边缘起皱、干燥、表面有褶皱,而在NA培养基上生长较慢,菌落乳白色、较小、隆起、边缘整齐、湿润、光滑、表面无褶皱;经革兰氏染色,大肠杆菌染为红色(G-),解淀粉芽胞杆菌染为紫红色(G+),菌株L18-7染为紫色(G+);菌体呈杆状,两端钝圆。说明菌株L18-7为革兰氏染色阳性。
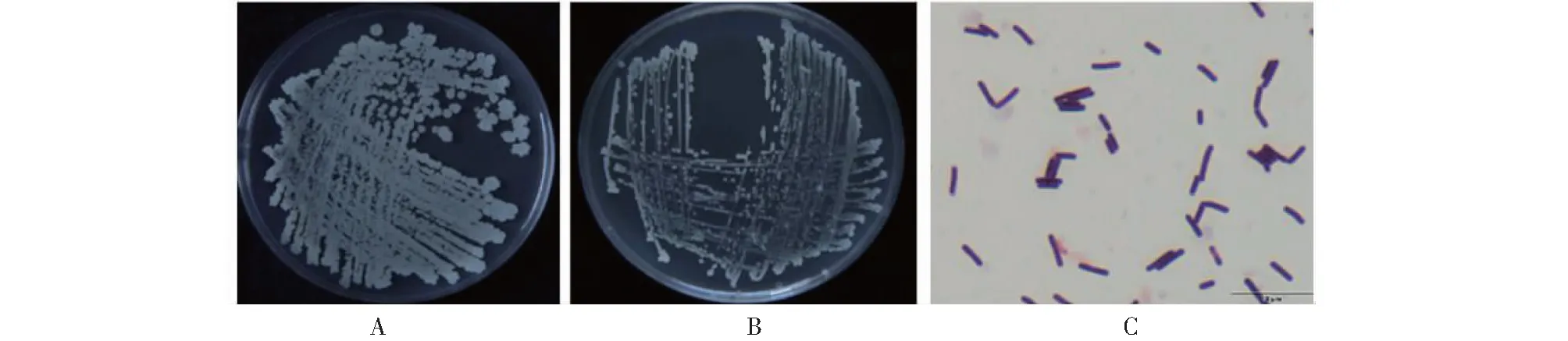
A:LA培养基;B:NA培养基;C:革兰氏染色。A:LA medium;B:NA medium;C:Gram stain.图3 菌株L18-7的培养性状和革兰氏染色Fig.3 Culture characteristics and gram staining of strain L18-7
2.3.2 菌株L18-7的分子鉴定 对筛选出的拮抗菌L18-7进行16S RNA和rpoB基因序列扩增,经测序分别得到约1440和580 bp序列(GenBank登录号分别为OP808198和OP794336)。将所得测序结果在NCBI中进行BLAST比对,经16S RNA和rpoB基因序列比对及构建rpoB的系统发育进化树(图4)分析,并结合形态学特征表现,将菌株L18-7鉴定为贝莱斯芽胞杆菌(B.velezensis)。

图4 基于rpoB基因序列构建的菌株L18-7系统发育进化树Fig.4 Phylogenetic tree constructed of strain L18-7 based on rpoB gene sequence
2.4 拮抗菌菌株L18-7的胞外酶活性
采用检测平板对菌株L18-7进行胞外酶活性测定,结果(图5)显示,菌株L18-7能在纤维素酶和蛋白酶检测培养基上产生透明圈,透明圈直径分别为(28.06±1.22)和(25.46±0.19)mm,说明该菌株能产生具有活性的胞外纤维素酶和蛋白酶;在β-1,3-葡聚糖酶检测培养基上不产生可见透明圈(结果不显示),说明菌株L18-7不产胞外β-1,3-葡聚糖酶。

A:纤维素酶;B:蛋白酶;C:葡聚糖酶。A:Cellulase;B:Protease;C:β-1,3-glucanase.图5 拮抗菌菌株L18-7的活性检测Fig.5 Activities of antagonistic strain L18-7
2.5 拮抗菌菌株L18-7抑菌物质活性及抗生素相关基因的检测
在28 ℃条件下,将菌株L18-7于5种培养基中培养48 h,经过滤除菌获得无菌发酵液,其拮抗活性测定结果(图6)显示,各处理的病原菌生长均受到抑制,而对照未受到影响。说明各培养基的发酵液均含有拮抗活性物质,菌株L18-7可产生抗生素类拮抗物质。

A:空白对照;B:NA培养基;C:枯草芽胞杆菌常用培养基;D:YEP培养基;E:LB培养基;F:Landy培养基。A:Blank control;B:NA medium;C:Bacillus subtilis commonly used medium;D:YEP medium;E:LB medium;F:Landy medium.图6 菌株L18-7无菌发酵液对亚洲炭疽菌菌丝生长的抑制效果Fig.6 Inhibitory effect of sterile fermentation broth of strain L18-7 on the mycelium of C. asianum
以菌株L18-7的总DNA为模板,用特异性引物分别对mycB、ituA、yndJ、fenB和bacA基因进行PCR扩增,并进行琼脂糖凝胶电泳检测(图7),所有引物均能扩增出单一特异性条带,条带大小与预期相符。说明菌株L18-7携带mycB、ituA、yndJ、fenB和bacA等产抗生素相关基因,推测该菌株可产生抗霉枯草菌素、伊枯草菌素、假定蛋白yndJ、丰原素和溶杆菌素。
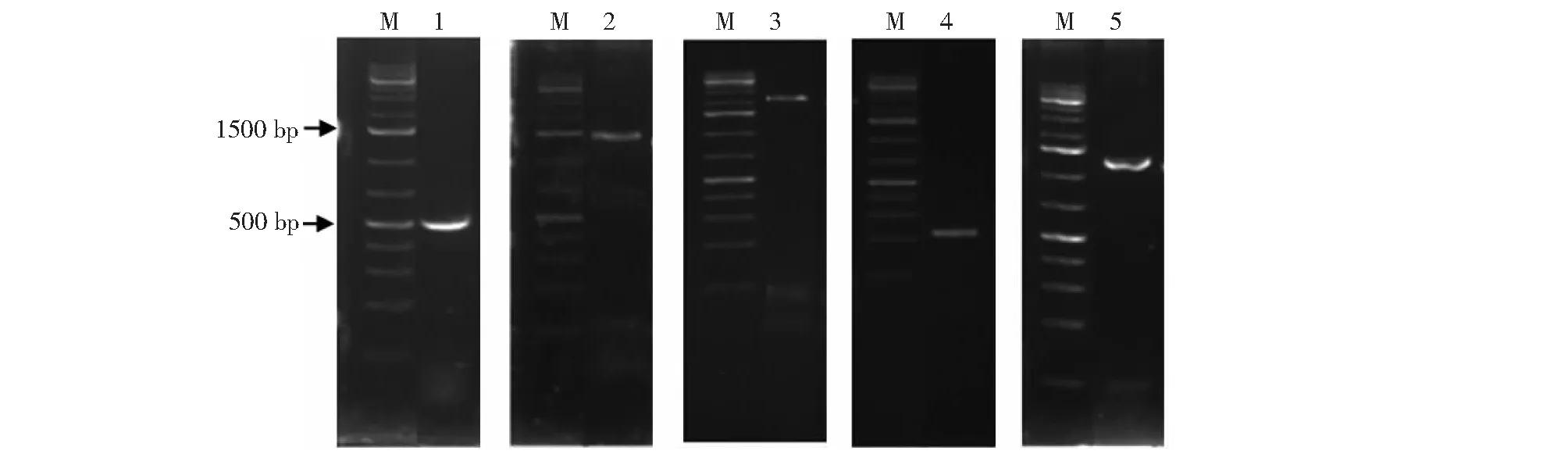
M:1 kb DNA Marker;1:bacA(498 bp);2:fenB(1400 bp);3:mycB(2024 bp);4:yndJ(212 bp);5:ituA(1150 bp)。图7 菌株L18-7抗生素合成基因的电泳检测Fig.7 Electrophoresis detection of antibiotic synthesis genes in strain L18-7
3 讨 论
芒果炭疽病在芒果生长期和采后贮藏期均可严重发生,极大影响芒果的产量和品质[1],其生物防治研究也一直受到关注。各国学者已先后从根际土壤、叶围或植物体内分离获得枯草芽胞杆菌、暹罗芽孢杆菌、贝莱斯芽胞杆菌、荧光假单胞菌(Pseudomonasfluorescens)、有孢圆酵母(Torulasporaspp.)和湖北拟酵母(Pseudozymahubeiensis)等对芒果炭疽病菌具有拮抗作用的不同类型(种类)拮抗菌[8,10,13,22]。本研究以芒果炭疽病菌优势种亚洲炭疽菌为靶标,筛选获得8株对芒果炭疽病具有明显防效的芽胞杆菌菌株,进一步丰富了该病生物防治的菌种资源。本研究仅通过平板对峙法和离体叶片接种法测定候选芽胞杆菌的拮抗作用和防效,菌株L18-7、L16-4和L19-3等的防效及其稳定性还需进一步进行田间试验验证。
贝莱斯芽胞杆菌可产生多种次级代谢产物,具有广谱抑菌活性和促生长作用,能发挥多重生防功效[23-25]。已有研究表明,贝莱斯芽胞杆菌主要通过分泌伊枯草菌素(Iturin)、丰原素(Fengycin)、溶杆菌素(Bacylisim)、抗霉枯草菌素(Mycosubtilin)和表面活性素(Surfactin)等脂肽类抗生素,以及蛋白酶、几丁质酶和β-葡聚糖酶等多种次级代谢产物,对病原菌产生抑菌作用[24-26]。本研究中,菌株L18-7为贝莱斯芽胞杆菌,能产生蛋白酶和纤维素酶,同时携带mycB、ituA、yndJ、fenB和bacA5种产抗生素相关基因,说明该菌株具有产生抗霉枯草菌素、伊枯草菌素、假定蛋白yndJ、丰原素和溶杆菌素等脂肽类抗生素的可能。不同贝莱斯芽胞杆菌菌株产生的拮抗物质种类、数量及其拮抗机制有所不同[27],贝莱斯芽胞杆菌GA1菌株产生的表面活性素、伊枯草菌素和丰原素混合喷雾可完全抑制稻瘟病菌(Pyriculariaoryzae)分生孢子萌发从而减轻叶部病斑大小,同时,伊枯草菌素和丰原素能抑制菌丝生长,而表面活性素对菌丝无抑制作用[28]。PW192菌株对胶孢炭疽菌和香蕉炭疽菌菌丝生长具有明显的抑制作用,其主要抑菌活性物质为丰原素[29];FZB42菌株产生的丰原素除抑制禾谷镰刀菌(Fusariumgraminearum)菌丝生长外,还可减少其毒素的产生,同时可抑制核盘菌菌核产生并诱导番茄产生系统抗性[30-31]。溶杆菌素D是HN-2菌株的主要抗菌物质之一,具有较高的抑制菌丝生长活性,主要通过对菌丝和孢子的细胞壁及细胞膜造成损伤,使细胞内的细胞质和细胞器渗出并形成空洞[32]。本研究中,菌株L18-7的无菌发酵液对亚洲炭疽菌的菌丝生长具有明显的抑制作用,但具体是哪类抗生素发挥了作用,或哪几种抗生素及抗菌蛋白发挥了协同作用,有待深入探究。
4 结 论
以芒果炭疽病优势病原菌亚洲炭疽菌为测试菌筛选获得8株对芒果炭疽病具有较好防效的菌株,其中,将防效最佳的菌株L18-7鉴定为贝莱斯芽胞杆菌,该菌株在28 ℃下以LB为培养基进行培养生长良好,能产生拮抗活性物质、胞外蛋白酶和纤维素酶,携带mycB、ituA、yndJ、fenB和bacA等产抗生素相关基因,可作为生防菌的种质资源加以利用。
