黔北麻羊CTSK、FN1基因生物信息学分析及其在性腺轴中的表达
2023-06-10赵佳福周明帅杨秀远
赵佳福,周明帅,徐 畅,杨秀远,陈 祥
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵阳 550025;2.贵州大学动物科学学院,贵阳 550025)
【研究意义】黔北麻羊作为贵州省三大优良地方山羊品种之一,具有生长发育快、体型大、性成熟早、肉质香嫩鲜美、无膻味和皮张品质好等特点,深受消费者的欢迎和喜爱[1]。研究发现,黔北麻羊繁殖力较强,产羔率可达196%,高于贵州白山羊(160%)和贵州黑山羊(152%)。繁殖率是肉羊养殖的重要经济性状[2],因此,研究黔北麻羊繁殖性状对提高其养殖经济效益具有重要作用。【前人研究进展】组织蛋白酶 K(Cathepsin K,CTSK)是一种溶酶体半胱氨酸蛋白酶,属于木瓜蛋白酶超家族成员,存在于溶酶体细胞内,是蛋白酶中一个细胞外基质降解酶[3],广泛存在于病毒、细菌、真菌、原生动物及原虫、植物、哺乳动物和人体中,通过氨基酸活性部位调节对应蛋白的催化活性。对绵羊的研究发现,在绵羊妊娠的40~120 d可在其子宫胎盘组织中检测到多种组织蛋白酶mRNA的表达,CTSK蛋白在妊娠后期主要分布于子宫内膜腺间和胎盘间,表明在绵羊子宫胎盘组织中CTSK蛋白可能参与绵羊子宫内膜重塑以及胎盘的形成[4]。纤连蛋白(Fibronectin,FN)是一种分子量为440 kDa的高分子量细胞外基质糖蛋白,是纤维连接蛋白家族的一个成员,其分子结构中含有多种结构域,可选择性地与细胞外基质中多种大分子如胶原、肝素、纤维蛋白及细胞表面受体结合,在细胞黏附、迁移、生长、分化及基质重塑等多种细胞过程中起至关重要作用[5],FN1在肿瘤、动脉粥样硬化、关节炎等疾病中发挥着多种生物学功能[6]。【本研究切入点】围绕前期转录组学检测结果,以单羔黔北麻羊卵巢中差异表达的CTSK和FN1基因为切入点,研究CTSK、FN1基因在黔北麻羊单羔、多羔性腺轴中的表达规律,解析CTSK和FN1基因与黔北麻羊繁殖之间的表达调控关系。【拟解决的关键问题】阐明CTSK、FN1基因不同表达模式与黔北麻羊繁殖率之间的相互作用关系,为黔北麻羊多胎品系的选育寻找潜在的关键候选基因和分子标记物。
1 材料与方法
1.1 试验动物、试剂及主要仪器
1.1.1 试验动物 黔北麻羊(Qianbei Ma goat)由贵州省习水县富兴牧业有限公司提供。选择健康无病、繁殖性能正常,体重相近的1~2岁单羔(连续2胎产单羔)和多羔(连续2胎产双羔以上)黔北麻羊各3只,屠宰后分别采集单羔、多羔母羊下丘脑、垂体、子宫、输卵管和卵巢5个性腺组织,使用灭菌的锡箔纸包裹组织样品,贴好标签置于液氮中运回实验室,转移至-80 ℃冰箱保存备用。
1.1.2 试剂 TRIzol和逆转录试剂盒购于Thermo Fisher科技公司,qPCR Mix购于美国BIO-RAD公司,胶回收试剂盒购于Axygen生物技术有限公司,DNA Marker 2000购于大连宝生物工程有限公司,LB培养基粉末购于上海生物工程技术服务有限公司,液氮、氯仿、50×TAE 缓冲液、异丙醇、无水乙醇、琼脂糖、氨苄青霉素等购自贵州西宝生物科技有限公司。
1.1.3 主要仪器 包括超微量紫外分光光度计(NANODROP 2000,美国Thermo Fisher)、恒温摇床(MaxQ4000,美国ThermoScientific)、电泳仪(DYY-2C 型,北京六一)、PCR 扩增仪(C1000 TouchTM、美国BIO-RAD)、荧光定量PCR仪(CFX 96,美国BIO-RAD)、凝胶成像系统(Gel Doc XR,美国BIO-RAD)、微量瞬时离心机(D1008E,大龙)、斡旋混匀仪(VORTEX-1,欧莱博)。
1.2 方法
1.2.1 引物设计及合成 根据Genbank公布的山羊CTSK(XM_005677656.3)、FN1(XM_005676508.3)及β-acting基因 mRNA序列,利用Primer Premier 5.0引物设计软件设计荧光定量 PCR引物,由上海擎科生物科技有限公司合成,引物序列信息见表1。

表1 qPCR引物序列信息Table 1 Primer sequence information of qPCR
1.2.2 RNA的提取及cDNA的合成 利用TRIZOL法提取组织RNA,超微量紫外分光光度计检测RNA质量,随后通过HiFi Saript逆转录试剂盒合成cDNA,逆转录体系为20 μL,体系为5×RT Buffer 4 μL、RibolockRnose Inhibitor 1 μL、10 mmol/L dNTP Mix 2 μL、RevertAid M-MuLURT 1 μL、RNase-Free water补充至20 μL。反应条件:42 ℃,60 min;70 ℃,5 min,最后将反应产物置于-20 ℃冰箱保存备后续试验。
1.2.3 qPCR检测 采用qPCR检测CTSK、FN1基因在单羔、多羔黔北麻羊下丘脑、垂体、卵巢、输卵管、子宫性腺组织中表达水平。将逆转录得到的各组织cDNA稀释至等浓度作为模板,反应体系为10 μL:qRT-PCR mix 5 μL、cDNA模板1 μL、上下游引物(100 μmol/L)各0.5 μL、ddH2O 3 μL。反应条件:95 ℃预变性 2 min,95 ℃变性 15 s,60 ℃退火 30 s,70 ℃延伸30 s并添加机器自带的熔解曲线,以β-acting为内参基因,每组3个重复进行qPCR反应。
1.3 数据处理及生物信息学分析
qPCR数据采用SPSS 19.0进行统计分析,图表采用GraphPad Prism5进行处理。在t检验中,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);在进行多重比较分析时,不同字母表示差异极显著(P< 0.01),相同字母表示差异不显著(P> 0.05)。使用Expasy网站中的ProtParam(https://web.expasy.org/protparam/)工具分析CTSK、FN1蛋白理化性质;运用SignalP-5.0Server(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽;使用PSOR(http://psort1.hgc.jp/form.html)预测蛋白亚细胞定位;SOPMA和SWISS预测蛋白二级和三级结构;使用Megalign进行不同物种同源性比较;用MEGA7.0构建不同物种系统发育进化树。
2 结果与分析
2.1 CTSK、FN1基因在黔北麻羊单羔、多羔性腺轴中的表达水平
从图1看出,CTSK基因在单羔组及多羔组黔北麻羊的卵巢、下丘脑、子宫、输卵管和垂体中均有表达。在单羔组中,CTSK基因在卵巢组织中的表达最高,极显著高于其他组织,在垂体和输卵管中的表达最低;在多羔组中,CTSK基因在卵巢中表达最高,极显著高于其他组织,在输卵管、下丘脑、子宫和垂体中的表达较低且差异不显著。CTSK基因在单羔组卵巢、下丘脑、子宫中的表达均极显著高于多羔组,在垂体和输卵管中的表达差异不显著。FN1基因在单羔组及多羔组卵巢、下丘脑、子宫、输卵管和垂体中均有表达。在单羔组中,FN1基因在输卵管中的表达量最高,极显著高于其他性腺轴组织,在垂体、下丘脑和子宫中的中的表达量较低,且差异不显著。在多羔组中,FN1基因在子宫组织中的表达量最高,极显著高于其他性腺轴组织,在输卵管和垂体中的表达量最低。FN1在多羔组丘脑和子宫组织中的表达极显著高于单羔组,在卵巢中的表达量显著高于单羔组,垂体和输卵管中的表达量极显著低于单羔组。
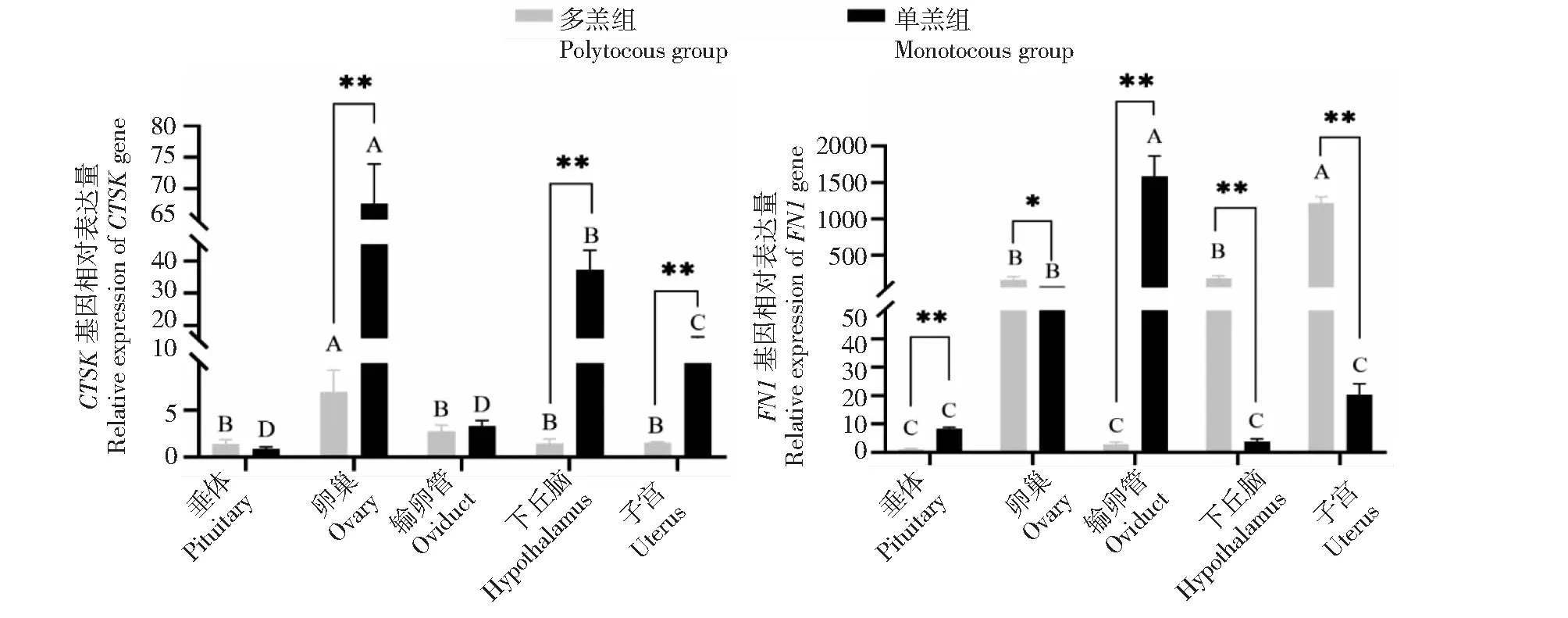
图1 CTSK和FN1基因在黔北麻羊单羔及多羔性腺轴中的表达量Fig.1 Expression of CTSK gene and FN1 gene in gonadal axis of monotocous and polytocous lambs of Qianbei Ma goat
2.2 黔北麻羊CTSK和FN1基因蛋白理化性质
黔北麻羊CTSK基因共编码330个氨基酸,相对分子质量37160.25,化学式C1649H2566N458O490S16,理论PI为8.82,在哺乳动物体中的半衰期约为30 h。其中带负电荷氨基酸残基(Asp + Glu)总数34个,带正电荷的残基总数(Arg + Lys)为41个,说明该基因编码的氨基酸序列带负电荷。该基因的不稳定指数为31.67,为稳定蛋白质(不稳定系数<40),脂肪族指数为77.12,总平均亲水性为-0.523,为亲水性蛋白。
黔北麻羊FN1基因共编码2478个氨基酸,相对分子质量272 070.51,化学式C11912H18545N3317O3814S88,理论PI为5.37,在哺乳动物体中的半衰期约为30h。其中带负电荷氨基酸残基(Asp + Glu)总数为266个,带正电荷的残基总数(Arg + Lys)为206个,说明该基因编码的氨基酸序列带负电荷。该基因的不稳定指数为41.14,为不稳定蛋白质(不稳定系数>40),脂肪族指数为69.79,总平均亲水性为-0.496,为亲水性蛋白。
2.3 黔北麻羊CTSK和FN1基因的亚细胞定位
使用PSOR II Prediction在线软件预测CTSK、FN1蛋白亚细胞定位结果显示,CTSK蛋白定位在细胞外和内质网的可能性为33.3%,定位在线粒体中的可能性为22.2%,定位在囊泡的可能性为11.1%。FN1蛋白定位在细胞核的可能性60.9%,定位在线粒体及细胞外的可能性均为13.0%,小概率定位在囊泡(8.7%)和细胞质(4.3%)中。说明CTSK蛋白可能主要在细胞外和内质网中发挥生物学作用,而FN1蛋白可能主要在细胞核中发挥生物学作用。
2.4 黔北麻羊CTSK和FN1基因信号肽预测
从图2看出,黔北麻羊CTSK蛋白在16~17位(SFA-LY)氨基酸位置有86.23%的可能性出现信号肽切割位点,且是Sec/SPI信号肽的可能性为96.33%;黔北麻羊FN1蛋白在27~28位(AGA-SK)氨基酸位置有34.92%的可能性出现信号肽切割位点,且是Sec/SPI信号肽的可能性为99.35%。说明CTSK和FN1蛋白信号肽均由Sec转运子运输,由信号肽酶Ⅰ(Lep)切割而成,与信号识别有关。
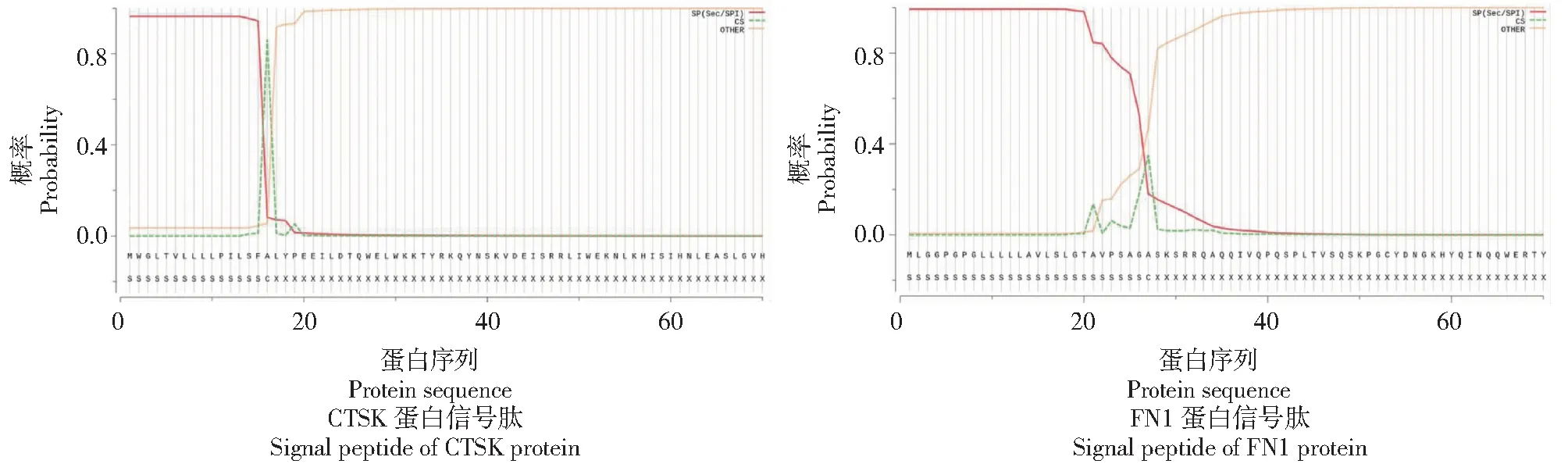
图2 CTSK和FN1蛋白信号肽预测Fig.2 Signal peptide prediction of CTSK protein and FN1 protein
2.5 CTSK和FN1基因的二级和三级结构
从图3看出,黔北麻羊CTSK蛋白质二级结构主要由α-螺旋(32.7%)、β-转角(5.45%)、无规则卷曲(58.47%)与延伸链(29.82%)组成;FN1蛋白质二级结构主要由α-螺旋(5.73%)、β-转角(5.97%)、无规则卷曲(45.45%)与延伸链(16.35%)组成。CTSK蛋白质三级结构主要由α-螺旋与无规则卷曲构成,FN1蛋白质则主要为无规则卷曲及延伸链构成,预测结果与二级结构一致。
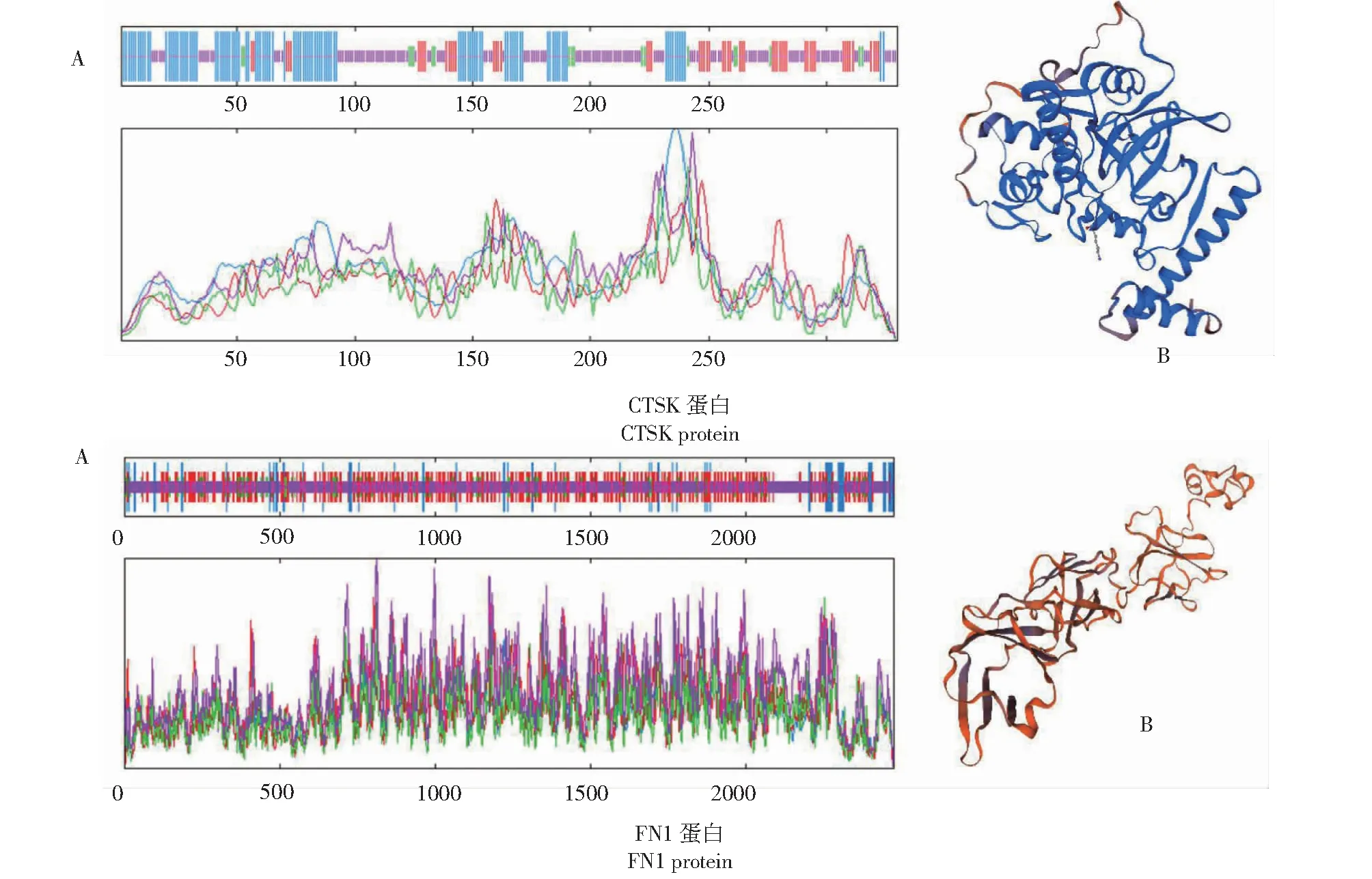
图3 CTSK和FN1蛋白的二级结构(A)和三级结构(B)Fig.3 Secondary structures(A) and tertiary structures (B) of CTSK protein and FN1 protein
2.6 CTSK和FN1基因同源性及遗传距离
将黔北麻羊CTSK、FN1基因氨基酸序列与不同物种氨基酸序列进行同源性比对结果显示,黔北麻羊CTSK基因与绵羊、牛、猪、狗、马、兔、人、鼠和鸡的同源性分别为99.5%、98.4%、95.9%、95.9%、95.4%、94.7%、94.2%、85.7%和74.9%(图4-A);黔北麻羊FN1基因与绵羊、牛、猪、狗、马、人、兔、鼠和鸡的同源性分别为99.7%、99.1%、95.8%、95.2%、95.1%、93.9%、93.3%、91.6%和83.2%(图4-B)。由此可见,黔北麻羊CTSK和FN1基因编码氨基酸序列在不同物种之间具有较高的保守性,均与反刍动物绵羊、牛的同源性最高,与小型动物或非哺乳动物鼠和鸡中的同源性最低。从构建的不同物种CTSK、FN1基因系统进化树结果证实,黔北麻羊CTSK(图5-A)和FN1(图5-B)基因与绵羊、牛等反刍动物遗传距离最近,与鼠和鸡的遗传距离最远。
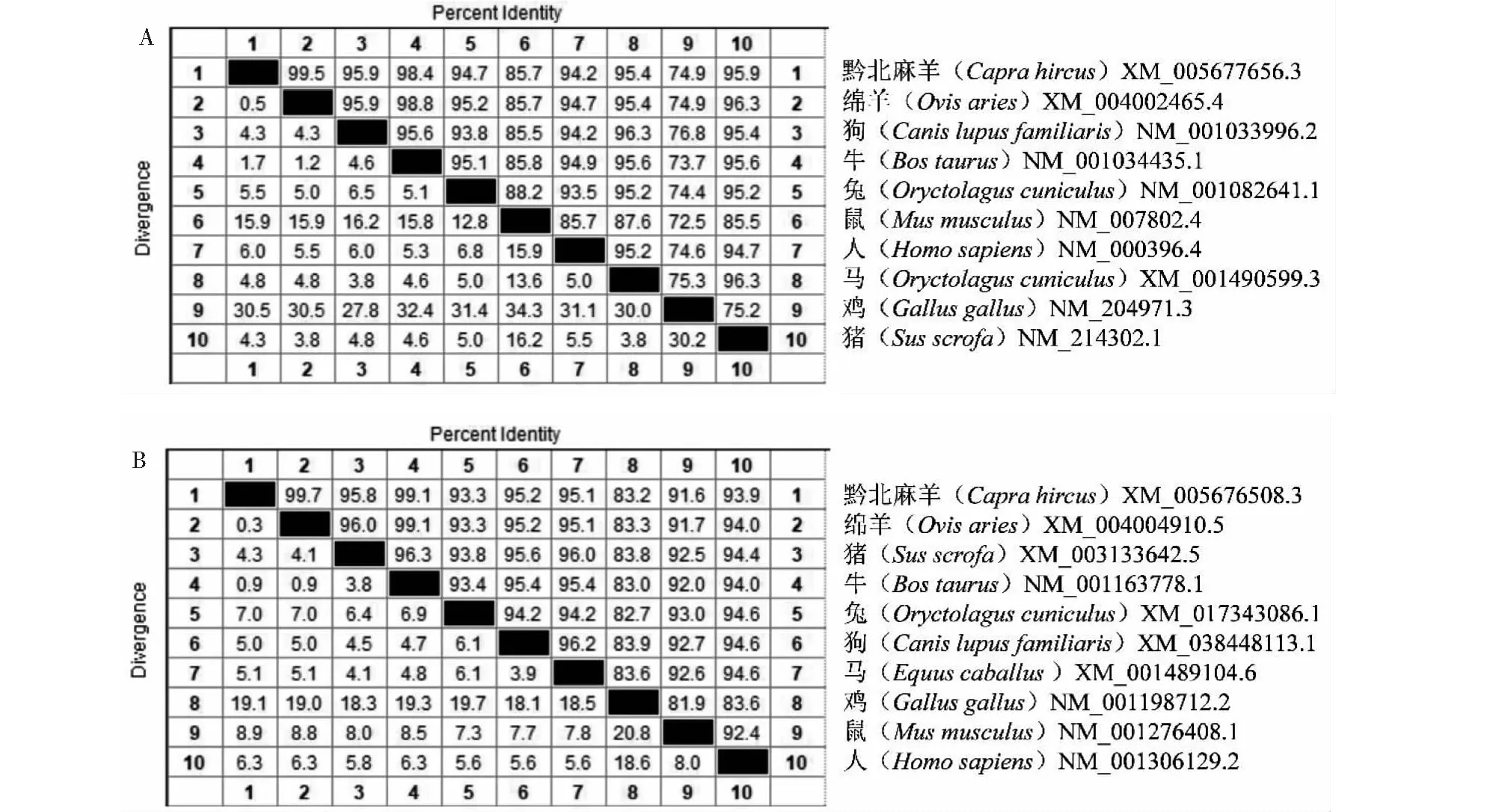
图4 不同物种CTSK(A)和FN1(B)氨基酸序列的同源性Fig.4 Amino acid sequence homology of CTSK (A) and FN1 (B) in different species

图5 不同物种CTSK(A)和FN1(B)氨基酸序列的系统发育进化树Fig.5 Phylogenetic tree of amino acid sequences of CTSK (A) and FN1 (B) in different species
3 讨 论
CTSK基因作为组织蛋白酶家族中被研究得较少的一类,近年来较多的研究方向均为与骨质疏松或牙周炎[7-9]和肿瘤发生[10]等有关,Feng等[11-13]研究认为,CTSK基因是一种骨质疏松靶向蛋白酶,活化的破骨细胞特异性表达成熟CTSK基因,且有助于骨组织的重塑与再吸收,CTSK基因缺乏的骨细胞防止乳汁诱导的骨丢失和甲状旁腺激素抑制,而雌激素可以下调CTSK基因的表达。魏巍等[3]发现,CTSK基因不仅参与机体正常生理调节,而且在多种疾病如实体瘤、关节炎、椎间盘退行性改变等中均异常表达。Li等[14]研究表明,CTSK基因被确定为肠道菌群失衡与结直肠癌转移之间的重要中介,与结直肠癌转移及预后不良相关。但近年来CTSK基因在家畜、山羊上的研究则比较少见。Balatsky等[15]研究表明,肌肉内脂肪含量和嫩度受CTSK等位基因变异的影响,CTSK基因可能与优质瘦肉的生产特别相关。Suárez-Vega等[16]研究发现,CTSK基因还可能与绵羊的奶酪量与品质性状有关。本研究中,qPCR结果显示,CTSK基因在单羔组卵巢、下丘脑、子宫中的表达均极显著高于多羔组,这与 Balboula[17]的研究一致;Balboula等研究发现,与质量较差的胚胎相比,优质胚胎或优质卵裂球表现出更强的自噬活性和较少的CTSK基因活性,且抑制CTSK基因会降低IVP牛胚胎的发育率(增加囊胚和孵化率)和质量(增加细胞总数和降低凋亡细胞百分比),此外,下丘脑-垂体-卵巢轴通过调节激素分泌对哺乳动物卵巢卵泡的发育具有重要影响[18-20],而CTSK基因在单羔组卵巢和下丘脑组织中高表达,说明CTSK基因可能与胚胎质量和卵泡发育具有负向调控关系。
FN1基因作为纤维连接蛋白家族中的一员,是一种参与细胞粘附和迁移过程的糖蛋白,被普遍研究认为与癌症的发生途径有关。在癌症病例中,FN1基因的高表达往往被视为预后不良,FN1基因在GAC肿瘤组织中的表达水平均显著高于正常组织[21]。Qiu等[22]研究发现,FN1在甲状腺乳头状癌(PTC)进展中发挥重要作用,可能作为PTC预后的标志物。在生殖过程中FN1基因也发挥着不同的功能,如受精和着床。FN1基因的表达从桑椹胚到囊胚早期显著增加,这表明FN1基因可能也参与了早期囊胚的形成。Goossens等[23]研究认为,FN1可能在囊胚形成过程中发挥特定的功能,胚胎FN1基质具有黏附性,将细胞连接在一起,并为细胞层迁移提供底物。Cai等[24]研究发现,敲低FN1基因能显著抑制结肠癌细胞的增殖和迁移;樊庆灿[25]对鸡胚的研究表明,FN1基因通过结构域与细胞表面受体、纤维蛋白等特异性结合,调控细胞的迁移、分化和黏附,参与胚胎细胞分化和器官形成,在胚胎发育中起到重要的调节作用。本研究表明,FN1基因在多羔组下丘脑、子宫和卵巢组织中的表达均显著高于单羔组,推测FN1可能通过卵巢及子宫细胞的增殖及迁移,促进胚胎发育,与动物繁殖性状可能具有正向调控关系。因此,CTSK和FN1基因作为影响黔北麻羊繁殖力高低的重要候选基因还需作进一步的研究。
4 结 论
CTSK、FN1基因分别编码330和2478个氨基酸,理论PI分别为8.82和5.37,CTSK是一种具有信号肽的稳定亲水性蛋白,而FN1是一种具有信号肽的不稳定亲水性蛋白;亚细胞定位结果说明:CTSK蛋白可能主要在细胞外和内质网中发挥生物学作用,而FN1蛋白可能主要在细胞核中发挥生物学作用;高级结构预测结果显示,CTSK和FN1蛋白均主要由无规则卷曲构成;与其他动物相比,黔北麻羊CTSK、FN1基因均与反刍动物绵羊及牛的亲缘关系最近。qPCR表明:CTSK和FN1基因在单羔组及多羔组黔北麻羊的卵巢、下丘脑、子宫、输卵管和垂体中均有表达;CTSK基因在单羔组卵巢、下丘脑、子宫中的表达均极显著高于多羔组,在垂体和输卵管中的表达差异不显著(P>0.05);FN1在多羔组丘脑和子宫组织中的表达极显著高于单羔组,在卵巢中的表达量显著高于单羔组(P<0.05),在垂体和输卵管中的表达量极显著低于单羔组。CTSK基因表达量与黔北麻羊的繁殖性状有一定的负相关,FN1基因表达量与黔北麻羊的繁殖性状有一定的正相关,两者均与动物繁殖性状密切相关。
